Salinité
La salinité désigne la quantité de sels dissous dans un liquide, notamment l'eau qui est un puissant solvant pour de nombreux minéraux.

Il ne faut pas confondre la salinité avec la dureté de l'eau qui est relative à son dosage en calcium et magnésium.
Propriétés chimiques
Le sel dissous modifie les propriétés de l'eau, en premier lieu sa capacité de dissolution, sa densité, mais aussi sa compressibilité, son point de congélation et d'ébullition, sa conductivité électrique, sa dureté ainsi que sa viscosité ou sa corrosivité, et très légèrement sa capacité à transporter les sons et la lumière. La quantité de sels dissous dans un liquide modifie la pression osmotique de celui-ci.
Concentration massique
À une température donnée, la salinité ne peut dépasser un seuil de concentration massique, au-delà duquel le liquide ne peut plus dissoudre du sel et des cristaux se forment, au fond du récipient ou en périphérie de la surface.
Le seuil de concentration massique augmente avec la température, ce qui fait que l'eau très chaude peut contenir beaucoup plus de sel dissous que l'eau froide.
Il augmente aussi avec la pression. La salinité approche par exemple 300 g/litre dans le forage pétrolier-gazier profond d'Elgin-Franklin en mer du Nord, ce qui pose des problèmes de formation rapide de tartre dans les installations[1].
Mesure de la salinité
La salinité est difficilement estimable (elle n'est pas à proprement parler mesurable puisqu'il n'y a pas d'étalon auquel on puisse comparer un échantillon) par analyse chimique directe, c’est-à-dire par séchage, à température élevée, et pesée du résidu solide, car certains composés présents comme les ions carbonate s'évaporent en fin de séchage. Sachant que les proportions des constituants principaux de l'eau de mer sont quasiment constantes, le seul dosage de l'un d'entre eux permet de déduire la teneur de tous les autres, et une évaluation de la salinité. Les ions chlorure, bromure et iodure sont facilement dosables, par exemple par précipitation permettant un titrage au nitrate d'argent. Ils suffisent aux analyses. Ceci ne vaut pas pour les zones situées à proximité des pôles ou des estuaires, en aval d'usines de dessalement, de sources marines d'eau douce ou de remontées d'eaux salines d'origine volcanique parce que la proportion des différents ions y est modifiée par rapport à celle de l'eau de mer « normale ».
La salinité est depuis 1978 officiellement mesurée à partir de la conductivité électrique de l'eau à une certaine température et pression. La salinité (S) d'un échantillon d'eau est donnée par le rapport K de la conductivité électrique de cet échantillon d'eau de mer à 15 °C et à la pression atmosphérique normale, avec la conductivité d'une solution de chlorure de potassium (KCl) dans laquelle la fraction en masse de KCl est 0,0324356, à la même température et même pression. Si ce rapport K est égal à 1 on dit que la salinité est de 35. La salinité n'est plus présentée comme un rapport de masse. Elle s'exprime sans unité, comme le pH, mais on trouve encore des salinités exprimées en ‰, en g/kg ou en psu (practical salinity unit).
Salinité des océans
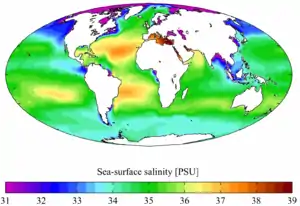
Climatologie
L'eau des océans est une solution qui contient en moyenne 35 g/kg de sels divers (chlorure de sodium essentiellement), avec un pH très stable de 8,2 (légèrement alcalin), mais qui tend à s'acidifier en dissolvant le CO2 d'origine anthropique en excès dans l'air. La Mer Morte contient beaucoup plus de sels, ce qui explique qu'on y flotte sans effort, alors que la Mer Baltique en contient beaucoup moins, ce qui explique qu'elle gèle plus vite. Néanmoins, hormis dans les mers fermées, on a montré au début du XXe siècle que la proportion des composants les plus importants reste quasi constante, ce qui laisse penser que depuis des millions d'années et plus sans doute, les océans ont été parfaitement mélangés par la circulation thermohaline, avec l'aide (importance non déterminée) de certaines espèces de plancton qui par leurs mouvements quotidiens et saisonniers contribuent à homogénéiser les couches thermiques et salines. La relativement faible occupation spatiale du phytoplancton dans la colonne d'eau, cantonnée essentiellement à la zone euphotique, limite son influence sur l'homogénéisation de la colonne d'eau océanique atteignant régulièrement plusieurs milliers de mètres de hauteur.
Ceci indiquait, qu'en plus des circulations particulières à chaque océan, l'eau circulait entre les différents océans, ce qui a été confirmé par la courantologie.
Quantités : le volume des océans est estimé à 1 370 millions de kilomètres cubes. Il contiendrait donc environ 48 millions de milliards (ou 4,8 × 1016) de tonnes de sels pour une masse océanique totale de 1,4 milliard de milliards (ou 1,4 × 1018) de tonnes. Cela représenterait 95 t/m2 si on étalait ce sel sur le globe entier (environ 510 millions de kilomètres carrés), ou encore 320 t/m2 si on ne l'étalait que sur les parties actuellement émergées (près de 150 millions de kilomètres carrés).
| Anions (en g/kg) | Cations (en g/kg) | ||
|---|---|---|---|
| Chlorure (Cl−) | 18,9799 | Sodium (Na+) | 10,5561 |
| Sulfate (SO42−) | 2,6486 | Magnésium (Mg2+) | 1,2720 |
| Hydrogénocarbonate (HCO3−) | 0,1397 | Calcium (Ca2+) | 0,4001 |
| Bromure (Br−) | 0,0646 | Potassium (K+) | 0,3800 |
| Fluorure (F−) | 0,0013 | Strontium (Sr2+) | 0,0135 |
Effet de la salinité sur la densité
La densité de l'eau salée est une fonction non linéaire de la température et de la salinité. Au premier ordre, la densité peut être évaluée par :
Où et sont des constantes positives, donc la densité diminue quand la température augmente et elle augmente quand la salinité augmente.
L'amplitude des variations relatives de température étant sur la majeure partie des mers du globe supérieures à celles de salinité, l'effet de la salinité est souvent moindre que celui de la température. La salinité ne joue alors un rôle que quand ses variations sont assez fortes, souvent à cause d'un fort apport d'eau douce, ou que les variations de température sont faibles, souvent à cause de la proximité du point de congélation de l'eau de mer. Le premier cas se rencontre localement dans les mers tropicales, proche de l'embouchure de grands fleuves comme l'Amazone ou en Afrique équatoriale mais également en Mer Noire. Le deuxième cas se rencontre dans les mers polaires arctiques et antarctiques, quand la fonte de la banquise et des calottes polaire induit un apport d'eaux fraîches (peu salées) en surface tandis que les eaux plus profondes sont plus salées et plus chaudes[2].
La stratification des océans liée à une densité d'eau variable dans la colonne d'eau amène à la formation de pycnocline, c'est-à-dire un gradient fort des isopycnes, les lignes d'iso-densité. Lorsque cette pycnocline est contrôlée par la salinité, on parle d'haliocline, tandis que lorsqu'elle est contrôlée par la température, on parle de thermocline. Dans les régions polaires, l'halocline peut être si marquée qu'elle peut être le support d'ondes internes, pouvant mener à un phénomène dit « d'eaux mortes » [3]. Dans les mers tropicales, l'apport d'eaux douces peut former une légère halocline en sub-surface sous la couche mélangée de surface, et on parle alors de « barrière de sel ». L'halocline en Mer Noire est également très forte[4].
L'effet de la salinité sur la densité de l'eau de mer joue également un rôle très important dans la circulation thermohaline globale, en faisant plonger aux hautes latitudes les eaux plus salées apportée depuis les latitudes moyennes, lorsque celles-ci se refroidissent[5]. On forme ainsi aux hautes latitudes les eaux profondes qui remplissent ensuite tous les bassins abyssaux de la planète. Ce mécanisme forme un des puits de carbone de la circulation en stockant en profondeur des eaux initialement en surface.
Ce mécanisme peut être accentuée par l'augmentation de la concentration en sel lors de la formation de banquise de mer : le sel étant rejeté dans l'eau encore libre, celle-ci augmente alors de densité. C'est ainsi que les eaux de fond d'origine antarctique figurent parmi les eaux les plus denses de la planète, atteignant des températures potentielles négative et une densité potentielle de 1,046[6].
Enfin certains courants même aux latitudes tempérées ou tropicales sont contrôlées par des variations de densité dues à la salinité, principalement à cause de forte évaporation. Un exemple connu est le courant de Leeuwin sur la côte Ouest de l'Australie[7].
 Séparation Eau douce Eau salée en Méditerranée à Nice après une grosse averse de montagne
Séparation Eau douce Eau salée en Méditerranée à Nice après une grosse averse de montagne
Voir aussi
Articles connexes
Liens externes
Bibliographie
Notes et références
- (en)K. Orski, B. Grimbert, C. Menezes & E. Quin (2007), Fighting Lead and Zinc Sulphide Scales on a North Sea HP/HT Field ; Total E&P UK Ltd. ; European Formation Damage Conference, 30 May-1 June 2007, Scheveningen, Pays-Bas ; (ISBN 978-1-55563-160-4) Society of Petroleum Engineer (résumé).
- « Miers », ADLFI. Archéologie de la France - Informations, (ISSN 2114-0502, DOI 10.4000/adlfi.10977, lire en ligne, consulté le )
- M. J. Mercier, R. Vasseur et T. Dauxois, « Resurrecting dead-water phenomenon », Nonlinear Processes in Geophysics, vol. 18, no 2, , p. 193–208 (ISSN 1607-7946, DOI 10.5194/npg-18-193-2011, lire en ligne, consulté le )
- Emil V. Stanev, « On the mechanisms of the Black Sea circulation », Earth-Science Reviews, vol. 28, no 4, , p. 285–319 (ISSN 0012-8252, DOI 10.1016/0012-8252(90)90052-w, lire en ligne, consulté le )
- Robert R. Dickson et Juan Brown, « The production of North Atlantic Deep Water: Sources, rates, and pathways », Journal of Geophysical Research, vol. 99, no C6, , p. 12319 (ISSN 0148-0227, DOI 10.1029/94jc00530, lire en ligne, consulté le )
- Kevin G. Speer et Walter Zenk, « The Flow of Antarctic Bottom Water into the Brazil Basin », Journal of Physical Oceanography, vol. 23, no 12, , p. 2667–2682 (ISSN 0022-3670 et 1520-0485, DOI 10.1175/1520-0485(1993)023<2667:tfoabw>2.0.co;2, <2667:tfoabw>2.0.co;2 lire en ligne, consulté le )
- Mary L. Batteen et Ming-Jer Huang, « Effect of salinity on density in the Leeuwin Current System », Journal of Geophysical Research: Oceans, vol. 103, no C11, , p. 24693–24721 (ISSN 0148-0227, DOI 10.1029/98jc01373, lire en ligne, consulté le )
- Portail de la chimie
- Portail du monde maritime
- Portail de l’écologie