Rhizopus stolonifer
Rhizopus stolonifer est une espèce de champignons de la famille des Rhizopodaceae, sous-division des Mucoromycotina[n 1], taxon comprenant la majorité des espèces anciennement classées parmi les Zygomycota[n 2]. Il est responsable de pourritures molles et liquides sur divers fruits et légumes (fraises, raisin, tomates...) ainsi que de la moisissure noire, observée communément à la surface du pain et d'autres aliments amylacés[2].
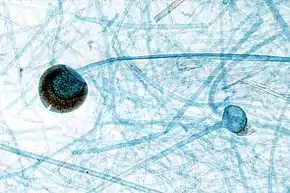
Sporocyste avec columelle apparente
| Règne | Fungi |
|---|---|
| Division | Zygomycota |
| Sous-division | Mucoromycotina |
| Ordre | Mucorales |
| Famille | Rhizopodaceae |
| Genre | Rhizopus |
Mucor stolonifer Ehrenb., (1818)
Mucor mucedo L. (1753)
Mucor artocarpi Berk. & Broome (1875)
Mucor ascophorus Link (1824)
Rhizopus artocarpi Racib. (1900)
Rhizopus nigricans Ehrenb. (1821)
Ascophora mucedo (L.) Tode (1790)...
(d'après Species Fungorum[1])
Cette moisissure est connue sous le nom de moisissure chevelue (au Canada[3],[4]) et de moisissure noire du pain[5].
C'est une espèce cosmopolite, présente partout dans le monde.
Écologie
Rhizopus stolonifer est de loin, l'espèce la plus commune de l'ordre des Mucorales à se développer sur les produits alimentaires[6]. C'est une moisissure qui croît rapidement à 25 °C et couvre une boîte de Petri d'un mycélium noir et lâche, en quelques jours. Elle produit des fructifications aériennes, de couleur d'abord blanche puis devenant noire.
Rhizopus stolonifer est un saprophyte ubiquiste, se développant sur des végétaux et des produits alimentaires comme[7] :
- les légumes : pois, carottes, concombre, courgette, tomates, aubergines, patates douces...
- les fruits : fraises, raisins, abricots, pêches, prunes, melon...
- les céréales : blé, orge, cacahouète, noisettes...
- les fromages
- le pain et toutes sortes d'aliments amylacés.
Il survit[8] très facilement sur ou dans le sol ou sur les débris végétaux et peut s'y maintenir plusieurs années sous les formes de spores, zygospores ou de mycélium. Outre l'altération de fruits, légumes et céréales, il provoque aussi une pourriture des racines d'arbres fruitiers, notamment les agrumes.
On trouve de plus Rhizopus stolonifer dans les entrepôts sur le matériel de conditionnement et de stockage des fruits. Le moisissement des végétaux apparait après la récolte. Pour prévenir leur détérioration, un traitement fongicide au thiabendazole (Benlate) ou de Dicloran[6] est parfois appliqué.
.jpg.webp)
Rhizopus stolonifer pénètre dans les fruits par l'intermédiaire de la moindre blessure puis les envahit avec son mycélium. Pour se multiplier par voie asexuée, il sort en surface afin de sporuler. Les spores émises sont disséminées par le vent sur de longues distances, ainsi que par l'eau, les ouvriers ou les insectes, comme par la mouche du vinaigre Drosophila melanogaster[8].
Il apprécie une température de 23−28 °C et une humidité élevée[9]. Les conditions humides et chaudes d'août et septembre sont très favorables à son développement. Il croît entre 5 °C et 30 °C (Schipper[10] 1984) avec un optimum vers 25 °C. À cette température et une activité en eau aw=0.99, la croissance radiale atteint 2 mm/h et environ 5 cm/jour[6]. Comme d'autres espèces de Mucorales, R. stolonifer peut croître en anaérobie.
La détérioration des produits alimentaires tient plus à la pourriture engendrée en profondeur qu'aux manifestations de surface de la moisissure. Une tomate blessée qui a été attaquée par Rhizopus stolonifer va voir ses tissus se liquéfier peu à peu en quelques jours, sous l'effet de la décomposition de la matière organique. Les tissus affectés prennent un aspect translucide et une teinte sombre, se liquéfient et finissent par s'effondrer[7].
Pour se nourrir, la moisissure doit digérer à l'extérieur la matière organique avant de pouvoir l'ingérer par l'intermédiaire de protéines qui traversent la membrane plasmique (nommées transporteurs). De nombreuses enzymes sont excrétées par Rhizopus stolonifer, comme des enzymes pectolytiques qui hydrolysent la pectine et contribuent à la décomposition des tissus végétaux[11]. Même après une irradiation qui aura tué le champignon et stoppé sa croissance mycélienne, les enzymes pectolytiques qui ont été produites dans le substrat continueront un certain temps à digérer les substances nutritives.
Caractères morphologiques
La morphologie de l'anamorphe se caractérise par une hyphe siphonnée (sans cloison pour séparer les noyaux), multinucléée, à noyaux haploïdes, possédant une paroi de chitine et de glucanes, et ayant une croissance apicale. Le protoplasme renferme de nombreuses vacuoles qui poussent le cytoplasme et les noyaux à la périphérie. Les réserves de nourriture sont stockées sous forme de glycogène et de lipide.
Au moment de la reproduction, ou après une blessure, des septa (cloisons) sont formées.
En tant qu'hétérotrophe, R. stolonifer dépend de sucre ou d'amidon comme source de carbone pour son alimentation ; il croît et tire ses matières nutritives de substances vivantes ou mortes.
Le genre Rhizopus se caractérise parmi les autres genres de l'ordre des Mucorales[6] par :
- la formation d'appendices en forme de racines, nommés rhizoïdes ; ils se forment à la base des sporocystophores (ou sporangiophores) et servent à fixer le mycélium sur le substrat ;
- les sporocystophores sont non ramifiés et groupés par 3 à 5 ;
- la présence de stolons, hyphes aériennes grâce auxquelles le champignon se dissémine ;
- le sporocyste comporte dans le prolongement de l'axe du sporocystophore, une formation globuleuse, appelée la columelle, qui s’effondre en une structure en forme d'ombelle avec l'âge (voir dessin 4a. section suivante) ;
- par des spores (sporangiospores) sont sèches et munies de parois épaisses et striées.

R. stolonifer croît lentement ou pas du tout à 36 °C alors que R. oryzae, R. oligosporus, et R. microsporus croissent rapidement[6]. De plus les spores de R. stolonifer sont plus grosses (8-20 μm) que celles des trois autres Rhizopus cités (<8 μm).
Le mycélium est lâche, extensif, cotonneux devenant brun-noir à maturité. Lorsqu'il envahit le substrat, il se manifeste comme une moisissure duveteuse blanchâtre puis grise. À la loupe binoculaire, on distingue clairement les fructifications noirâtres (sporocystophore et sporocystes).
La moisissure Rhizopus stolonifer se manifeste sous trois formes différentes au cours de son cycle de développement. Elle passe par les stades spores, zygospores et mycélium et leur germination et fructifications respectives. Les spores et zygospores sont chacune constituées par une cellule multinuclée, entourées d'une paroi épaisse la protégeant de l'environnement. Les noyaux de la spore sont haploïdes, ceux de la zygospore diploïdes. La germination d'une spore donne une hyphe, la germination d'une zygospore donne un sporocyste, formation qui ensuite produit des spores.
Biologie des cycles de reproduction sexué et asexué

Le développement Rhizopus stolonifer se fait suivant deux cycles :
- un cycle sexué, passant par les étapes spore → mycélium → caryogamie → zygospore → germination ; lorsque la survie devient difficile en raison de la diminution des ressources nutritives, le mycélium produit par croisement hétérothallique une zygospore, capable de rester en dormance plusieurs mois avant de germer et de redonner des spores
- un cycle asexué, court, où le mycélium produit des sporocystes engendrant un grand nombre de spores, libérées à l'air libre et pouvant être emportées par le vent ou l'eau afin de propager immédiatement la moisissure.
La phase diploïde des cycles de développement du champignon est limitée au passage par la zygospore.
| Les cycles de reproduction de Rhizopus stolonifer | |
|---|---|
1. Spores : une fois mature, les spores (ou sporangiospores) contiennent plusieurs noyaux haploïdes[12]. Elles contiennent aussi des mitochondries, des vésicules (sphérosomes lipidiques et protéiques), des vacuoles et de nombreux ribosomes. Une épaisse paroi, extérieurement striée de longues crêtes proéminentes, recouvre la membrane plasmique et renferme le protoplasme. Les spores sont produites par un sporocyste qui peut aussi bien être issu d'une fructification du mycélium que de la germination d'une zygospore. |
 Spore germante (en coupe) |
2. Germination de la spore : à une température favorable d'environ 25 °C et dans un milieu nutritif humide et aéré, la spore subit des changements structuraux qui se manifestent par l'apparition d'un tube germinatif : on dit alors qu'elle germe. Au début, on observe dans la spore une augmentation de la consommation d'oxygène O2, de la synthèse d'ARN, de ribosomes, de protéines, puis d'ADN. Ces biosynthèses s'accompagnent d'une réplication des noyaux, d'un accroissement en nombre et en taille des mitochondries et d'un grossissement des vacuoles, le tout résultant finalement en une augmentation de volume de la spore puis en l'émergence du tube germinatif[12],[13]. |
 Spore non germée et spore germante |
| 3. Formation du mycélium : l'élongation du tube germinatif produit une hyphe. Lorsque celle-ci se développe à la surface du substrat, à intervalles réguliers, apparaissent des systèmes de fixation appelés rhizoïde (car ressemblant à des racines) qui s'enfoncent dans le substrat et au-dessus duquel, émergent des fructifications, nommées sporocystophores (ou sporangiophores). L'hyphe qui se projette en avant est nommée stolon car ce filament courant à la surface et attaché régulièrement, évoque un modèle réduit de stolon de fraisier. Le filament mycélien après avoir décrit une arcade, retombe et se termine en cône qui bourgeonne, d'abord en crampons inférieurs puis plus tard en sporocystophores[14]. Les crampons rhizoïdes sont toutefois seulement un système de fixation et ne sont pas semblables aux des racines des plantes : rappelons que la stratégie nutritive du champignon consiste à faire pénétrer les substances organiques et minérales à l'état dissout grâce à des transporteurs membranaires[2]. L'hyphe croît très rapidement au niveau de son apex et se ramifie pour envahir au mieux le substrat. La propagation se fait non seulement en surface, mais le mycélium pénètre aussi à l'intérieur du substrat. Lorsque R. stolonifer attaque par exemple une baie de raisin[9], il déploie son mycélium de façon très extensive, dans toutes les directions à l'intérieur de la chair qui se décomposera alors progressivement sous l'effet des enzymes libérées. |  Mycélium interne et sortie de stolon, ancré par un rhizoïde |
| La reproduction asexuée | |
|---|---|
| 4a. Production de sporocystophores : les stolons courant en surface, émettent au-dessus des rhizoïdes, quelques tiges dressées nommées sporocystophores (ou sporangiophores). Celles-ci développent à leur extrémité une (et une seule) formation globulaire, nommée sporocyste (ou sporangium). Couvert d'une mince paroi pigmentée, incrustée de fins cristaux en aiguilles qui lui donnent un aspect hérissé[2], le sporocyste contient de nombreuses spores haploïdes et sans flagelle, résultant de la division du contenu cytoplasmique initial.
Les noyaux et vacuoles, qui au début étaient disposés aléatoirement à l'intérieur du sporocyste, finissent par se réorganiser : les noyaux vont à la périphérie et les vacuoles au centre[15]. Celles-ci fusionnent en une forme aplatie en dôme qui se remplit de substance formant une cloison (septum). Elle sépare la région distale contenant les noyaux qui vont devenir les spores, d'une région centrale, de forme cylindrique ou globuleuse, nommée la columelle. Les noyaux après s'être multipliés par division mitotique, s'invaginent dans la membrane plasmique pour donner des spores. De son côté, la columelle se développe et exerce une pression sur la mince paroi du sporocyste jusqu'à la faire éclater et laisser la voie libre aux spores. Une fois les spores dispersées, la columelle se dégonfle et prend la forme d'une ombelle. |
 Production de spores dans les sporocystes |
| La reproduction sexuée | |
|---|---|
| La reproduction sexuée est rare dans la nature, elle apparaît quand le milieu s'appauvrit en matières nutritives, généralement à la fin de la période de croissance. 4b. Formation de gamétocystes : chez R. stolonifer, la fécondation se fait entre gamètes provenant d'hyphes de types de croisement différents (noté + et -), on la qualifie d' hétérothallique. Deux filaments génétiquement compatibles s'approchent l'un de l'autre en émettant des diverticules jusqu'à établir un contact. Chacun de ces diverticules s'isole ensuite du filament (qui lui a donné naissance) par une paroi[16]. Les noyaux haploïdes ainsi dissociés du reste du mycélium vont jouer le rôle de gamètes (+ ou -) dans la fécondation qui se prépare. On appelle donc cette structure un gamétocyste[2]. Chacun est relié à l'hyphe par un suspenseur, formé par le reste du diverticule. |
 |
|
5b. Plasmogamie : la paroi qui séparait les deux gamétocystes (+ et -) en contact commence à se désintégrer. La fusion des deux gamétocystes (ou plasmogamie) résulte en une structure qui enfle en zone équatoriale, nommée un cénozygote. Les noyaux + et - issus des deux gamétocystes restent côte à côte sans fusionner. C'est le stade dicaryotique à n+n chromosomes. Les noyaux s'associent par paires (+,-) et ceux qui restent en surnombre dégénèrent. |
 |
| 6b. Caryogamie : les noyaux appariés subissent la caryogamie ou fécondation. On nomme alors zygospore, la structure qui contient cet ensemble de noyaux diploïdes. La zygospore est munie d'une paroi épaisse et verruqueuse, lui permettant de résister à des conditions environnementales défavorables. La zygospore se distingue de la (sporangio)spore par le fait qu'elle contient des noyaux diploïdes (alors qu'ils sont non haploïdes pour la spore) et qu'elle est en forme de grosse barrique couverte de "verrues"[16] . Elle entre ensuite en vie ralentie, pendant 5 à 9 mois[15]. C'est la seule phase diploïde dans le cycle de vie de R. stolonifer. |  |
7b. germination de la zygospore : la germination commence en présence d'eau, les noyaux diploïdes subissent une méiose, contribuant à la formation de noyaux haploïdes. On voit alors apparaître un tube germinatif dans lequel montent les noyaux haploïdes. À l'extrémité se développe une formation enflée, le sporocyste de germination (germ sporangium), dans lequel les noyaux continuent à se diviser. Contrairement au sporocyste de la multiplication asexuée, ce sporocyste n'a pas de columelle. Des spores au début mononucléées se forment puis deviennent éventuellement polynucléées (c'est-à-dire cénocytiques), en raison d'une division nucléaire libre[15]. À maturité, la paroi du sporocyste éclate et libère les spores. Une moitié sont de la souche +, l'autre de la souche -. Le cycle sexué se boucle par un retour à l'étape 1. |
 Micrographie de zygospores
|
Notes
- La sous-division des Mucoromycotina est classiquement rattachée aux Zygomycota, mais selon Hibbett et al. (Mycological Research, vol. 111, no 5, 2 mars 2007, p. 509-547), sa position systématique n'est pas encore déterminée (incertae sedis)
- cette ancienne division est maintenant considérée comme artificielle car polyphylétique (O'Donnell et al., Mycologia, 93(2), 2001)
Références
- species fungorum
- P. Bouchet, J.-L. Guignard, Y.-F. Pouchus, J. Villard, Les champignons, Mycologie fondamentale et appliquée, Masson (2e édition),
- T. J. Avis, « Effect of chlorine atmospheres on the development of rhizopus rot Rhizopus stolonifer and gray mold Botrytis cinerea on stored strawberry fruits », Canadian journal of plant pathology, vol. 28, no 4, , p. 526-532 (ISSN 0706-0661, lire en ligne)
- Comité permanent de nomenclature française des maladies des plantes au Canada, Noms des maladies des plantes au Canada, Agriculture Québec,
- Univ-Brest
- (en) John I Pitt, Ailsa D Hocking, Fungi and food spoilage, New York, Springer-Verlag, , 519 p. (ISBN 978-0-387-92207-2 et 0387922075, lire en ligne)
- INRA ephyta
- Dominique Blancard, Henri Laterrot, Georges Marchoux, Thierry Candresse, Les maladies de la tomate identifier, connaître, maîtriser, Versailles, Ėditions Quæ,
- INRA ephytia
- (en) M. A. A. (Maria A. A.) Schipper, J. A. (Joost Augustinus) Stalpers, A revision of the genus Rhizopus : by M.A.A. Schipper, Baarn, Centraal bureau voor Schimmelcultures, coll. « Studies in mycology ; no. 25. », (ISBN 90-70351-04-8)
- N. F. Sommer, « Production of Pectolytic Enzymes by Rhizopus stolonifer Sporangiospores After "Lethal" Gamma Irradiation », Applied Microbiology, vol. 11, no 6, , p. 463-466 (ISSN 0003-6919, lire en ligne, consulté le )
- Patricia M. Buckley, « Ultrastructural Details in Germinating Sporangiospores of Rhizopus stolonifer and Rhizopus arrhizus », Journal of Bacteriology, vol. 95, no 6, , p. 2365-2373 (ISSN 0021-9193, lire en ligne)
- James L. Van Etten, « Physiological and Morphological Correlation of Rhizopus stolonifer Spore Germination1 », Journal of Bacteriology, vol. 117, no 2, , p. 882-887 (ISSN 0021-9193, lire en ligne)
- MycoBank
- rhizopus sakshieducation
- Hsiao-Man Ho and Zuei-Ching Chen, « Ultrastructural study of wall ontogeny during zygosporogenesis in Rhizopus stolonifer (Mucoraceae), an amended model », Bot. Bull. Acad. Sin., vol. 39, , p. 269-277
- Portail de la mycologie
- Portail de la protection des cultures
