Rat musqué
Ondatra zibethicus
Ne doit pas être confondu avec un autre « rat musqué » proche des taupes : Desmana moschata

- Castor zibethicus Linnaeus, 1766
- Ondatra americana Tiedemann, 1808
Sous-espèces de rang inférieur
- Ondatra zibethicus zibethicus
LC : Préoccupation mineure

Le rat musqué (Ondatra zibethicus) (ou rat d'Amérique) est un rongeur de la famille des cricétidés de trente à quarante cm de long qui pèse jusqu'à 1,5 kg (sec).
Il est réputé pouvoir vivre une dizaine d'années en captivité, mais il ne dépasse que rarement trois ou quatre ans dans la nature. Excellent nageur, il peut parcourir près de 100 m sans respirer sous l'eau ou y rester submergé et immobile plus de quinze minutes s'il se sent menacé.
Originaire d'Amérique du Nord, il a été introduit en Europe au début du XXe siècle pour sa fourrure et comme sujet de curiosité (en Bohême au début du XXe siècle). Il a été élevé dans de nombreux élevages en Europe, avant que des individus échappés d'élevages ou volontairement libérés dans la nature colonisent les milieux naturels et agricoles. Il est devenu dans les années 1960 le mammifère le plus commun des cours d'eau des zones agricoles d'Europe de l'Ouest où il cause d'importants dégâts.
Il ne faut pas le confondre avec le ragondin (Myocastor coypus), un autre rongeur beaucoup plus gros (jusqu'à 9 kg) de la famille des capromyidés originaire d'Amérique du Sud, lui aussi introduit en Europe, mais moins invasif et qui passe plus difficilement l'hiver, ni avec le rat d'eau, espèce indigène à l'Ancien Monde.
Description
- Il possède une grosse tête avec des incisives jaunes et puissantes, de fortes pattes arrière frangées sur leur bord externe de petits poils natatoires.
- Les membres antérieurs sont beaucoup plus courts.
- De solides griffes lui permettent de creuser efficacement les sols.
- Longueur : 50 à 61 cm, dont 30 à 36 cm pour la tête et le corps, 20 à 25 cm pour la queue, presque glabre, noirâtre, écailleuse et comprimée latéralement. Mis à part le castor, c'est le seul rongeur qui n'ait pas une queue arrondie ; cette queue semble améliorer ses capacités natatoires en produisant des mouvements semblables à ceux d'une anguille quand il nage rapidement[1]). Dans son aire originelle de répartition (Amérique du Nord), il est nettement plus grand et plus gros là où le climat est doux et la nourriture abondante et riche[2]. Pour ses réserves d'énergie et sa thermorégulation[3], il doit accumuler davantage de graisses brunes dans les régions où l'eau est plus froide[4].
- Couleur : foncée sur le dos (brun à presque noir) et plus claire sur le ventre (brun-gris). La couleur peut légèrement varier avec l'âge.
- Fourrure : un duvet très dense de sous-poils gris le protège du froid, sous une couche de poils de couverture rigides et brillants.
Alimentation
C'est un herbivore, mais si son régime alimentaire est essentiellement composé de végétaux, il le complète en hiver par quelques animaux aquatiques. Il est notamment capable d'ouvrir des coquillages (anodontes, moules zébrées, palourdes asiatiques qu'il casse toujours de la même manière). À l'occasion il peut également se nourrir de poissons laissés sur la rive par des pêcheurs.
Habitat

C'est un animal relativement ubiquiste, mais qui reste amphibie et dépend des zones humides[5] et sa survie dépend beaucoup de fluctuation des niveaux d'eau[6] et de la durée et importance des inondations[7],[8] ; il a bénéficié de la régularisation du débit des cours d'eau et des berges raides des fossés[9].
Il ne vit qu'à grande proximité des eaux dormantes ou courantes ; il creuse des terriers dans les berges débouchant normalement sous l'eau, ou lorsqu'il n'est pas dérangé construit des « huttes » rappelant celles des castors : amoncellements de branches et débris végétaux dans les caricaies ou roselières.
Il apprécie peu les berges en pentes très douces, notamment si elles sont piétinées par les animaux (son terrier s'effondre).
Dès qu'il peut y creuser un terrier, éventuellement en passant sous les parois de béton, il n'hésite pas à coloniser les berges de canaux, même très fréquentés.
Répartition
Comportement

C'est une espèce territoriale dont le comportement intraspécifique et interspécifique a été étudié, en lien avec ceux du castor canadien (autre espèce introduite en Europe du Nord)[10]. Il se rend plus discret (par exemple en ne faisant que des terriers, et pas de hutte) en présence d'une forte pression humaine, notamment pression de chasse ou de piégeage.
Quand il fait très froid (on a enregistré des températures de 0 à −10 °C dans le terrier ou la hutte durant l'hivernage, dans les pays froids) les rats musqués se blottissent les uns contre les autres, ce qui pourrait leur permettre d'économiser environ 10 % de leurs calories[11].
Reproduction
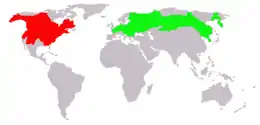
- habitat natif
- zone d'introduction
Dès la maturité sexuelle, acquise dès l'âge d'un an, le mâle et la femelle produisent – du printemps au début de l'été, via des glandes sexuelles – une substance à l'odeur musquée qui signifie qu'ils sont prêts à s'accoupler.
La gestation est brève (environ 30 jours), ce qui explique la prolificité de l'espèce : 2 à 3 portées par an sont possibles, avec 6 à 7 petits par portée, allaités de 21 à 28 jours.
Le mâle s'occupe des petits avec la femelle, dans le terrier avant leur émancipation.
À l’automne, les jeunes sont autonomes et quittent leurs parents pour chercher un nouveau territoire.
Pathologies et maladies
Il peut être affecté par de nombreuses maladies, dont zoonotiques. Il peut par exemple véhiculer la leptospirose, l’hantavirose (et la maladie de Lyme dans les régions où les tiques sont nombreuses) et probablement d'autres maladies émergentes ou non.
Ceci doit être pris en compte dans l'écoépidémiologie des espèces vivant dans les milieux où il a été introduit ; par exemple en France, il a été montré en 1986 qu'il est l'un des nouveaux « hôtes intermédiaires naturels » d'Echinococcus multilocularis, qui cause l'une des formes d'échinococcose, exceptionnellement transmissible à l'homme[12].
Comme il mange en hiver de nombreux coquillages d'eau douce (Unios, moule zébrée...) qui sont des organismes filtreurs, il peut se contaminer en bioaccumulant des métalloïdes et métaux lourds, dont du mercure, qui pourra à son tour contaminer plus fortement encore ses prédateurs (vison par exemple)[13].
Espèce invasive
Cette espèce invasive a colonisé les cours d'eau du nord de la France et de la Belgique dans les années 1960 à partir d'animaux introduits ou échappés d'élevages, ou relâchés par des éleveurs alors que le cours de la fourrure chutait.
En Europe, le Rat musqué est inscrit depuis 2017 dans la liste des espèces exotiques envahissantes préoccupantes pour l’Union européenne[14]. Cela signifie que cette espèce ne peut pas être importée, élevée, transportée, commercialisée, ou libérée intentionnellement dans la nature, et ce nulle part dans l’Union européenne[15].
Il fait l'objet d'une lutte intensive dans les zones agricoles situées entre les Pays-Bas et la région parisienne. Il est inscrit sur la liste d'espèces susceptibles d'être classés nuisibles en France.
Impacts
Il a selon les contextes
- des impacts écologiquement positifs (complexification du milieu et de l'écotone rivulaire, ou du milieu grâce à ses huttes qui peuvent accueillir des animaux (nids d'oiseaux[16], invertébrés) et des plantes particulières[17],[18], accélération du travail de certains microbes[19] et décomposeurs). De ce point de vue, c'est une espèce-ingénieur et facilitatrice[20] ;
- des impacts neutres ;
- des impacts négatifs sur les aménagements faits par l'homme (notamment là où il est devenu invasif ou envahissant)[21].
Il cause notamment des dégâts physiques aux digues et aux berges de fossés, cours d'eau ou aménagements hydrauliques qu'il sape avec ses terriers[22]. Capable de mobiliser environ 1 m3 de terre par an, le rat musqué y dégrade en effet les berges raides des fossés et des cours d'eau qui drainent les zones cultivées.
Il peut fragiliser l'enracinement des arbres de la ripisylve, alors plus facilement déchaussés par le vent.
Il a aussi un impact significatif sur les roselières (mesuré par l'ONCFS en France en comparant des zones de roselières protégées par des grillages (exclos) avec des zones non protégées)[23].
Quand il colonise les lagunages naturels (on en a trouvé avec des densités atteignant 20 individus par ha[24]), il peut négativement interférer avec leur fonctionnement et pourrait significativement affecter leur performances[24]. Il peut en outre véhiculer certaines maladies.
Lutte contre le rat musqué et gestion des dégâts
Il est très difficile de le réguler et plus encore de l'éradiquer, car il se reproduit rapidement et il bénéficie dans les régions où il a été introduit d'une quasi-absence de prédateurs et d'une nourriture facile et très énergétique partout où les champs avoisinent les cours d'eau, ce qui est devenu très fréquent depuis que les remembrements dans les années 1960 à 1980 ont mis en culture des milliers de prairies alluviales et de bas-pays (céréales, maïs et pommes de terre ainsi que les betteraves sont appréciés de l'Ondatra).
Quand on le chasse d'un côté d'une frontière, il peut se réfugier de l'autre ; ainsi, dans le nord de la France, l'USAN (Union des syndicats d'assainissement du Nord) coordonne la lutte contre le rat musqué sur son territoire et en lien avec ses homologues belges (flamands et wallons) depuis avril 1968.
En raison de nombreux aménagements faits en bord de cours d'eau et de zones humides, il est en outre devenu difficile de permettre des crues périodiques et naturelles pour y réduire sa densité et la permanence de sa présence[25].
En France par exemple, cette espèce est inscrite sur la Liste des animaux susceptibles d'être classés nuisibles[26]. Elle est organisée sous l'égide des préfets, et le cas échéant de manière transfrontalière (par exemple dans les Flandres belges et françaises où il a trouvé un habitat idéal (nombreux cours d'eau et watringues aux berges raides où il se cache facilement et source abondante de nourriture d'origine agricole). Récemment, le projet CARTORA y mutualise certains moyens, dont une cartographie commune des zones infestées, pour soutenir l'effort de piégeage (dans le respect des règles communautaires), avec en outre un travail sur la certification des pièges et des actions communes de communication[27].
Depuis le , les appâts chimiques sont interdits dans toute l'Europe (la FREDON en distribuait 120 tonnes d'anticoagulants par an rien que dans le Nord-Pas-de-Calais[28]) en raison des risques toxiques et écotoxiques qu'ils entraînent. Le piégeage (piège en X, avec agrément et autorisation, ou piégeage à la nasse autorisé sans agrément), le tir à l'arc ou au fusil (avec cartouche sans plomb) et une gestion plus écosystémique (reprofilage de berges en pentes douces, aménagements favorisant les prédateurs des rats musqués...) sont maintenant recommandés.
Notes et références
- Fish FE (1982) Function of the compressed tail of surface swimming muskrats (Ondatra zibethicus). Journal of Mammalogy, 591-597 (résumé et extrait).
- Boyce MS (1978) Climatic variability and body size variation in the muskrats (Ondatra zibethicus) of North America. Oecologia, 36(1), 1-19.
- MacArthur RA (1984) Aquatic thermoregulation in the muskrat (Ondatra zibethicus): energy demands of swimming and diving. Canadian journal of zoology, 62(2), 241-248.
- MacArthur RA (1986) Brown fat and aquatic temperature regulation in muskrats, Ondatra zibethicus. Physiological zoology, 59(3), 306-317.
- Bellrose FC (1950) The relationship of muskrat populations to various marsh and aquatic plants. J. Wildl. Manage. 14, 299 315
- Bellrose FC, Brown LG (1941) The effect of fluctuating water levels on the muskrat population of the Illinois River valley. J. Wildl. Manage. 5, 206-212
- Bellrose FC & Low JB (1943) The influences of flood and low water levels on the survival of muskrats. J. Mammal. 24, 173 188
- Dilworth TG (1967) The life history and ecology of the muskrat, Ondatra zibethicus under severe water level fluctuations. Thèse de doctorat de l'Université du Nouveau-Brunswick, Fredericton, 125 pp.
- Donohoe RW (1966), Muskrat reproduction in areas of controlled and uncontrolled water-level units. J. Wildl. Manage. 30, 320-326
- ALST, H. von (2000): Untersuchungen zum intra- und interspezifischen Verhalten von kanadischem Biber Castor canadensis Kuhl, und Bisam Ondatra zibethicus (L.). - Proc. 1. EBS Bratislava 1997: 171-172. (2325)
- Bazin, R. C., & MacArthur, R. A. (1992). Thermal benefits of huddlings in the muskrat (Ondatra zibethicus). Journal of Mammalogy, 73(3), 559-564. résumé
- Boussinesq, M., Bresson, S., Liance, M., & Houin, R. (1986). Un nouvel hôte intermédiaire naturel d'Echinococcus multilocularis en France: le rat musqué (Ondatra zibethicus L.). Annales de parasitologie humaine et comparée, 61(4), 431-434 (résumé)
- Stevens RT, Ashwood TL & Sleeman JM (1997). Mercury in hair of muskrats (Ondatra zibethicus) and mink (Mustela vison) from the US Department of Energy Oak Ridge Reservation. Bulletin of environmental contamination and toxicology, 58(5), 720-725 (extrait).
- « List of Invasive Alien Species of Union concern - Environment - European Commission », sur ec.europa.eu (consulté le )
- « RÈGLEMENT (UE) No 1143/2014 du parlement européen et du conseil du 22 octobre 2014 relatif à la prévention et à la gestion de l'introduction et de la propagation des espèces exotiques envahissantes »
- Dieter CD & Anderson, BJ (2009) Reproductive success and brood movements of giant Canada geese in eastern South Dakota. The American Midland Naturalist, 162(2), 373-381.
- de Szalay FA & Cassidy W (2001) Effects of muskrat (Ondatra zibethicus) lodge construction on invertebrate communities in a Great Lakes coastal wetland. The American Midland Naturalist, 146(2), 300-310.
- Kangas PC & Hannan GL (1985) Vegetation on muskrat mounds in a Michigan marsh. American Midland Naturalist, 392-396. (résumé)
- Wainscott VJ, Bartley C & Kangas P (1990) Effect of muskrat mounds on microbial density on plant litter. American Midland Naturalist, 399-401 (résumé).
- Higgins CR (2002) Ecosystem Engineering by Muskrats (Ondatra zibethicus) In Created Freshwater Marshes (Thèse de doctorat soutenue à l'université d'État de l'Ohio.
- Skyrienė G & Paulauskas A (2012) Distribution of invasive muskrats (Ondatra zibethicus) and impact on ecosystem. Ekologija, 58(3).
- Mériaux JL (1976) Influence écologique du rat musqué (Ondatra zibethica L.) sur l’écosystème étang. Bull. Soc. Bot. Nord Fr., 28-29 : 3. Lille.
- ONCFS (Revue Faune Sauvage - Avril 2008)
- Kadlec RH, Pries J & Mustard H (2007) Muskrats (Ondatra zibethicus) in treatment wetlands. ecological engineering, 29(2), 143-153.
- Toner J, Farrell JM & Mead JV (2010). Muskrat abundance responses to water level regulation within freshwater coastal wetlands. Wetlands, 30(2), 211-219
- France. « Arrêté du 3 avril 2012 pris pour l'application de l'article R. 427-6 du code de l'environnement et fixant la liste, les périodes et les modalités de destruction des animaux d'espèces susceptibles d'être classées nuisibles par arrêté du préfet » [lire en ligne (page consultée le 17 juillet 2015)]
- Présentation de CARTORA (Cartographie transfrontalière de l’infestation des rats musqués), consulté 2013-06-10
- « La fin de la lutte chimique », revue Ici l'Aa, source d'information du SAGE Delta de l'Aa, no 15, décembre 2011.
Voir aussi
Articles connexes
Référence
- (fr+en) Référence ITIS : Ondatra zibethicus (L., 1766)
- (en) Référence UICN : espèce Ondatra zibethicus (Linnaeus, 1766) (consulté le )
- (fr+en) Référence CITES : espèce Ondatra zibethicus (L., 1766) (+ répartition) (sur le site de l’UNEP-WCMC)
- (en) Référence GISD : espèce Ondatra zibethicus (L., 1766)
Liens externes
- Le rat musqué, Faune et flore du pays
Bibliographie
- Alexander MM (1955) Variations in winter muskrat habitats and harvests. Am. Midl. Nat. 53, 61 70
- Boutin, S., Moses, R. A., & Caley, M. J. (1988). The relationship between juvenile survival and litter size in wild muskrats (Ondatra zibethicus). The Journal of Animal Ecology, 455-462 (résumé).
- Connors LM & Kiviat E (2000) [s Muskrat (Ondatra zibethicus) Disturbance to Vegetation and Potential Net Nitrogen Mineralization and Nitrification Rates in a Freshwater Tidal Marsh] ; American Midland Naturalist, 143(1)
- Cook, A.H (1952) A study of the life history and management of the muskrat in New York State ; Thèse de doctorat de la Cornell University, Ithaca, New York, 128 pp.
- Dauphine TC (1965) Biology and ecology of the muskrats in a central Adirondack area. Thèse de doctorat de la State University of New-York at Syracuse, 141 pp.
- Erb J, Stenseth NC & Boyce MS (2000) Geographic variation in population cycles of Canadian muskrats (Ondatra zibethicus). Canadian journal of zoology, 78(6), 1009-1016.
- Fish FE (1982) Aerobic energetics of surface swimming in the muskrat Ondatra zibethicus. Physiol. Zool, 55(2), 180-189.
- McCulloch PF & JONES D (1990) Cortical influences on diving bradycardia in muskrats (Ondatra zibethicus). Physiological zoology, 63(6), 1098-1117
- MacArthur RA (1984) Microenvironment gas concentrations and tolerance to hypercapnia in the muskrat Ondatra zibethicus. Physiological zoology, 57(1), 85-98.
- MacArthur RA (1990) Seasonal changes in the oxygen storage capacity and aerobic dive limits of the muskrat (Ondatra zibethicus). Journal of Comparative Physiology B, 160(5), 593-599 (résumé).
- MacArthur RA & Campbell KL (1994) Heat increment of feeding and its thermoregulatory benefit in the muskrat (Ondatra zibethicus). Journal of Comparative Physiology B, 164(2), 141-146.
- Panneton WM & Yavari P (1995) A medullary dorsal horn relay for the cardiorespiratory responses evoked by stimulation of the nasal mucosa in the muskrat Ondatra zibethicus : evidence for excitatory amino acid transmission. Brain research, 691(1), 37-45.
- Shanks CE (1947) Populations, productivity, movements and food habits of Missouri muskrats. Thèse de doctorat de l'Université du Missouri, Columbia, 123 pp.
- Smith NR & Jordan PA (1976) An exploited population of muskrats with unusual biomass, productivity, and body size. State Geol. Nat. Hist. Surv. of Connecticut, Rept. of Invest. No. 7, 16 pp.
- Portail des mammifères
- Portail de la protection des cultures