Point de Bancroft
En chimie physique, un point de Bancroft est un point d'ébullition commun à deux espèces chimiques pures différentes. Autrement dit, il s'agit d'une condition de température et de pression à laquelle les deux espèces ont la même pression de vapeur saturante, voir figure 1.

Ce point porte le nom de Wilder Dwight Bancroft qui énonça en 1897[1] la règle selon laquelle les azéotropes se forment si les courbes de vapeur saturante des composants purs se croisent. Cependant, l'existence d'un point de Bancroft n'est qu'une condition suffisante de l'azéotropie : tout mélange binaire ayant un point de Bancroft présente un azéotrope. En revanche elle n'est pas une condition nécessaire : il existe des azéotropes dont les composants n'ont pas de point de Bancroft, par exemple le système dioxyde de carbone - éthane.
La règle de Bancroft s'énonce donc aujourd'hui selon :
« Tout système binaire ayant un point d’intersection des courbes de pression de vapeur saturante de ses constituants purs produit un azéotrope. »
Le comportement azéotropique du mélange s'observe à la température de Bancroft et s'étend à des températures plus ou moins éloignées de celle-ci selon le caractère non idéal plus ou moins prononcé du mélange.
Par abus de langage, le point d'azéotrope est parfois appelé point de Bancroft. Néanmoins, à la température de Bancroft la pression de l'azéotrope n'est pas la pression de Bancroft : les deux points ne se confondent pas.
Démonstration de la règle de Bancroft

On considère un mélange de deux corps et à l'équilibre liquide-vapeur. On note respectivement et leurs pressions de vapeur saturante à la température .
On suppose que les deux corps présentent un point de Bancroft, c'est-à-dire une température telle que :
Dans le diagramme de phases liquide-vapeur du mélange binaire à la température (diagramme représentant la pression en fonction de la composition, voir figure 2), les courbes d'ébullition et de rosée passent toutes les deux par les points :
- lorsque le corps est pur ;
- lorsque le corps est pur ;
avec :
- et les fractions molaires du corps respectivement en phase liquide et phase vapeur ;
- et les fractions molaires du corps respectivement en phase liquide et phase vapeur.
En application de la loi de Raoult, si le mélange était idéal on aurait :
- la courbe d'ébullition idéale : ;
- la courbe de rosée idéale : .
La droite d'équation passant par les deux points définis précédemment représente ainsi la courbe d'ébullition et la courbe de rosée du mélange idéal confondues. Cette droite est horizontale dans le diagramme de phases, voir figure 2. En conséquence, à la température de Bancroft un mélange des deux corps se comporte comme un corps pur quelle que soit la composition du mélange.
Cependant tout mélange réel présente un degré de non-idéalité plus ou moins prononcé, quels que soient ses composants. Par conséquent les courbes d'ébullition et de rosée réelles passent par les deux points définis plus haut mais ne se confondent pas avec la droite de Raoult. Aussi, selon le théorème de Rolle, les courbes d'ébullition et de rosée réelles du mélange, qui sont des courbes continues et dérivables, passent chacune obligatoirement par au moins un point auquel la tangente est horizontale, voir figure 2.
Ceci implique que les courbes d'ébullition et de rosée réelles passent chacune forcément par un extrémum (maximum ou minimum). Or, selon le théorème de Gibbs-Konovalov, en un point d'extrémum des courbes d'ébullition et de rosée les compositions des deux phases ne peuvent être qu'identiques.
En conséquence, un point de Bancroft induit nécessairement un azéotrope du mélange binaire à la température du point de Bancroft. Le comportement azéotropique du mélange s'étend à des températures plus ou moins éloignées de la température de Bancroft selon le caractère non idéal plus ou moins prononcé du mélange.
D'autre part, si l'extrémum est un maximum, la pression de l'azéotrope à la température de Bancroft est supérieure à la pression de Bancroft, il s'agit d'un azéotrope positif. Si l'extrémum est un minimum, la pression de l'azéotrope à la température de Bancroft est inférieure à la pression de Bancroft, il s'agit d'un azéotrope négatif.
Réciproque de la règle de Bancroft
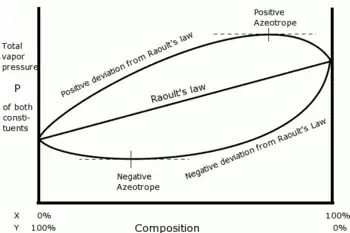
On suppose deux corps n'ayant pas de point de Bancroft. Il n'existe aucune température à laquelle les deux corps ont une pression de vapeur saturante commune.
Si le mélange ne présente pas un caractère non idéal trop prononcé, à température donnée les pressions d'ébullition et de rosée du mélange évoluent en fonction de la composition entre les pressions de vapeur saturante des deux corps. Les courbes d'ébullition et de rosée s'écartent de la loi de Raoult mais ne présentent pas d'extrémum : il n'y a pas d'azéotrope.
Si le mélange présente un caractère non idéal suffisamment prononcé, les pressions d'ébullition et de rosée du mélange peuvent prendre des valeurs supérieures à la plus grande des deux pressions de vapeur saturante, ou inférieures à la plus petite des deux pressions de vapeur saturante. Dans ces conditions, les courbes d'ébullition et de rosée présentent nécessairement un extrémum correspondant à un azéotrope selon le théorème de Gibbs-Konovalov, voir figure 3.
Il n'est donc pas nécessaire que le mélange présente un point de Bancroft pour produire un azéotrope, il suffit que le mélange soit suffisamment non idéal.
Voir aussi
Références
- Bancroft WD. The Phase Rule, The journal of Physical Chemistry. New York: Ithaca, 1897.
Bibliographie
- Jean Vidal, Thermodynamique : application au génie chimique et à l'industrie pétrolière, Paris, Éditions Technip, coll. « Publications de l'Institut français du pétrole. », , 500 p. (ISBN 978-2-7108-0715-5, OCLC 300489419, lire en ligne), p. 43.
- (en) M. B. King et P. V. Danckwerts, Phase Equilibrium in Mixtures : International Series of Monographs in Chemical Engineering, vol. 9, Elsevier, , 304 p. (ISBN 978-1-4831-5241-7, lire en ligne), p. 373-374.
- (en) J S Rowlinson, F L Swinton, J E Baldwin, A D Buckingham et S Danishefsky, Liquids and Liquid Mixtures : Butterworths Monographs in Chemistry, Butterworth-Heinemann, , 336 p. (ISBN 978-1-4831-4067-4, lire en ligne), p. 19 et 109.
- (en) Władysław Malesiński, Azeotropy and Other Theoretical Problems of Vapour-liquid Equilibrium, Interscience Publishers, , 222 p. (lire en ligne), p. 7.
Articles connexes
- Portail de la chimie
- Portail de la physique