Mixotrophie
La mixotrophie est le mode trophique d'organismes vivants capables de se nourrir par autotrophie (via la photosynthèse) aussi bien que par hétérotrophie (aux dépens de constituants organiques préexistants), consécutivement ou simultanément. Ces organismes sont dits mixotrophes.
_(flash).jpg.webp)
La mixotrophie concerne des organismes autotrophes pour le carbone (c'est-à-dire capables de synthétiser de la matière organique à partir de matière minérale comme le dioxyde de carbone) et capables de vivre comme des hétérotrophes en absence d'énergie lumineuse à l'origine de l'autotrophie ou encore des organismes nécessitant simultanément la présence d'énergie lumineuse et carbone organique.
Protistes
On considère maintenant comme mixotrophe une grande majorité des protistes y compris chez les phytoflagellés qui captent l'énergie lumineuse le jour et le carbone organique la nuit. De manière générale les protistes même dépourvus de chloroplaste sont à la fois capables de récupérer l'énergie lumineuse via les différents plastes et absorber par osmose le carbone organique présent dans le milieu. La vision qui consiste à partager les êtres entre animaux et végétaux ne peut pas s'appliquer aux protistes.
L'exemple le plus célèbre concerne les euglènes. Ce sont des organismes unicellulaires libres vivant en eau douce. Ces organismes sont capables de réaliser la photosynthèse en présence de lumière. En l'absence de lumière, elles deviennent hétérotrophes pour le carbone et restent capables de vivre contrairement à d'autres organismes photolithotrophes comme les plantes chlorophylliennes.
On peut distinguer différents groupes de mixotrophes, selon la source de leurs capacités photosynthétiques[3] :
- les mixotrophes constitutifs, qui sont dotés du matériel génétique leur permettant de produire et maintenir les plastes (exemples : Karlodinium, Prymnesium) ;
- les mixotrophes non constitutifs, qui gardent dans leur cytoplasme le matériel photosynthétique provenant de leurs proies :
- les généralistes, qui bénéficient des chloroplastes d'une grande variété d'autres organismes mais ne sont pas capables de les maintenir fonctionnels plus de quelques jours (Laboea, Strombidium),
- les spécialistes, qui dépendent d'un type particulier de proies mais :
- en gardent fonctionnels les plastes jusqu'à plusieurs mois (Dinophysis),
- ou mettent à leur service des colonies entières de proies photosynthétiques, qui restent vivantes (foraminifères, radiolaires).
Microalgues
La mixotrophie à dominante hétérotrophe est un mode de production intensif et industriel des microalgues. Cette technologie consiste à produire de la biomasse par hétérotrophie tout en flashant les cellules pour activer les voies métaboliques rattachées aux différents plastes. Cette technologie permet d'atteindre en production industrielle des rendements de l'ordre de plusieurs centaines de grammes de matière sèche par litre et de produire l'ensemble des molécules pouvant être synthétisées par les microalgues.
Plantes supérieures
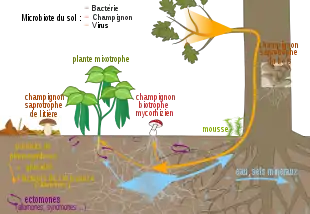
La mixotrophie peut aussi concerner des plantes vasculaires chlorophylliennes[4]. Ces plantes vertes mixotrophes ne comptent pas uniquement sur l’assimilation chlorophyllienne pour se fournir en carbone organique. Elles complètent cette source par une hétérotrophie partielle vis-à-vis du carbone. C’est le cas bien connu des plantes hémiparasites comme le gui, qui ponctionnent grâce à leurs suçoirs les photosynthétats directement à la source, dans les tissus de la plante hôte autotrophe.
On sait depuis le début des années 2000 que certaines plantes utilisent un moyen plus indirect d’accéder à ces ressources complémentaires de carbone, la mycohétérotrophie partielle. Ce mode de nutrition mixte a pour le moment été mis en évidence dans la famille des Orchidaceae et dans la famille des Ericaceae (plus particulièrement dans la sous-famille des Pyroloïdeae[5]). On trouve dans ces familles des plantes entièrement hétérotrophes, totalement dépourvues de chlorophylle. Elles vivent en exploitant le carbone organique d’un champignon[6]. Ces plantes mycohétérotrophes forment avec un champignon des mycorhizes particulières, de type orchidoïde ou monotropoïde et qui fonctionnent « à l’envers ». En effet, dans le cas habituel de la symbiose mycorhizienne, c’est la plante qui fournit au champignon du carbone, en échange de la nutrition minérale et hydrique que ce dernier peut apporter[7]. Les processus physiologiques permettant le détournement par la plante mycohétérotrophe de ce carbone fongique n’ont pas encore été bien élucidés (digestion ou autres mécanismes de transfert[8] ?). En dehors des régions tropicales, les champignons impliqués (identifiés par séquençage génétique) sont généralement des Ascomycètes et des Basidiomycètes symbiotiques, qui forment donc des ectomycorhizes avec les arbres forestiers avoisinants. Le carbone de ces champignons provient donc de l’activité photosynthétique des arbres avec lesquels ils sont associés, lequel est ensuite redistribué dans le réseau mycorhizien[9]. Plusieurs lignées ont opté pour ce même mode de nutrition mycohétérotrophe, par convergence évolutive[8].
Les plantes mixotrophes sont très souvent fortement apparentées aux mycohétérotrophes exclusives, et on considère la mixotrophie comme une première étape évolutive vers la mycohétérotrophie. Il a été prouvé d’après les reconstructions phylogénétiques que les mycohétérotrophes dérivent d’ancêtres mixotrophes[8]. La survie d’orchidées terrestre au phénotype « albinos », pratiquement dépourvues de chlorophylle, s’explique par cette capacité de compensation par mycohétérotrophie[10],[11],[12]. De telles orchidées « albinos » sont un modèle permettant d’étudier les mécanismes évolutifs de passage de la mixotrophie vers l’hétérotrophie. La faible vigueur des individus dépourvus de chlorophylle suggère toutefois que la perte des capacités de photosynthèse n’est pas le seul mécanisme permettant d’expliquer cette transition[8]. On a identifié des plantes mixtotrophes dans les forêts boréales, tempérées et méditerranéennes. On pourrait toutefois rechercher des mixotrophes dans d’autres types d’écosystèmes, mais aussi dans d’autres familles de plantes que celles citées précédemment. Les plantes concernées ont en commun de vivre dans des situations fortement ombragées par le couvert forestier. La mycohétérotrophie est envisagée comme une adaptation à ces conditions de faible luminosité, lorsque la photosynthèse ne peut suffire aux besoins métaboliques de la plante. Le carbone apporté par le champignon compense l’ombre, et permet aux plantes mixotrophes de s’épanouir sous une canopée très fermée[13],[14].
On peut se demander pourquoi les plantes mixotrophes gardent des capacités photosynthétiques, et n’évoluent pas systématiquement vers la mycohétérotrophie stricte. L’étude d’une orchidée méditerranéenne mixotrophe, le limodore à feuilles avortées Limodorum abortivum, apporte une réponse. Cette orchidée à peine verte dans la Nature a des capacités photosynthétiques très limitées. C’est par mycorhization avec des russules qu’elle profite du carbone fixé par les arbres qui l’entoure[15]. Or, traitée expérimentalement par des fongicides, cette orchidée est capable d’augmenter les concentrations de chlorophylle dans ses parties épigées, et particulièrement les ovaires, pour redevenir autotrophe et compenser la déficience des champignons associés[16].
Dans la Nature, la possibilité de disposer de deux sources de carbone est un avantage permettant une plus grande plasticité de la plante face à un environnement variable. La photosynthèse peut prendre par exemple le relais dans les situations où le champignon est défavorisé. On peut mettre en évidence cette mixotrophie par l’étude de la composition isotopique en carbone 13. L’enrichissement en isotopes lourds du carbone dans les réseaux trophiques permet de différencier les organismes autotrophes des hétérotrophes[17],[18]. Le profil isotopique des mixotrophes est intermédiaire entre celui des plantes autotrophes et celui des champignons, objectivant cette source mixte de carbone, à la fois d’origine photosynthétique et fongique. Cette méthode permet d’estimer la part de carbone apportée par la mycohétérotrophie. Cette part est très variable d’une espèce à l’autre, et peut aussi varier dans de fortes proportions chez une même espèce d’un site à l’autre[4]. Il existe en réalité un véritable continuum entre autotrophie et hétérotrophie. Ainsi, chez les pyroloïdeae, on a observé que l’importance de cette mixotrophie est inversement corrélée avec l’accès à la lumière. Chez les pyroles, espèces sempervirentes, on suppose que la photosynthèse est prépondérante l’hiver, et que le carbone d’origine fongique gagne en importance à la belle saison, lorsque le feuillage des arbres accentue l’ombrage[19],[5]. La difficulté de reprise après transplantation de certaines orchidées ou des pyroles s’expliquerait par la mixotrophie de nombre d’espèces forestières[8]. Coupées du lien avec les arbres, par l’intermédiaire du champignon mycorhizien, elles sont privées d’une source très importante de carbone. Cela peut avoir des conséquences importantes pour la conservation de ces espèces, en rendant plus difficiles par exemple les mesures de conservation ex situ de ces taxons.
De nombreuses questions demeurent encore sans réponse au sujet de ces plantes mixotrophes. Peut-on les considérer comme parasites des champignons et des plantes dont elles dépendent ou apportent-elles quelque chose en retour ? Affectent-elles la productivité des écosystèmes forestiers dans lesquels elles peuvent être abondantes (cas des pyroles dans les forêts boréales[5]) ?
Exemples de familles et de genres comportant des mixotrophes (liste non exhaustive) :
- Orchidaceae : Cephalanthera, Corallorhiza, Epipactis, Limodorum, Listera, Platanthera ;
- Ericaceae : Chimaphila, Orthilia (en), Pyrola.
Notes et références
- (en)Girlanda, M., Selosse, M.A., Cafasso, D., Brilli, F., Delfine, S., Fabbian, R., et al. (2006) Inefficient photosynthesis in the Mediterranean orchid Limodorum abortivum is mirrored by specific association to ectomycorrhizal Russulaceae. Mol Ecol 15: 491–504.
- (en) Bellino A, Alfani A et al. (2014). Nutritional regulation in mixotrophic plants: new insights from Limodorum abortivum. Oecologia 175, 875–885
- Aditée Mitra, « Le règne des plantes-garous », Hors-série Pour la science, no 101, , p. 78-84.
- Selosse MA, Roy M (2009) Green plants that feed on fungi: facts and questions about mixotrophy. Trends Plant Sci 14:64–70
- Tedersoo, Leho, Prune Pellet, Urmas Kõljalg, et Marc-André Selosse. 2007. « Parallel Evolutionary Paths to Mycoheterotrophy in Understorey Ericaceae and Orchidaceae: Ecological Evidence for Mixotrophy in Pyroleae ». Oecologia 151 (2): 206‑17. doi:10.1007/s00442-006-0581-2.
- Leake, Jonathan R. 1994. « The Biology of Myco‐heterotrophic (‘saprophytic’) Plants ». New Phytologist 127 (2): 171‑216. doi:10.1111/j.1469-8137.1994.tb04272.x.
- Smith SE, Read DJ (1997) Mycorrhizal symbiosis, 2nd edn. Academic Press, London
- Les plantes qui mangent des champignons. http://isyeb.mnhn.fr/IMG/pdf/dossier_77_p102107_selosse.pdf
- Selosse M-A, Richard F, He X, Simard SW (2006) Mycorrhizal networks: des liaisons dangereuses? Trends Ecol Evol 11:621–628
- Abadie, J-C. et al. (2006) Cephalantera longifolia (Neottiae, Orchidaceae) is mixotrophic: a comparative study between green and nonphotosynthetic individuals. Can. J. Bot. 84, 1462–1477
- Selosse M-A, Faccio A, Scappaticci P, Bonfante P (2004) Chlorophyllous and achlorophyllous specimens of Epipactis microphylla (Neottieae, Orchidaceae) are associated with ectomycorrhizal septomycetes, including truffles. Microb Ecol 47:416–426
- Julou T, Burhardt B, Gebauer G, Berviller D, Damesin C, Selosse M-A (2005) Mixotrophy in orchids: insights from a comparative study of green individuals and non-photosynthetic mutants of Cephalanthera damasonium. New Phytol 166:639–653
- Preiss K, Adam IKU, Gebauer G (2010) Irradiance governs exploitation of fungi: fine-tuning of carbon gain by two partially mycoheterotrophic orchids. Proc R Soc B 277:1333–1336
- Bidartondo MI, Burghardt B, Gebauer G, Bruns TD, Read DJ (2004) Changing partners in the dark: isotopic and molecular evidence of ectomycorrhizal liaisons between forest orchids and trees. Proc R Soc Lond Ser B 271:1799–1806
- Girlanda M, Selosse MA, Cafasso D, Brilli F, Delfine S, Fabbian R, Ghignone S, Pinelli P, Segreto R, Loreto F, Cozzolino S, Perotto S (2006) Inefficient photosynthesis in the Mediterranean orchid Limodorum abortivum is mirrored by specific association to ectomycorrhizal Russulaceae. Mol Ecol 15:491–504
- Bellino, Alessandro, Anna Alfani, Marc-André Selosse, Rossella Guerrieri, Marco Borghetti, et Daniela Baldantoni. 2014. « Nutritional Regulation in Mixotrophic Plants: New Insights from Limodorum Abortivum ». Oecologia 175 (3): 875‑85. doi:10.1007/s00442-014-2940-8.
- Post DM (2002) Using stable isotopes to estimate trophic position: models, methods, and assumptions. Ecology 83:703–718
- Dawson TE, Mambelli S, Plamboeck AH, Templer PH, Tu KP (2002) Stable isotopes in plant ecology. Annu Rev Ecol Syst 33:507–559
- Matsuda Y, Shimizu S, Mori M, Ito SI, Selosse MA (2012) Seasonal and environmental changes of mycorrhizal associations and heterotrophy levels in mixotrophic Pyrola japonica (Ericaceae) growing under different light environments. Am J Bot 99(7):1177–1188
Voir aussi
Bibliographie
- Aditee Mitra, « Le plancton animal qui voulait devenir végétal », Pour la science, no 496, , p. 50-59