Hex-1-ène
L’hex-1-ène est un alcène de formule brute C6H12. C’est l’un des 17 isomères de l’hexène. L’hex-1-ène est une oléfine alpha, c’est-à-dire que sa double liaison est en position alpha, ce qui lui assure une grande réactivité et donc des propriétés chimiques utiles. L’hex-1-ène est d’ailleurs une α-oléfine linéaire de grande importance dans l’industrie.
| Hex-1-ène | ||
 | ||
| Structures 2D et 3D de l'hex-1-ène | ||
| Identification | ||
|---|---|---|
| Nom UICPA | hex-1-ène | |
| Synonymes |
hexène ; butyléthylène |
|
| No CAS | ||
| No ECHA | 100.008.868 | |
| No CE | 209-753-1 | |
| PubChem | 11597 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d’odeur proche du pétrole | |
| Propriétés chimiques | ||
| Formule | C6H12 [Isomères] |
|
| Masse molaire[1] | 84,1595 ± 0,0056 g/mol C 85,63 %, H 14,37 %, |
|
| Propriétés physiques | ||
| T° fusion | −140,15 °C (± 4)[2] | |
| T° ébullition | 63,85 °C[2] | |
| Paramètre de solubilité δ | 15,1 MPa1/2 (25 °C)[3] | |
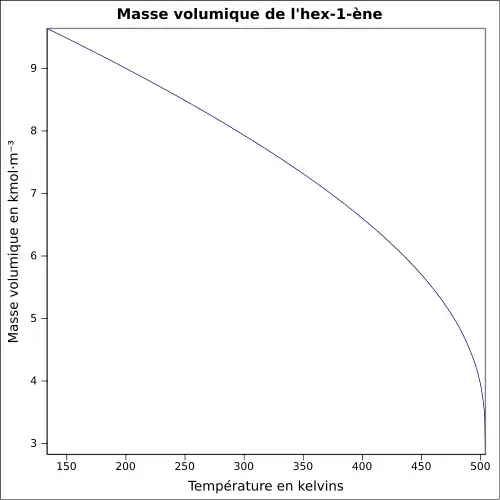
| Masse volumique | 0,67 g·cm-3[4]
|
|
| T° d'auto-inflammation | 255 °C[4] | |
| Point d’éclair | −20 °C[4] | |
| Limites d’explosivité dans l’air | 1,2–6,9 %vol[4] | |
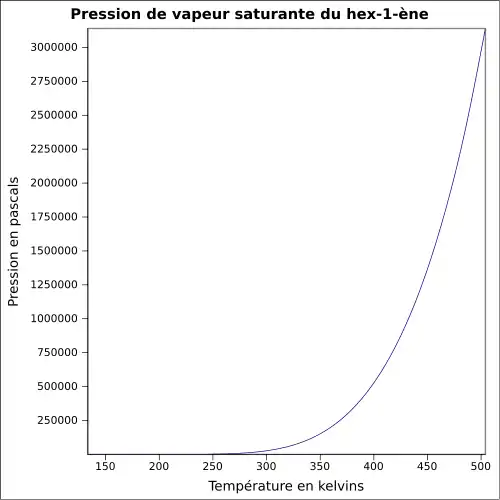
| Pression de vapeur saturante | 199 mbar à 20 °C 280 mbar à 30 °C 644 mbar à 50 °C[4] |
|
| Point critique | 230,85 °C (± 0,3) ; 32,1 bar (± 0,3)[6] | |
| Point triple | −139,76 °C[7] | |
| Thermochimie | ||
| S0liquide, 1 bar | 295,18 J·mol-1·K-1[8] | |
| ΔfH0gaz | -42. ± 2. kJ/mol[2] | |
| ΔfH0liquide | -73. ± 3. kJ/mol[2] | |
| ΔfusH° | 9,347 kJ·mol-1 (−139,76 °C)[2] | |
| ΔvapH° | 30,6 kJ·mol-1[2] | |
| Cp | 183,30 kJ·mol-1·k-1 (25 °C, liquide)[8]
|
|
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
 Xn  F |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Utilisation
La position α de la double liaison de l’hex-1-ène offre une bonne réactivité qui est utilisée pour la synthèse de l’acide heptanoïque utilisé dans la fabrication de lubrifiants[10].
La réaction est une hydroformylation à partir d’hex-1-ène, de monoxyde de carbone et de dihydrogène en présence d’un catalyseur à une température d’environ 150 °C, suivie d’une oxydation de l’aldéhyde en présence d’air et d’un autre catalyseur.
Ce procédé permet d’obtenir un ratio de 20:1 en faveur d’un acide linéaire face aux isomères ramifiés et est également utilisé pour produire l’acide nonanoïque à partir de l’oct-1-ène[11].
Une autre utilisation de l’hex-1-ène est la copolymérisation pour la production de dérivés du polyéthylène. L’hex-1-ène est ajouté pour obtenir du polyéthylène à basse densité linéaire (PEBDL, LLDPE en anglais) jusqu’à une concentration de 12 %. Cette co-α-oléfine est habituellement ajoutée lors de la polymérisation en phase liquide[10].
Elle sert aussi, comme le but-1-ène et l’oct-1-ène, à produire des plastomères par catalyse avec un métallocène.
Production et synthèse
La production de l’hex-1-ène est principalement issue de la polymérisation de l’éthylène qui forme un large mélange d’alcènes et de leur séparation par distillation.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « 1-Hexene », sur NIST/WebBook
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- Entrée « 1-hexene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5/5/2009 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Tsonopoulos, C.; Ambrose, D., Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons, J. Chem. Eng. Data, 1996, 41, 645-656
- Waddington, G.,Personal Commun., U. S. Bur. Mines, Bartlesville, OK, 1951.
- McCullough, J.P.; Finke, H.L.; Gross, M.E.; Messerly, J.F.; Waddington, G., Low temperature calorimetric studies of seven 1-olefins: effect of orientational disorder in the solid state, J. Phys. Chem., 1957, 61, 289-301
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 0-88415-858-6)
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co,
- (en) George R. Lappin et Joe D. Sauer, Alpha Olefins Applications Handbook, CRC Press, (ISBN 0-8247-7895-2), p. 325
- Portail de la chimie