Gustav Kirchhoff
Gustav Robert Kirchhoff (prononcé en allemand /ˈkɪʁç.hɔf/) (né le à Königsberg, en province de Prusse-Orientale et décédé à Berlin le ) est l’un des plus grands physiciens du XIXe siècle, avec des contributions essentielles à l’électrodynamique, la physique du rayonnement et la théorie mathématique de l'élasticité.
Pour les articles homonymes, voir Kirchhoff.

| Naissance |
Königsberg (Royaume de Prusse) |
|---|---|
| Décès |
Berlin (Empire allemand) |
| Domicile | Berlin |
| Nationalité |
|
| Domaines | Physique |
| Institutions |
Université de Breslau Université de Heidelberg Université Humboldt de Berlin |
| Diplôme | Université de Königsberg |
| Renommé pour |
Lois de Kirchhoff Loi du rayonnement de Kirchhoff Relations de Kirchhoff |
| Distinctions |
Médaille Rumford Médaille Janssen à titre posthume |
Biographie
Gustav Kirchhoff, fils de l'avocat Friedrich Kirchhoff, et de Johanna Henriette Wittke, épouse Clara Richelot, la fille de Friedrich Julius Richelot, son professeur de mathématiques. Après un doctorat de physique obtenu en 1847 à l'université de Königsberg où il a suivi les cours de Franz Ernst Neumann, il enseigne à l'université de Breslau de 1850 à 1854, puis à l'université de Heidelberg et enfin à l'université Humboldt de Berlin à partir de 1875. En 1886, sa santé défaillante le force à prendre sa retraite.
En 1862, pour formuler une loi universelle du rayonnement, Kirchhoff imagine un émetteur thermique idéal rayonnant dans le vide, le corps noir. Cette même année, la médaille Rumford lui est décernée pour avoir démontré l'existence de raies lumineuses fixes dans le spectre du rayonnement solaire (spectre de la « lumière naturelle »), et pour avoir mis en évidence une inversion des raies lumineuses dans la lumière artificielle. Il est également lauréat de la médaille Davy en 1877.
Travaux scientifiques
- Kirchhoff est mondialement célèbre pour les lois électrotechniques relatives à la conservation des courants et des charges dans les circuits électriques, lois qu'il a établies alors qu'il était encore étudiant.
- Kirchhoff enseignait également la théorie mathématique de l'élasticité, et dans ce cadre, il s'attaqua à la difficile question de la déformation des plaques élastiques. Il précisa la portée physique de la solution de Navier, en calculant toutes les composantes du champ de déformation, ainsi que toutes les composantes de contrainte. Il constata que la solution classique ne satisfaisait pas les conditions aux limites en déplacement pour une plaque d'étendue finie (appuyée ou encastrée), mais indiqua que l'écart tend à s'annuler lorsque l'épaisseur relative de la plaque tend vers 0.
- Il a apporte une immense contribution à la science, en tant que fondateur, avec Robert Bunsen, de la spectroscopie.
- Il proposa une loi pour le phénomène de rayonnement thermique en 1859, et déposa un brevet en 1861.
- Il établit que les raies spectrales de la lumière émise par un corps incandescent constituent une signature permettant d'identifier ce corps. En observant ainsi le spectre de la lumière solaire, il put reconnaître plusieurs éléments chimiques présents sur Terre. Cette technique nouvelle devait donner une nouvelle dimension à l'observation astronomique. Avec Robert Bunsen, il découvrit en 1860 grâce à l'analyse spectrale, le césium et le rubidium, ouvrant à l'Anglais Crookes, aux allemands Reich, Richter et à bien d'autres, la voie de la recherche de corps simples encore inconnus…
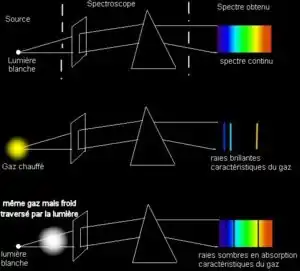
Les trois lois de spectroscopie de Kirchhoff
Kirchhoff a établi les trois lois suivantes, décrivant la lumière émise par le spectre d'un objet incandescent, en s'appuyant essentiellement sur les recherches de David Alter et de Anders Jonas Ångström :
- un objet chaud incandescent produit un spectre continu ;
- un gaz produit un spectre de raies de différentes longueurs d'onde (donc non continu), dépendant du niveau d'énergie des atomes du gaz ;
- un objet chaud entouré d'un gaz froid ou un gaz froid seul produit un spectre presque continu, et présentant des lacunes ponctuelles à certaines longueurs d'onde bien séparées, lacunes qui correspondent aux niveaux d'énergie des atomes composant le gaz.
L'existence de ces raies discrètes, car imposées par une énergie quantifiée fut expliquée plus tard par le Modèle de Bohr, qui a notamment aidé au développement de la physique quantique.
La loi de thermochimie de Kirchhoff
Kirchhoff démontra en 1858 que la variation de la chaleur d'une réaction chimique dépend de la différence de capacité calorifique entre produits et réactifs : dΔH / dT = ΔCp. L'intégration de cette équation permet l'évaluation de la chaleur de réaction à une température à l'aide de mesures à une autre température[1].
Références
- Peter W. Atkins, Éléments de chimie physique (éd. française, de Boeck 1998), p. 70.
Voir aussi
Articles connexes
- Analyse spectrale
- Lois de Kirchhoff en électricité
- Loi du rayonnement de Kirchhoff
- Spectre d'émission
- Spectre d'absorption
- Corps noir
- Physique quantique
- Relations de Kirchhoff en thermodynamique
Liens externes
- Article commenté de Kirchhoff et Bunsen sur l'analyse spectrale, 1860 (site Bibnum)
- Notices d'autorité :
- Fichier d’autorité international virtuel
- International Standard Name Identifier
- Bibliothèque nationale de France (données)
- Système universitaire de documentation
- Bibliothèque du Congrès
- Gemeinsame Normdatei
- Bibliothèque nationale de la Diète
- Bibliothèque royale des Pays-Bas
- Bibliothèque universitaire de Pologne
- Bibliothèque nationale de Catalogne
- Bibliothèque nationale d’Australie
- Bibliothèque nationale tchèque
- Bibliothèque nationale de Grèce
- WorldCat Id
- WorldCat
- Portail de la physique
- Portail de l’électricité et de l’électronique
- Portail du Royaume de Prusse