Fumarase
La fumarase, ou fumarate hydratase, est une lyase qui catalyse la réaction :
| Fumarase | ||
 Structure d'une fumarase humaine (PDB 3E04) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Fumarate hydratase | |
| Symbole | FH | |
| N° EC | 4.2.1.2 | |
| Homo sapiens | ||
| Locus | 1q43 | |
| Masse moléculaire | 54 637 Da[1] | |
| Nombre de résidus | 510 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Cette enzyme existe sous une forme cytosolique, par laquelle elle intervient dans le métabolisme du fumarate et de certains acides aminés, et sous une forme mitochondriale, par laquelle elle intervient à la 8e étape du cycle de Krebs pour catalyser l'hydratation du fumarate en L-malate. Sa localisation dans un compartiment cellulaire cible est déterminée par la présence ou l'absence d'un peptide signal de l'extrémité N-terminale : la présence de cette séquence N-terminale détermine une localisation mitochondriale tandis que son absence détermine une localisation cytosolique.
Outre le cycle de Krebs, elle intervient également dans le cycle de Krebs inverse (fixation du CO2), et joue un rôle dans le cancer du rein. Une mutation de son gène a été associée au développement de léïomyomes de la peau et de l'utérus en relation avec un cancer du rein.
Structure et mécanisme catalytique
L'étude de la structure cristallisée de plusieurs fumarases C d'Escherichia coli a révélé que cette enzyme possède deux sites de liaison aux dicarboxylates : le site actif et le site B. L'observation du déplacement du résidu His129 du site B laisse penser que de l'eau occupe ce site en permanence. Ce déplacement suggère également que l'accès au site allostérique B est contrôlé par la conversion imidazole imidazolium[2].
La figure ci-dessous illustre le mécanisme réactionnel de la fumarase. Deux groupes acide-base catalysent le transfert de protons, et l'état d'ionisation de ces groupes est en partie défini par les deux formes E1 et E2 de cette enzyme. À l'état E1, le groupe se présente sous une forme neutre A–H/B, tandis qu'à l'état E2 il se présente sous une forme zwittérionique A–/BH+. C'est l'état E1 qui se lie au fumarate et favorise sa conversion en malate, tandis que l'état E2 se lie au malate et favorise sa conversion en fumarate. Les deux formes doivent subir une isomérisation lors de chaque cycle catalytique.
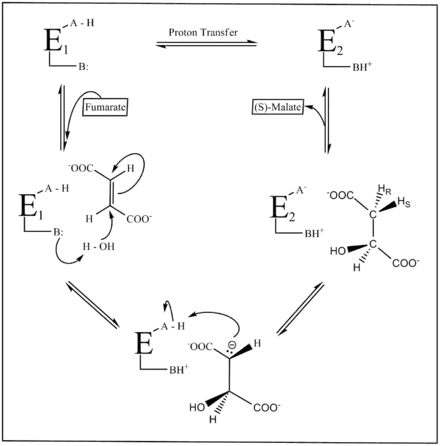
Malgré son importance biologique, le mécanisme réactionnel de la fumarase n'est pas entièrement compris. La conversion du fumarate en L-malate est mieux comprise que la réaction inverse et implique l'hydratation stéréospécifique par addition trans d'un groupe hydroxyle et d'un atome d'hydrogène. La réaction inverse fait quant à elle intervenir une élimination acidobasique catalysée par élimination E1cB (en) intermédiaire carbanionique.
Maladies associées
Un déficit en fumarase provoque une maladie appelé acidurie fumarique, caractérisée par l'hydramnios et des anomalies cérébrales du fœtus. Pendant la période néonatale, l'acidurie fumarique se manifeste notamment par de sévères atteintes neurologiques, une mauvaise alimentation, un retard de croissance et une hypotonie. On doit suspecter cette maladie chez l'enfant présentant de multiples anomalies neurologiques sévères en l'absence de crise métabolique aiguë. Un accroissement isolé de la concentration en acide fumarique dans les urines, décelée par dosage des acides organiques urinaires, suggère fortement une acidurie fumarique. L'activité insuffisante à la fois de la forme cytosolique et de la forme mitochondriale de l'enzyme peut provoquer ces symptômes. Il existe des tests génétiques moléculaires permettant de déceler la maladie.
La fumarase est très répandue dans les tissus à la fois chez le fœtus et chez l'adulte. Une fraction importante de l'expression de cette enzyme se déroule dans la peau, la parathyroïde, la lymphe et le côlon. Plusieurs maladies humaines liées à la fumarase ont été associées à des mutations affectant la production et la maturation de cette enzyme. Les mutations faux-sens et les délétions affectant l'extrémité 3' du gène peuvent conduire à l'acidurie fumarique, tandis que celles affectant l'extrémité 5' — allant d'une paire de bases à l'ensemble du gène — peuvent conduire au léïomyome et au cancer du rein[3].
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) T. Weaver, « Structure of free fumarase C from Escherichia coli », Acta Crystallographica Section D, vol. 61, no Pt 10, , p. 1395-1401 (PMID 16204892, DOI 10.1107/S0907444905024194, lire en ligne)
- (en) Marcel Estévez, Jeremy Skarda, Josh Spencer, Leonard Banaszak et Todd M. Weaver, « X-ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation », Protein Science, vol. 11, no 6, , p. 1552-1557 (PMID 12021453, PMCID 2373640, DOI 10.1110/ps.0201502, lire en ligne)
- Portail de la biochimie
