Diuron
Le diuron (de nom IUPAC, 3-(3,4-dichlorophényl)-1,1-diméthyl-urée) est un produit phytosanitaire (pesticide) ayant un effet herbicide.
| Diuron | |
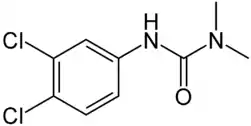
| |
| Formule développée | |
| Identification | |
|---|---|
| Nom UICPA | 3-(3,4-dichlorophényl) -1,1-diméthyl-urée |
| No CAS | |
| No ECHA | 100.005.778 |
| No CE | 206-354-4 |
| InChI | |
| Apparence | solide cristallin incolore |
| Propriétés chimiques | |
| Formule | C9H10Cl2N2O [Isomères] |
| Masse molaire[1] | 233,095 ± 0,013 g/mol C 46,37 %, H 4,32 %, Cl 30,42 %, N 12,02 %, O 6,86 %, |
| Propriétés physiques | |
| T° fusion | 158 °C |
| T° ébullition | décomposition à 180 °C |
| Solubilité | 35 mg·L-1 eau à 20 °C; 42 mg·L-1 dans l'eau à 25 °C |
| Pression de vapeur saturante | 1,1×10-3 mPa (25 °C) |
| Précautions | |
| SGH[2] | |
   Attention |
|
| SIMDUT[3] | |
Produit non contrôlé |
|
| Écotoxicologie | |
| DL50 | 1 017 mg·kg-1 rat oral 500 mg·kg-1 souris i.p. > 5 000 mg·kg-1 rat peau |
| Unités du SI et CNTP, sauf indication contraire. | |
Usages
Le diuron est très utilisé comme désherbant pour tuer les graminées indésirables et d'autres adventices annuelles et persistantes à feuilles larges, en viticulture notamment. On l'utilise aussi dans les jardins et pour désherber les bords de routes ou les voies ferrées[4]. À titre d'exemple, en 1998, l'Europe comptait 19 producteurs/fournisseurs de diuron et environ 133 tonnes de matière active avaient été fabriqués en France en 1997[4].
Réglementation
Historique du statut réglementaire dans l'Union européenne et en France
- L’Union européenne avait interdit cette substance en 2007 par la décision 2007/417/CE[5] à la suite de l'examen relatif à l'inscription à l’annexe I de la directive 91/414/CEE. Elle a ensuite été autorisée en 2008 à la suite de la décision 2008/91/CE du 29 septembre 2008[6] mais relève des substances dangereuses qui seront progressivement interdites[7],[8]. Cette autorisation de mise sur le marché a été décidée en dépit de sa toxicité pour l'Homme et l'environnement.
- La France a interdit cette substance en 2002 pour les usages non-agricoles entre le 1er novembre et le 1er mars[4]. Le 30 juin 2003, il a été interdit pour les usages agricoles.
Il est encore utilisé comme anti-algue et anti-mousse dans les peintures de façades ou certains produits de nettoyage, ainsi que dans de nombreux antifoulings qui en relarguent une grande partie dans les eaux marines[9].
Statut réglementaire actuel
Sur le plan de la réglementation des produits phytopharmaceutiques :
- Dans l’Union européenne : cette substance active est autorisée à la suite de la décision 2008/91/CE du 29 septembre 2008 ;
- En France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché. L'avis paru au Journal officiel du 4 septembre 2007 retire les autorisations de mise sur le marché des produits phytopharmaceutiques contenant du diuron, pour tous les usages agricoles, en fixant les délais d'écoulement des stocks que ce soit pour la distribution, jusqu'au 30 mai 2008, ou l'utilisation, jusqu'au 13 décembre 2008, des stocks existants[10].
Caractéristiques chimiques
De la famille des phénylamines (ou alogénophénylurées (N-(3,4-dichlorophényl)-N’-(diméthyl)-urée), il appartient à la sous-classe des phénylurées et au groupe des urées substituées qui appartient lui-même à la vaste famille chimique des pesticides, elle-même classée parmi les biocides.
Son activité phytocide vient du fait qu'à très faible dose, il inhibe la production photosynthétique de dioxygène en bloquant le transfert des électrons au niveau du photosystème II de la photosynthèse[4]. A des doses plus importantes, il a aussi des effets sur d'autres organismes, y compris animaux.
Sa solubilité dans l’eau (42 ppm) est moyenne[4] mais suffisante pour qu'on le trouve dans les eaux superficielles ou de nappes, ou après évaporation dans les pluies, brumes, brouillards et rosées, et en mer.
Son temps de demi-vie dans les sols serait d'environ un an (372 jours), mais des variations importantes semblent possibles en fonction de la nature du sol (pH, oxygénation, richesse en matière organique et en organismes microbiens vivants, humidité, altitude, exposition au soleil ou non, etc.).
Dans l'environnement aérien, l'oxydation par l'air ou l'ozone et la dégradation par photochimie semblent le dégrader lentement.
Dans le sol et les sédiments (fluviaux, marins et estuariens, mais aussi des mares agricoles, ou dans leurs boues de curage, souvent anoxiques) il pourrait persister plus longtemps avant minéralisation complète. Il se fixe bien sur la matière organique (sa lixiviation dans les nappes n'est significative que quand le sol est pauvre en matière organique, ou à partir de 25 cm de profondeur, là où le taux de matière organique diminue naturellement) [4].
Plusieurs études ont trouvé des présences significatives de diuron dans les eaux douces et marines (dans ce dernier cas, il peut provenir des antifoulings mais aussi pour partie être d'origine terrestre via un apport par les fleuves, par l'air ou la pluie[11]).
Toxicologie
Absorbé par inhalation ou contact, il peut induire des dermites irritatives, de légères brûlures et des irritations oculaires, ainsi qu'une sensibilisation cutanée en cas de contacts répétés.
L'ingestion induit des brûlures digestives, des vomissements et diarrhées au-delà de 50 g ingérés par un adulte.
Un risque d'« acné chlorique » du visage pourrait être expliqué par les impuretés chlorobenzéniques (Tétrachloroazobenzène) qui l'accompagnent, ce qui peut aussi laisser supposer une cancérogénicité.
Santé reproductive
Des effets délétères ont été détectés sur le spermatozoïde humain, et plus encore à la suite d'une exposition à l'un de ses sous-produits de dégradation, la 3,4-dichloroaniline (3,4-DCA) qui le tue après 30 minutes ou 24 heures respectivement pour des doses de 5 mM et 1 mM de 3,4-DCA pour 250 μl[12].. D'autres produits de dégradation pourraient avoir des impacts toxiques et écotoxiques :
- N-(3,4 dichlorophényl)-N-(méthyl)-urée (DCPMU) ;
- N-(3,4 dichlorophényl)-urée (DCPU).
Écotoxicologie
Ce produit assez répandu dans l'environnement peut s'évaporer dans l'air (en raison de sa tension de vapeur) être transporté et retomber à distance dans les pluies. Il semble pouvoir affecter les écosystèmes, les habitats et les espèces de plusieurs manières[4].
La décomposition du diuron par le feu conduit à des gaz, fumées et cendres hautement toxiques.
Dans le sol, il peut être solubilisé dans l'eau ou interagir avec la matière organique, dont celle apportée par les amendements agricoles[13].
Des taux élevés de diuron (environ huit fois plus que d'irgarol, autre biocide présent dans les antifoulings) ont été trouvés en rade de Brest en 2003-2004, avec selon l'IFREMER, des teneurs grimpant à 6,7 μg·L-1 dans des marinas ou d'autres zones portuaires[14]. Ces chiffres ne sont probablement pas des maxima, car les mesures sont rares. Ils sont cependant déjà assez élevés pour induire un effet sur le phytoplancton, et peut-être dans ces zones sur toute la chaine alimentaire. Ces teneurs dépassent, et de très loin, les normes européennes de potabilité, alors que des moules et huîtres ou coquilles Saint-Jacques peuvent croître à proximité ou en aval de ces zones et être commercialisées.
Il modifie les biofilms algo-bactériens des cours d'eau qui sont aussi des biointégrateurs et « sentinelles des rivières »[15], notamment en zone de vignobles[16] (pesticides qui peuvent eux-mêmes modifier la composition du biofilm[17]).
Après l'interdiction du TBT dans les antifoulings, et depuis les années 1990, l'irgarol et le diuron (le premier semblant plus toxique que le second[18]) sont devenus parmi les substituts les plus employés pour les composés organostanniques, mais d'autres alternatives sont recherchées et testées.
Depuis les années 1990, le diuron et l'irgarol (qui semble moins toxique que le diuron[18],[14]) comptent parmi les premiers substituts aux composés organostanniques, mais d'autres alternatives sont recherchées et testées.
Voir aussi
Articles connexes
Bibliographie
- Akcha F., Spagnol C., & Rouxel J. (2012). “Genotoxicity of diuron and glyphosate in oyster spermatozoa and embryos”. Aquatic Toxicology. n°106, p. 104-113.
- Giacomazzi S., Cochet N. (2004). Environmental impact of diuron transformation: a review. Chemosphere. no 56, p. 1021–1032.
- Okamura H., Aoyama I., Ono Y., Nishida T. (2003). Antifouling herbicides in the coastal waters of western Japan. Mar. Poll. Bull.
- Salvestrini S., Di Cerbo P., Capasso S. (2002) Kinetics of the chemical degradation of diuron. Chemosphere. no 48, p. 69–73.
- Rouchaud J., Neus R., Bulcke K., Cools K., Eelen H., Dekkers T. (2000). Soil dissipation of diuron, chlorotoluron, simazine, propyzamide and diflufenican herbicides after repeated applications in fruit tree orchards. Archives of Environmental Contamination and Toxicology. n°39, p. 60–65
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Diuron » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Daniel Mesquita Fernandes, Chimie environnementale Étude des effets du diuron sur l’environnement , PDF, 12 pages, 2010/12/08, consulté 2011/05/07
- Décision 2007/417/CE
- décision 2008/91/CE du 29 septembre 2008
- directive 2000/60/CE
- BRIGNON Jean-Marc in « Diuron » ; INERIS-DRC-07-86334-03507A, 5 mars 2007
- Thomas, K.V., McHugh, M., Waldock, M., 2002. Antifouling paint booster biocides in the UK coastal waters: inputs, occurrence and environmental fate. Sci. Total Environ. 293, 117–127.
- « Avis aux fabricants, distributeurs et utilisateurs de produits phytopharmaceutiques contenant les substances carbosulfan, carbofuran, diuron, cadusafos, haloxyfop-R », MINISTÈRE DE L’AGRICULTURE ET DE LA PÊCHE
- LACOSTE P. ; PICQUE E. ; DELATTRE J.-M., Rain water contamination study by pesticides in the region Nord-Pas-de-Calais ; European journal of water quality ; (ISSN 1818-8710) ; 2004, vol. 35, no2, p. 129-152 [24 page(s) (article)] (16 ref.); Lien Inist CNRS
- Effects of a herbicide Diuron [3-(3,4-Dichlorophenyl)-1,1-dimethylurea] and one of its biotransformation products, 3,4-dichloroaniline (3,4-DCA), on human spermatozoa
- THEVENOT Mathieu, DOUSSET Sylvie, HERTKORN Norbert, SCHMITT-KOPPLIN Philippe, ANDREUX Francis, Interactions of diuron with dissolved organic matter from organic amendments dans Science of the Total Environment no 407, 2009, p. 4297–4302.
- Étude de l'Ifremer sur la toxicité du Diuron et de l'Irgarol 1051 envers Chaetoceros gracilis (diatomée marine)
- IRSTEA, Les biofilms, sentinelles des rivières, à propos de modélisation de biofilms par l'Irstea-Lyon, consulté 2012-08-01
- Stéphane Pesce, Ahmed Tlili et Bernard Montuelle, Les biofilms aquatiques : dans quelles mesures permettent-ils de comprendre l’effet des pesticides sur le fonctionnement des cours d’eau ? Exemple en zone de vignoble ; Revue Ingénierie-EAT no 55-56
- Aurélie Villeneuve, Effets conjoints de facteurs physiques (lumière et vitesse du courant) et chimiques (pesticides) sur la structure et la composition du périphyton : une approche multi-échelles ; Thèse soutenue le 18 décembre 2008 (codirection Irstea-Inra), résumé ou résumé en anglais. Le pesticide testé était le diuron
- Manzo S, Buono S, Cremisini C., Toxic effects of irgarol and diuron on sea urchin Paracentrotus lividus early development, fertilization, and offspring quality ; Arch Environ Contam Toxicol. 2006 Jul;51(1):61-8. Epub 2006 Jan 30 (Résumé)
- Portail de la chimie
- Portail de la protection des cultures