Diisopropylamidure de lithium
Le diisopropylamidure de lithium (noté LDA de l'anglais Lithium diisopropylamide) est un composé très utilisé en chimie organique de formule brute C6H14LiN. Ce composé de formule LiN[CH(CH3)2)]2 est un amidure substitué. En solution, il se comporte comme une base forte (pKa d'environ 36) et très encombrée de telle sorte qu'il ne s'additionne pas (mauvais nucléophile) aux dérivés carbonylés.
| Diisopropylamidure de lithium | |
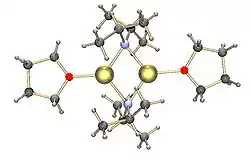
| |
| Dimère de LDA avec les atomes de lithium coordinés par du THF |
|
| Identification | |
|---|---|
| Nom UICPA | Diisopropylamidure de lithium |
| Synonymes |
LDA |
| No CAS | |
| No ECHA | 100.021.721 |
| No CE | 223-893-0 |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C6H14LiN [Isomères] |
| Masse molaire[1] | 107,123 ± 0,008 g/mol C 67,27 %, H 13,17 %, Li 6,48 %, N 13,08 %, |
| pKa | 36 (in THF) [2] |
| Propriétés physiques | |
| Solubilité | Soluble dans les éthers, les alcanes, ou le toluène. Décomposition dans l'eau. |
| Masse volumique | 0,79 |
| Précautions | |
| SGH[3] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Le LDA est préparé à partir de la diisopropylamine et du butyllithium[4]. Il est soluble dans les solvants organiques comme le THF et garde une très bonne réactivité à −78 °C.
Utilisations
Le diisopropylamidure de lithium sert en chimie organique pour favoriser les réactions d'élimination. Le LDA est aussi utilisé comme base pour la préparation de l'ion énolate par déprotonation d'énol.
Avantages par rapport au n-butyllithium
Alors que le n-butyllithium se montre très nucléophile à partir d'une certaine température, le LDA est beaucoup moins nucléophile tout en étant stable. C'est donc un réactif de choix dans certaines réactions.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- " Evan's pKa Table
- " Fiche de sécurité établie par Sigma-Aldrich, consultée le 05/01/2020
- Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, Corbas (Rhône), Librairie du Cèdre, , 22e éd., 785 p. (ISBN 978-2-916346-00-7, OCLC 421344172, notice BnF no FRBNF40102520), p. 509