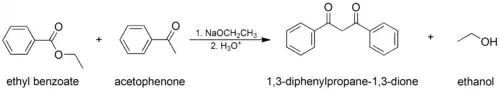
Condensation de Claisen
La condensation de Claisen (à ne pas confondre avec le réarrangement de Claisen) est une réaction omniprésente en milieu biologique. C'est une réaction formant une liaison carbone-carbone à partir de deux esters (ou deux thioesters par exemple) ou encore entre un ester et un composé carbonylé en présence d'une base forte, formant un β-cétoester ou une β-dicétone[1] :
 |
| Une animation du mécanisme |
Elle est nommée d'après Ludwig Claisen qui a publié une étude sur cette réaction en 1881[2],[3],[4].
Pré-requis
Au moins l'un des réactifs doit être énolisable (c'est-à-dire disposer d'un atome d'hydrogène sur le carbone en alpha). En fonction de la nature énolisable ou non des réactifs, il existe différents types de condensation de Claisen.
La base ne doit pas non plus interférer par une réaction de substitution nucléophile ou d'addition nucléophile sur le carbone du groupe carbonyle. Pour cette raison, on utilise en général l'alcoolate conjuguée de l'alcool formé par la réaction (par exemple l'éthanolate de sodium si on forme de l'éthanol), ce qui permet en plus de régénérer l'alcoolate. Dans les condensations de Claisen « croisées », une base non-nucléophile telle que le diisopropylamidure de lithium (LDA) peut être utilisée, puisqu'un seul composé est énolisable. Le LDA ne peut par contre pas être utilisé pour les condensations « classiques » ou les condensations de Dieckmann, car tous les esters peuvent être convertis en énolate d'ester et la condensation ne peut alors avoir lieu.
La partie alcoolate de l'ester doit aussi être un bon groupe partant. On utilise pour ça des esters de méthyle ou d'éthyle, ce qui forme des groupes méthonalate ou éthonalate.
Types
En fonction de la nature énolisable ou non des réactifs, il existe différents types de condensation de Claisen. Dans la condensation de Claisen « classique », seul un ester énolisable est utilisé :
Dans la condensation de Claisen « croisée », on utilise un ester ou une cétone énolisable et un ester non énolisable :
Dans la condensation de Dieckmann, on utilise une molécule portant deux groupes esters qui réagissent intramoléculairement en formant un β-céto ester cyclique. Dans ce cas, le cycle formé doit contenir au moins 5 ou 6 atomes afin de respecter la tension de cycle :
Biologie
On retrouve notamment la condensation de Claisen lors de la première étape de la cétogenèse lors de la condensation de deux acétyl-CoA en acétoacétyl-CoA.
On la retrouve également lors de la synthèse des acides gras à partir de malonyl-CoA qui va alors être redistribué par l'acide gras synthase pour mener à l'élongation des acides gras en cours de formation.
Variante
La condensation de Stobbe est une variante de la condensation de Claisen, qui utilise un diester succinique à la place de l'ester, et se condense sur un composé carbonylé pour former un ester α,β-insaturé. Du fait de la plus grande stabilisation du carbanion succinique, une base moins forte que celle utilisée dans la condensation de Claisen peut généralement être utilisée[5]. La réaction présente l'intérêt de fonctionner avec un grand nombre de substituants alkyles ou aryles, y compris de substituants encombrants.

Notes et références
- (en) F. A. Carey, Organic chemistry, New York, NY, McGraw-Hill, , 8e éd., 1333 p. (ISBN 978-0-07-340261-1, présentation en ligne), chap. 20 (« Enols and Enolates »), p. 882-884.
- (de) L. Claisen et A. Claparède, « Condensationen von Ketonen mit Aldehyden », Ber. Dtsch. Chem. Ges., vol. 14, no 2, , p. 2460-2468 (ISSN 0365-9496, DOI 10.1002/cber.188101402192).
- (de) L. Claisen, « Ueber die Einführung von Säureradicalen in Ketone », Ber. Dtsch. Chem. Ges., vol. 20, no 1, , p. 655-657 (ISSN 0365-9496, DOI 10.1002/cber.188702001150).
- (en) C. R. Hauser et B. E. Hudson, Jr., Organic Reactions, vol. 1, John Wiley & Sons, , 402 p. (ISBN 978-0-471-00462-2, DOI 10.1002/0471264180.or001.09, présentation en ligne), chap. 9 (« The Acetoacetic Ester Condensation and Certain Related Reactions »).
- Jerry March (en), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, New York, Wiley, , 3e éd., 1345 p. (ISBN 0-471-85472-7)
Voir aussi
- Portail de la chimie
- Portail de la biochimie