Bleu de Coomassie
Le bleu de Coomassie, ou Brilliant Blue, est un colorant bleu communément employé pour colorer les textiles (industrie), et les protéines (analyse chimique). En se liant aux protéines, le bleu de Coomassie permet de les doser en solution par colorimétrie (méthode de Bradford), ou de les visualiser en gel d'électrophorèse type SDS-PAGE (Sodium DodedecylSulfate- PolyAcrylAmide Gel).
| Bleu de Coomassie | |
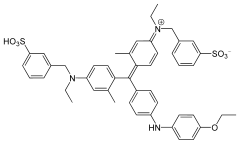
| |
| Structure du bleu de Coomassie G-250 | |
| Identification | |
|---|---|
| Synonymes | |
| No CAS | |
| No ECHA | 100.025.509 |
| No CE | 228-058-4 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C47H49N3NaO7S2 |
| Masse molaire[1] | 855,028 ± 0,054 g/mol C 66,02 %, H 5,78 %, N 4,91 %, Na 2,69 %, O 13,1 %, S 7,5 %, 856.03 g/mol |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le bleu de Coomassie est un triphenylmethane qui existe sous deux formes : G-250 (également appelé Brilliant Blue G, Acid Blue 90, C.I. 42655, ou Brilliant Blue G 250) et le R-250 (Brilliant Blue R, C.I. 42660, C.I. Acid Blue 83, Brilliant indocyanine 6B). D'autres existent, par exemple le Coomassie Blue RL (Acid Blue 92, C.I. 13390), de structure très différente.
Les 2 formes R-250 et G-250 diffèrent par leur couleur (bleu teinté de vert pour le R250, bleu teinté de rouge pour le G-250), et selon le pH (le G-250 devient peu coloré entre pH 2 et 3). Ceci repose sur leur différence de structure (2 groupes methyl pour le G-250), qui affecte également la coloration donnée aux protéines selon la composition de ces dernières: l'interaction Coomassie/protéines implique des interactions ioniques (via les 2 groupes sulfonyl et les groupes azote), mais aussi hydrophobes complexes - impliquant les acides aminés aromatiques (phenylalanine, tyrosine, tryptophane) et à chaine basique (arginine surtout, lysine, histidine). Enfin, le G-250 est plus hydrosoluble[2].
Les 2 formes R-250 et G-250 peuvent être utilisées dans une même application, mais de façon non interchangeable car notamment elles ne colorent pas les protéines de la même façon.
Usage en laboratoire

Le bleu de Coomassie G-250 est largement utilisé pour le dosage des protéines en solution par colorimétrie (méthode de Bradford). Le R-250 est plutôt utilisé pour la coloration des protéines sur gel d'électrophorèse, et plus récemment aussi le G-250 (sans étape de décoloration).
- Dans la méthode de Bradford, le bleu de Coomassie forme avec les protéines en milieu acide un complexe soluble dont l'absorbance initiale de 465 nm vire à 595 nm, l'intensité de coloration étant proportionnelle à la concentration en protéines. L'absorbance permet de calculer, avec la loi de Beer-Lambert, la concentration en protéines. Cependant l'intensité de coloration dépend aussi en partie de la nature de la protéine dosée.
- Pour l'électrophorèse sur gel de polyacrylamide en présence de sodium dodécyl sulfate (SDS-PAGE), après migration des protéines, le gel est démoulé puis trempé dans une solution acide du colorant, et enfin soumis à des lavages pour enlever l'excès de bleu faisant apparaitre les bandes protéines en bleu[3]. Des formulations avec le Coomassie G-250, dites colloïdales, permettent de s'affranchir de l'étape de lavage pour une première lecture directe, le lavage restant néanmoins utilepour une lecture optimale.
Formule des solutions de coloration et de lavage pour les gels d'électrophorèse
- Solution de coloration
- 2,5 g de bleu de Coomassie R-250,
- 455 ml de méthanol (ou d'éthanol),
- 455 ml d'eau distillée et désionisée (ddH2O),
- 90 ml d'acide acétique glacial (GAA) (ou d'acide citrique)
- Solution de lavage (décoloration)
- 455 ml de méthanol (ou d'éthanol),
- 455 ml de ddH2O,
- 90 ml de GAA.
Le lavage peut également être effectué à l'eau, en chauffant.
Une solution éthanol 10 % acide acétique 10 % est très efficace, surtout chauffée (passage au four à micro-ondes de quelques minutes), et bien moins toxique que le méthanol.
Formule classique du réactif de Bradford
- 0,01 % de bleu de Coomassie G-250
- 4,7 % d'éthanol,
- 8,5 % d'acide phosphorique, in ddH2O.
Autres applications
Le bleu de Coomassie a été utilisé en vue de diverses autres applications : dans le domaime médical (expériences sur le rat [4],[5]), en dépistage d'empreintes digitales (permettant de distinguer les empreintes mâles et femelles, ces dernières étant plus riches en acides aminés aromatiques et basiques)[6].
Nom
Comme pour beaucoup de colorants, le bleu de Coomassie tient son nom de la localité africaine de Kumasi, actuellement dans le territoire du Ghana; il était développé comme teinture pour laine acide, et fut nommé en commémoration de l'occupation britannique de la capitale d'Ashanti en 1896, alors appelée Coomassie[7].
Liens externes
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche technique du Coomassie Brilliant Blue sur Interchim.com
- T. S. Meyer et B. L. Lamberts, « Use of Coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips », Biochimica et Biophysica Acta (BBA) - General Subjects, vol. 107, , p. 144–145 (DOI 10.1016/0304-4165(65)90403-4, lire en ligne, consulté le )
- (en) Peng, W., « Systemic administration of an antagonist of the ATP-sensitive receptor P2X7 improves recovery after spinal cord injury », Proc Natl Acad Sci U S A., 2009 jul 27, p. 106(30): 12489–12493. (DOI 10.1073/pnas.0902531106, lire en ligne)
- "Blue M&Ms 'mend spinal injuries'". Telegraph. 2009-07-28. Retrieved 2010-01-19. https://www.telegraph.co.uk/news/science/science-news/5921266/Blue-MandMs-mend-spinal-injuries.html "Blue Food Dye Treats Spine Injury in Rats". Wired.com. 2009-07-27. https://www.wired.com/2009/07/bluerats/
- (en) Brunelle, Erica, « Coomassie Brilliant Blue G-250 Dye: An Application for Forensic Fingerprint Analysis », Analytical Chemistry. 89 (7), , p. 4314–4319 (e-ISSN 0003-2700, PMID 28293949, DOI 10.1021/acs.analchem.7b00510, lire en ligne)
- Portail de la chimie
- Portail des couleurs
- Portail du textile
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie