Acide mélilotique
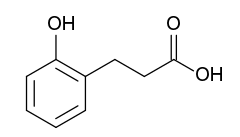
L'acide mélilotique ou acide 3-(2-hydroxyphényl)propanoïque est un composé aromatique de la famille des acides phénylpropanoïques, un sous-groupe des phénylpropanoïdes et des acides phénoliques. Il est notamment présent dans le mélilot officinal (Melilotus officinalis)[5] où il a été découvert et dont il tire son nom.
| Acide mélilotique | |
| |
| Identification | |
|---|---|
| Nom systématique | acide 3-(2-hydroxyphényl)propanoïque |
| Synonymes |
acide 3-(2-hydroxyphényl)propionique, acide o-hydroxyphénylpropionique, , acide orthohydroxyphénylpropionique |
| No CAS | |
| No ECHA | 100.156.954 |
| PubChem | 873 |
| SMILES | |
| InChI | |
| Apparence | poudre blanc cassé[1] |
| Propriétés chimiques | |
| Formule | C9H10O3 [Isomères] |
| Masse molaire[2] | 166,1739 ± 0,0088 g/mol C 65,05 %, H 6,07 %, O 28,88 %, |
| pKa | 4,22[3] |
| Propriétés physiques | |
| T° fusion | 86 à 89 °C[1] |
| Solubilité | 2,76 g·L-1[3] |
| Cristallographie | |
| Système cristallin | monoclinique[4] |
| Classe cristalline ou groupe d’espace | P21/c [4] |
| Précautions | |
| SGH[1] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
Outre le mélilot officinal, il est présent dans un grand nombre de plantes, par exemple Dipteryx odorata[6], la renouée bistorte (Polygonum bistorta) [7], Gliricidia sepium[8], Justicia pectoralis[9], Erythrina variegata, Moringa oleifera et le tribule terrestre (Tribulus terrestris)[10].
D'un point de vue alimentation humaine, on peut citer parmi les aliments les plus riches en acide mélilotique la betterave rouge, la cannelle de Chine et la myrtille[3]. Il a également été détecté dans le corps humain humains, principalement dans les selles. Il semble que l'acide mélilotique soit un métabolite microbien majeur de la (+)-catéchine et de l'(-)-épicatéchine chez les microbiotes fécaux humains[11] À l'intérieur des cellules, on le trouve principalement dans le cytoplasme[3].
Biosynthèse et métabolisme
L'acide mélilotique peut être biosynthétisé à partir de l'acide propanoïque. La 2-coumarate réductase (en) (ou mélilotate déshydrogénase) peut le convertir en acide orthocoumarique.
Propriétés
L'acide mélilotique se présente sous la forme d'une poudre blanc cassé qui fond vers 86 à 89 °C[1]. C'est un acide faible (dont la base conjuguée est le mélilotate), relativement peut soluble dan l'eau. Il cristallise dans une structure monoclinique, de groupe d'espace P21/c[4].
Applications
L'acide mélilotique aurait un effet antiulcérogène. Il a été montré qu'il prévenait l'ulcérogenèse induite par la sérotonine chez le rat[12].
L'acide mélilotique est un substrat de croissance adéquat pour diverses souches d'E. coli[13] et est utilisé comme standard dans l'étude du métabolisme microbien des stéréoisomères de la catéchine[11].
Notes et références
- (pl) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en polonais intitulé « Kwas melilotowy » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 3-(2-Hydroxyphenyl)propionic acid, consultée le 15 septembre 2020.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Human metabolim database
- N. S. Begum, M. Jain, S. Chandrasekhar, K. Venkatesan, « Structure of 3-(2-hydroxyphenyl) propionic acid », Acta Crystallographica Section C, Crystal Structure Communications, vol. 48, no 6, , p. 1076-1078 (DOI 10.1107/S0108270191012970)
- (en) Debra Rayburn, Let's Get Natural with Herbs, Ozark Mountain Publishing, (ISBN 9781886940956, lire en ligne), p. 295
- (en) Natural sources of flavouring. Report No. 2, Belgique, =Council of Europe Publishing, (ISBN 9789287161567, lire en ligne)
- (en) Chung Ki Sung, Takeatsu Kimura, Paul P.H. But, Ji-Xian Guo, International Collation of Traditional and Folk Medicine. Northeast Asia, vol. 3, World Scientific, (ISBN 9789810236397, lire en ligne), p. 26
- (en) Stephen G. Reynolds, John Frame, Grasslands: Developments, Opportunities, Perspectives, Science Publishers, (ISBN 9781578083596, lire en ligne), p. 93
- J X de Vries, B Tauscher, G Wurzel, « Constituents of Justicia pectoralis Jacq. 2. Gas chromatography/mass spectrometry of simple coumarins, 3-phenylpropionic acids and their hydroxy and methoxy derivatives. », Biomedical & environmental mass spectrometry, vol. 15, no 8, , p. 413-7 (DOI 10.1002/bms.1200150802)
- (en) M. Daniel, Medicinal Plants. Chemistry and Properties, Science Publishers, , 23, 89, 127 p. (ISBN 9781578083954, lire en ligne)
- R Burlingame, P J Chapman, « Catabolism of phenylpropionic acid and its 3-hydroxy derivative by Escherichia coli. », Journal of bacteriology, vol. 155, no 1, jillet 1983, p. 113-21 (DOI 10.1128/JB.155.1.113-121)
- S Tanaka, Y H Yoon, H Fukui, M Tabata, T Akira, K Okano, M Iwai, Y Iga, K Yokoyama, « Antiulcerogenic compounds isolated from Chinese cinnamon », Planta medica, vol. 55, no 3, , p. 245-8 (DOI 10.1055/s-2006-961994)
- Aura AM, et al., « Microbial metabolism of catechin stereoisomers by human faecal microbiota: comparison of targeted analysis and a non-targeted metabolomics method », Phytochemistry Letters, vol. 1, no 1, , p. 18-22 (DOI 10.1016/j.phytol.2007.12.001)
- Portail de la chimie