Syndrome de détresse respiratoire aiguë
Le syndrome de détresse respiratoire aiguë (SDRA) est un état critique (extrêmement grave) où la compliance pulmonaire et la capacité d'échanges gazeux chutent radicalement.
de détresse respiratoire aiguë

| Spécialité | Pneumologie et médecine d'urgence |
|---|---|
| Symptôme | Dyspnée, tachypnée et cyanose |
| CISP-2 | R99 |
|---|---|
| CIM-10 | J80 |
| CIM-9 | 518.5, 518.82 |
| DiseasesDB | 892 |
| MedlinePlus | 000103 |
| eMedicine | 165139 |
| eMedicine | med/70 |
| MeSH | D012128 |
![]()
Il traduit une atteinte de la membrane alvéolo-capillaire induisant un œdème pulmonaire lésionnel.
Cette manifestation peut apparaître dans un grand nombre de situations pathologiques avec des mécanismes différents. Il est caractérisé par une inflammation du parenchyme pulmonaire qui mène à des anomalies d'échanges de gaz avec une libération en parallèle de médiateurs inflammatoires du parenchyme pulmonaire qui causent une inflammation, une hypoxémie ; souvent une défaillance multiviscérale en résulte.
Son traitement, à la fois étiologique et symptomatique, ne permet une survie que dans la moitié des cas pour les SDRA dits « sévères ». Son pronostic reste donc encore très sombre et il peut laisser des séquelles importantes.
Historique
Il a été décrit pour la première fois en 1967[1].
Épidémiologie
Il atteint 10 % des patients en réanimation[2]. L'incidence, aux États-Unis, est comprise entre 10 et 90 cas par 100 000 patients[3].
Physiopathologie
Le syndrome de détresse respiratoire aiguë comprend classiquement trois phases[3] : une première, « exsudative », avec extravasation de liquides et de protéines dans l'alvéole, une deuxième, « proliférative », avec recrutement de macrophages et sécrétion de cytokines, une dernière, de « cicatrisation » qui peut se compliquer par la formation d'une fibrose.
Symptômes
Généralement d'installation aiguë[4] :
- tachypnée, dyspnée avec hypoxie, hypocapnie initialement, confusion
- cyanose réfractaire à l'oxygénothérapie,
- râles crépitants à l'auscultation, réalisant une insuffisance respiratoire aiguë
- tirage : intercostal, sus sternal, sous sternal et sus claviculaire.
Histologie
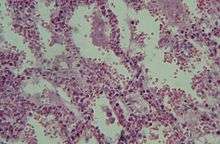
Le dommage alvéolaire diffus (DAD) comporte 3 stades[5] :
- Phase aiguë, exsudative : dépôt de membranes de fibrine le long des parois alvéolaires
- infiltrat diffus neutrophilique avec hémorragie, destruction des pneumocytes I
- œdème riche en protéines, fibrine + surfactant inactivé comblant les alvéoles pulmonaires
- altération des pneumocytes II, diminution de la synthèse du surfactant pulmonaire
- dure à peu près 6 jours
- Phase subaiguë, proliférative
- hyperplasie, métaplasie des pneumocytes II
- début d'organisation fibreuse
- dure de 4 à 10 jours
- Phase chronique
- réorganisation fibreuse interstitielle
Causes et facteurs de risque
Il s'agit d'une maladie de la membrane alvéolo-capillaire entraînant une dysfonction de l'oxygénation du sang. Les causes peuvent être
- Pulmonaire :
- Pneumopathie
- Inhalation
- Embolies
- Infiltration
- Traumatisme
- Extra-pulmonaire :
- Choc
- Sepsis
- Polytraumatisé
- Toxique
- Éclampsie
- Produits de contraste
- Acidocétose
Il existe des facteurs de risque génétiques[6], dont des variants de l'ACE[7].
Éléments du diagnostic
L'ARDS Definition task force a proposé, en 2012, un ensemble de critères dits « de Berlin »[8] afin de pallier les imprécisions des précédents critères diagnostiques (imprécision sur la définition du caractère aigu, absence de niveau de PEEP (positive end-expiratory pressure), chevauchements des notions d'acute lung injury (ALI) et acute respiratory distress syndrome, etc.) La notion d'ALI a, par ailleurs, été supprimée aux dépens de celle de SDRA léger :
- délai : < 7 jours depuis une agression clinique connue avec nouveau symptômes ou aggravation des symptômes respiratoires ;
- imagerie : opacités bilatérales non complètement expliquées par un épanchement, une atélectasie, des nodules ;
- origine de l’œdème : détresse respiratoire non complètement expliquée par une défaillance cardiaque ou une surcharge volémique (échocardiographie nécessaire) ;
- puis selon la gravité du SDRA :
- SDRA léger : PaO2/FiO2 entre 200 et 300 mmHg avec PEEP ou CPAP ≥ 5 cm H2O
- SDRA modéré : PaO2/FiO2 entre 100 et 200 mmHg avec PEEP ≥ 5 cm H2O
- SDRA sévère : PaO2/FiO2 ≤ 100 mmHg avec PEEP ≥ 5 cm H2O
De nombreuses autres définitions existent :
- celle de la conférence de consensus américano-européenne sur le SDRA (AECC)[9] :
- état clinique du patient : détresse respiratoire d'installation aiguë,
- gaz du sang perturbés : rapport PaO2/FiO2 < 200 [en cas de rapport PaO2/fiO2 < 300, on parle d'ALI (en anglais : acute lung injury)],
- radiographie de poumon : infiltrat bilatéral,
- absence d'étiologie cardiaque à l'œdème pulmonaire : PAPO 18 mmHg, bonne fonction cardiaque à l'échographie ou absence de signes cliniques d'insuffisance cardiaque,
- Définition d'Ashbaugh[4] :
- tachypnée,
- hypoxémie,
- cyanose réfractaire à l'oxygénothérapie,
- perte de compliance pulmonaire,
- infiltrat alvéolaire diffus sur la radiographie du thorax,
- définition de Murray[10], le Lung Injury Score :
| Score | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| radiographique du thorax : nombre de quadrants avec un syndrome alvéolaire | 0 | 1 | 2 | 3 | 4 |
| Hypoxémie (PaO2/fiO2) | 300 | 225–299 | 175–224 | 100–174 | 100 |
| Niveau de PEEP (Positive End-Expiration Pressure) | 5 cm H2O | 6-8 cm H2O | 9-11 cm H2O | 12-14 cm H2O | 15 cm H2O |
| Compliance pumonaire (mL/cm H2O) | 80 | 60-79 | 40-59 | 20-39 | 20 |
Faire la somme des items utilisés puis à diviser pas le nombre d'items utilisés. Un Lung Injury Score 2,5 définit alors le SDRA.
Définition Delphi du SDRA[11] :
- hypoxémie : PaO2/FiO2 200 avec une PEEP 10 cm H2O ;
- radiographie de thorax : atteinte bilatérale ;
- début : en moins de 72 heures ;
- pas de signes cliniques d'insuffisance cardiaque :
- PAPO 18 mmHg ou FEVG 40 %,
- présence d'un facteur de risque de SDRA.
Proposition de la SRLF (recommandations d'experts 2005)[réf. souhaitée] :
- présence des critères de l'AECCA ;
- persistance d'une PaO2/FiO2 200 ;
- après 24 h ;
- avec une PEEP 5 cm H2O
Modalités thérapeutiques
Dans tous les cas, le traitement de la cause doit être fait lorsque cela est possible (traitement d'une infection par exemple)
Ventilation mécanique
Les modalités de la ventilation mécanique au cours du SDRA a fait l'objet de la publication de recommandation par différentes sociétés savantes américaines et européennes[12].
Elle peut aggraver les dommages aux tissus pulmonaires déjà induits par cette affection. On vise donc à minimiser les risques de volo/barotrauma, quitte à permettre un niveau relativement élevé d'hypercapnie (hypercapnie permissive) et d'hypoxémie. On se basera, pour cela, sur la mesure de la pression alvéolaire (pression de plateau inspiratoire) qui doit être ≤ 30 cm H2O. On cherchera par ailleurs à surveiller l'apparition d'une hyperinflation dynamique (appelée autrement auto-PEEP) potentiellement responsable de tamponnade gazeuse. En gros, le volume courant est réglé à un bas niveau (6 ml/kg) par rapport à d'habitude[13].
Selon la théorie de l'open lung ventilation certaines alvéoles affaissées peuvent être maintenues ouvertes par un niveau de PEEP plus élevé[14] (selon le niveau de FiO2) après avoir été recrutées par de hautes pressions de ventilation (40-50 cm H2O) : c'est le concept du recrutement alvéolaire. La méthode de recrutement alvéolaire (méthode apnéique, non-apnéique et décubitus ventral) ne fait pas encore l'objet de consensus mis à part l'intérêt démontré récemment pour le décubitus (ou position) ventral à la phase aiguë des SDRA les plus sévères[15].
Les niveaux de PEEP sont probablement différents selon que le SDRA soit d'allure focale (PEEP probablement non élevée) ou d'allure diffuse (PEEP probablement élevée).
L'objectif de PaO2 est probablement entre 55 et 80 mmHg.
Thérapeutique non ventilatoire
- Vasodilatateur inhalé (oxyde nitrique…) ;
- Drainage des épanchements pleuraux[16]
- La sédation est très souvent pratiquée , en revanche, la curarisation des patients fait de l'objet de débats, à cause d'importants effets indésirables [16],[17] ;
- ECMO (Extra-corporeal membrane Oxygenation) ;
- Épurateur de CO2 (intérêt discuté) ;
- corticothérapie à la phase fibroproliférative.
Thérapeutique n'ayant pas fait la preuve de leur efficacité
La ventilation oscillatoire à haute fréquence ne fait plus partie des modalités de ventilation utilisées (certains sous-groupes de patients pourraient peut-être encore en bénéficier mais des études complémentaires sont nécessaires)[18],[19].
La ventilation liquidienne aux perfluorocarbones reste du domaine de la recherche.
Pronostic
Il s'agit d'une atteinte grave et la mortalité peut atteindre 50 % dans les formes les plus sévères[2]. Même après guérison, il peut exister des séquelles musculaires, neurologiques, cognitives ou psychologiques[20], avec une baisse de la forme physique sur plusieurs années[21].
Notes et références
- Ashbaugh DG, Bigelow DB, Petty TL, Levine BE, Acute respiratory distress in adults, Lancet, 1967;2:319-323
- Bellani G, Laffey JG, Pham T et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries, JAMA, 2016;315:788-800
- Thompson BT, Chambers RC, Liu KD, Acute respiratory distress syndrome, N Engl J Med, 2017;377:562-572
- (en) Ashbaugh « Acute respiratory distress in adults » Lancet 1967;2(7511):319-23
- (en) « Pathology of the adult respiratory distress syndrome » Crit Care Clin. 1986;2(3):405-28.
- Meyer NJ, Christie JD, Genetic heterogeneity and risk of acute respiratory distress syndrome, Semin Respir Crit Care Med, 2013;34:459-474
- Marshall RP, Webb S, Bellingan G, et al. Angiotensin converting enzyme insertion/deletion polymorphism is associated with susceptibility and outcome in acute respiratory distress syndrome, Am J Respir Crit Care Med, 2002;166:646-650
- (en) ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. « Acute Respiratory Distress Syndrome : The Berlin Definition » JAMA 2012;307(23):2526-33.
- (en) « The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. » Am J Respir Crit Care Med. 1994;149(3 Pt 1):818-24.
- (en) Murray « An expanded definition of the adult respiratory distress syndrome » Am Rev Respir Dis. 1988 Sep;138(3):720-3
- (en) Ferguson « Development of a clinical definition for acute respiratory distress syndrome using the Delphi technique » J Crit Care 2005 Jun;20(2):147-54
- Fan E, Del Sorbo L, Goligher EC et al. An official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine clinical practice guideline: mechanical ventilation in adult patients with acute respiratory distress syndrome, Am J Respir Crit Care Med, 2017;195:1253-1263
- The Acute Respiratory Distress Syndrome Network, Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome, N Engl J Med, 2000;342:1301-1308
- (en) « Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial » JAMA. 2008;299(6):646-55.
- (en) « Prone positioning in severe acute respiratory distress syndrome » N Engl J Med. 2013;368(23):2159-68.
- Docteur Dominique FALCON, « Le syndrome de détresse respiratoire aigu », Corpus médical de la faculté de médecine de Grenoble , Août 2002. lire en ligne
- (en) « Neuromuscular blockers in early acute respiratory distress syndrome » N Engl J Med. 2010;363(12):1107-16.
- (en) Ferguson ND, Cook DJ, Guyatt GH, Mehta S, Hand L. et al. ; Oscillate Trial Investigators; Canadian Critical Care Trials Group « High-frequency oscillation in early acute respiratory distress syndrome » N Engl J Med. 2013;368(9):795-805.
- (en) Young D, Lamb SE, Shah S, MacKenzie I, Tunnicliffe W. et al. Oscar Study Group « High-frequency oscillation for acute respiratory distress syndrome » N Engl J Med. 2013;368(9):806-13.
- Herridge MS, Moss M, Hough CL et al. Recovery and outcomes after the acute respiratory distress syndrome (ARDS) in patients and their family caregivers, Intensive Care Med, 2016;42:725-738
- Herridge MS, Tansey CM, Matté A et al. Functional disability 5 years after acute respiratory distress syndrome, N Engl J Med, 2011;364:1293-1304
Articles connexes
- Poumon
- Œdème pulmonaire
- Respiration
- Choc anaphylactique
- Surfactant pulmonaire
- Insuffisance respiratoire
- Choc (médecine)
- Portail de la médecine