Onchocercose
L’onchocercose ou cécité des rivières est une filariose cutanée, due à un nématode parasite Onchocerca volvulus, lequel peut vivre jusqu'à quinze années dans le corps humain.

| Spécialité | Infectiologie (en) |
|---|---|
| Symptôme | Lymphadénite, cécité, exanthème, nodule, dépigmentation (en) et lichenification (en) |
| CIM-10 | B73 |
|---|---|
| CIM-9 | 125.3 |
| DiseasesDB | 9218 |
| eMedicine | 224309 et 1204593 |
| eMedicine | med/1667 oph/709 |
| MeSH | D009855 |
![]()
Morphologie

Le parasite est un ver blanc, opalin, finement strié transversalement.
Le mâle, très petit, mesure 3 à 4 cm et son extrémité postérieure est recourbée.
La femelle atteint 50 cm pour un diamètre de 0,3 à 0,4 mm.
Cycle parasitaire
Le cycle évolutif est à deux hôtes : l'homme, hôte définitif, et un insecte, la simulie, hôte intermédiaire et vecteur.
L'infestation s'effectue par piqûre de la simulie, un insecte diptère nématocère Simuliidae, notamment l'espèce Simulium damnosum. Il y a deux foyers mondiaux : l'Afrique centrale et l'Amérique centrale.
Le cycle parasitaire d’ O.volvulus débute quand une femelle du genre Simulie infestée de parasites prend un repas de sang. La salive contenant des larves d’O.volvulus au troisième stade passe dans le sang de l’hôte. Ensuite les larves migrent vers le tissu sous cutané où elles forment des nodules et deviennent matures sous la forme de vers adultes au bout de six à douze mois. Après maturation, les mâles adultes migrent à partir des nodules vers le tissu sous-cutané où ils s’accouplent aux femelles adultes de plus grande taille, produisant entre 1000 et 3000 œufs par jour. La durée de vie normale d’un ver adulte peut aller jusqu'à 15 ans. Les œufs subissent une maturation interne pour parvenir au stade des microfilaires, qui sont libérées du corps de la femelle un par un et restent dans le tissu sous-cutané (et plus particulièrement dans les kystes).
À la première étape les microfilaires infectent les simulies au cours d’un repas de sang, elles poursuivent leur développement dans l’hôte intermédiaire où elles arrivent à maturité en une à trois semaines pour atteindre le troisième stade larvaire, bouclant ainsi le cycle parasitaire. L’homme est le seul hôte définitif pour O. Volvulus. La durée de vie normale des microfilaires est de 1 à 2 ans.
Épidémiologie, écoépidémiologie

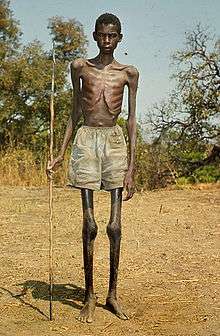

Elle atteint 37 millions de personnes, essentiellement en Afrique, avec quelques foyers en Amérique centrale[1], à proximité des rivières hébergeant la mouche vectrice.
Physiopathologie
Les vers adultes restent dans les nodules sous-cutanés, ce qui limite leur exposition au système immunitaire de l’hôte. Les microfilaires, en revanche, peuvent induire des réponses inflammatoires intenses, particulièrement au moment de leur mort. Les microfilaires en mourant libèrent des antigènes dérivés de Wolbachia, une bactérie vivant en endosymbiose avec le parasite, déclenchant des réactions immunitaires responsables de l'inflammation et de la morbidité associée. La sévérité de la maladie est directement proportionnelle au nombre de microfilaires et à l’intensité de la réponse inflammatoire qui en résulte.
Symptômes de la maladie
Très souvent la maladie n'a pas de symptômes, mais l'infection oculaire donne toute sa gravité à la maladie, l'onchocercose étant la première cause de cécité dans les zones infestées et la deuxième cause de cécité d’origine infectieuse dans le monde.
Atteinte cutanée et sous-cutanée
Les autres manifestations sont :
- cutanées : gale filarienne avec prurit
- sous-cutanées : onchocercomes qui sont des kystes se formant autour des vers au-dessus de plans durs osseux
Les manifestations cutanées (gale filarienne) comprennent habituellement des démangeaisons, de l’œdème, et une inflammation intense. Un système d'évaluation s'est développé pour classer le degré d’atteinte cutanée :
- Dermite aiguë avec papules – Le prurit est localisé (papules) ;
- Dermite chronique avec papules – Les papules sont plus grandes et provoquent une hyperpigmentation ;
- Dermite lichenifiée avec des papules et des plaques dépigmentée, avec également œdème, lymphœdème, prurit et infections bactériennes banales secondaires ;
- Atrophie cutanée avec perte d'élasticité de la peau ressemble à du papier de soie, aspect « de peau de lézard » ;
- Dépigmentation avec aspect « de peau de léopard », habituellement sur la face antérieure de la jambe.
Atteinte oculaire
L’atteinte oculaire donne son nom à l'onchocercose, la cécité du fleuve. La surface de la cornée est une autre région vers laquelle migrent les microfilariae, et où elles sont également attaqués par le système immunitaire. Dans la zone qui est lésée, il se produit une kératite ponctuée, qui s’atténue lorsque l'inflammation diminue. Cependant, si l'infection devient chronique, une kératite sclérosante peut se produire, provoquant une opacité de la zone affectée. Avec le temps la cornée tout entière peut devenir opaque, ce qui conduit à la cécité[2].
Atteinte neurologique
Selon une étude du NIH[3], cette parasitose pourrait être la cause du syndrome du hochement de tête, une forme d'épilepsie frappant des enfants en Afrique dans des zones d'endémie : Tanzanie, Ouganda, sud du Soudan. Il pourrait s'agir d'une maladie auto-immune, les anticorps développé contre la parasitose s'attaquant également à la protéine leiomodine 1 présente dans certaines cellules du cerveau.
Diagnostic
Le parasite peut être décelé sur des biopsies de peau[4].
La recherche des antigènes parasitaires n'est pas fiable. La détection des anticorps peut être simplifiée par l'utilisation de cartes réactives et a une bonne sensibilité et spécificité[5].
Traitement et prévention
.jpg)
Le traitement de l'onchocercose est l’ivermectine. Les personnes infectées peuvent être traitées en une prise tous les douze mois. Il est nécessaire d'associer des corticoïdes au traitement pour limiter les réactions inflammatoires induites par la mort des microfilaires[6]. La molécule paralyse les microfilaires et les empêche de provoquer des démangeaisons[réf. nécessaire]. En outre, alors que le médicament ne tue pas le ver adulte, il l’empêche de se reproduire. Il empêche donc la morbidité et la transmission.
Depuis 1988, l'ivermectine est fournie gratuitement par le laboratoire Merck & Co. dans le cadre du programme de la donation Mectizan (MDP). Le MDP collabore avec les ministères de la Santé et les organismes non gouvernementaux de développement tels que l'organisation mondiale de la santé pour fournir le Mectizan gratuitement à ceux qui en ont besoin dans les zones d’endémie.
Il y a plusieurs programmes de contrôle qui visent à mettre fin à l’existence de l'onchocercose en tant que problème de santé publique. Le premier était le programme de contrôle de l'onchocercose (OCP), qui a été lancé en 1974 et à son apogée a couvert 30 millions de personnes dans onze pays. Par l'usage de la pulvérisation de larvicides sur les fleuves pour contrôler les populations de mouches noires et, depuis 1988, l'utilisation de l'ivermectine pour traiter les personnes infectées, l'OCP a éliminé l'onchocercose de la liste des problèmes de santé publique. L'OCP, a conjugué ses efforts avec ceux de l'ONU, l’Organisation mondiale de la santé (OMS), la Banque mondiale, le Programme des Nations unies pour le développement et l’organisation pour la nourriture et l'agriculture (FAO). Ces actions ont été considérés comme des succès et sont arrivées à leur terme en 2002[7]. La surveillance continue pour s'assurer que l'onchocercose ne peut pas réinfester la zone contrôlée par l'OCP.
En 1992 le programme pour l'élimination de l'onchocercose dans les Amériques (OEPA) a été lancé. L'OEPA est basé également sur l’utilisation de l'ivermectine.
En 1995 programme africain pour le contrôle de l'onchocercose (APOC) a commencé à couvrir dix-neuf autres pays et à compter principalement sur l'utilisation de l'ivermectine. Son but est d'établir un approvisionnement communautaire en ivermectine pour ceux qui sont infectés. De cette façon, la transmission du parasite a été significativement réduite.
Le doublement des cas dans certaines communautés du Ghana entre 2000 et 2005 malgré un traitement bien conduit, se fait poser la question de l'apparition de souches résistantes à l'ivermectine[8].
La moxidectine est en cours de test et pourrait avoir une activité supérieure à celle de l'ivermectine[1].
Voir aussi
Articles connexes
Liens externes
Organisation pour la Prévention de la Cécité (OPC) : ONG française spécialisée dans la gestion complète de programmes de lutte contre la cécité évitable dans les pays en développement francophones. L'OPC œuvre depuis 1998 dans la mise en place d’un système de soins oculaires complets dans la stratégie de lutte contre l’onchocercose au Congo. Organisation pour la Prévention de la Cécité. Cette lutte est aussi prolongée au Mali, en Guinée et au Sénégal.
Notes et références
- (en) Taylor MJ, Hoerauf A, Bockarie M, « Lymphatic filariasis and onchocerciasis » Lancet 2010;376:1175-85.
- Nadah, M., Karmane, A., Salhi, Y., & Daoudi, R. (2009). Les manifestations oculaires de l’onchocercose: à propos d’un cas. Journal Français d'Ophtalmologie, 32, 1S173.
- (en) T. P. Johnson et al., « Nodding syndrome as an autoimmune reaction to Onchocerca volvulus », Science Translational Medicine, (présentation en ligne)
- A. Mahé, P. Huguet, M. Develoux, « Onchocercose », sur www.therapeutique-dermatologique.org, (consulté le 19 juillet 2012)
- (en) Weil GJ, Steel C, Liftis F. et al. « A rapid-format antibody card test for diagnosis of onchocerciasis » J Infect Dis. 2000;182:1796-9.
- Brigitte Girard, Uvéites postérieures et vascularites rétiniennes. Encyclopédie Médico-Chirurgicale, Ophtalmologie, 21-230-B-10. 1993 Éditions Scientifiques et Médicales Elsevier SAS.
- « Un demi-siècle de lutte contre l'onchocercose en Afrique de l'Ouest - L'engagement de la France. Ed. IRD, Paris, 2002; 8p. », (consulté le 19 mai 2017)
- (en)Osei-Atweneboana MY, Eng JKL, A Boakye DA, Gyapong JO, Prichard RK, Prevalence and intensity of Onchocerca volvulus infection and efficacy of ivermectin in endemic communities in Ghana: a two-phase epidemiological study, Lancet, 2007;369:2021-2029
- Portail de la médecine
- Portail de la parasitologie