Rein
Le rein est un organe du corps de nombreux animaux. Il a de multiples fonctions : hormonales, de régulation de la pression sanguine et d'élimination des toxines. Il assure ainsi, par filtration et excrétion d'urine, l'équilibre hydroélectrolytique (homéostasie) du sang et de l'organisme en général. Ses fonctions hormonales comprennent la synthèse de l'érythropoïétine, du calcitriol (forme active de la vitamine D) et de la rénine.
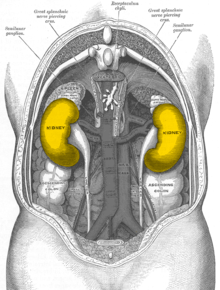
C'est un organe vital. Chez les amniotes, il est le plus souvent pair et situé dans l'abdomen, dans le rétropéritoine, suivant une symétrie plus ou moins bilatérale. Il est de taille et de conformation très variable en fonction des espèces : lisses chez les humains, lobulés chez les ruminants, diffus chez les oiseaux...
Par abus de langage, le langage courant nomme souvent reins la zone des vertèbres lombaires (ex.: « tour de reins » pour parler de lombalgie). Les reins de certains animaux de production sont consommés par les humains, sous le nom de rognons.
Anatomie chez l'être humain
Morphologie
Chez l'être humain, les reins sont des organes aplatis, ovoïdes, dits « en haricot ». La face externe est convexe ; la face interne est concave, et accueille le hile qui se projette au niveau de la 1re vertèbre lombaire : il constitue la zone de transit des éléments vasculo-nerveux et des voies excrétrices urinaires.
La surface des reins est lisse chez l'adulte, de couleur rouge-brun. En moyenne, ils ont pour hauteur 12 cm, largeur 6 cm, épaisseur 3 cm[1]. Ces mensurations sont très variables d'un individu à l'autre.
Situation
Les reins se situent dans l'espace rétropéritonéal, où ils se projettent par leur face postérieure dans la région lombaire. Celle-ci constitue d'ailleurs la principale voie d'abord chirurgicale du rein.
Ils sont placés entre la 11e vertèbre thoracique et la 3e lombaire (pour le rein gauche) et la 12e et l'espace entre la 3e et la 4e lombaire (pour le rein droit), le rein droit subissant la pression du foie sus-jacent.
Ils s'orientent[1] :
- dans le plan frontal, selon un angle d'environ 18° avec l'axe médian (orientés vers le bas et en-dehors) ;
- dans le plan transversal, selon un angle de 40 à 60° avec l'axe sagittal (orientés vers l'avant et en dedans)
Vascularisation
Un seul rein suffit pour vivre ; 5 % des individus n'ont qu'un rein, mais dans ce cas il s'agit le plus souvent du rein droit, mieux vascularisé et grâce à la présence du quadrilatère de Rogié qui favorise la stase veineuse et a des répercussions au niveau génital gauche.
Le rein est vascularisé par les artères et veines rénales et c'est par une échancrure dans la face concave que ces vaisseaux pénètrent dans le rein (hile du rein).
Le parenchyme rénal est entouré d'une capsule dure, très résistante qui le protège. La partie périphérique du parenchyme est le cortex alors que la partie centrale est la médulla. Cette médulla n'est pas continue : elle est interrompue par des prolongements du cortex qui vont jusqu'au sinus rénal.
Innervation
Le rein est innervé par le système orthosympathique et parasympathique.
L'innervation parasympathique est assurée par le nerf vague (X)[2].
L'innervation orthosympathique émerge des segments de la moelle spinale T10 à L1. Les fibres pré-synaptiques vont se réunir pour former les nerfs splanchniques, ceux-ci font synapse principalement dans le ganglion aortico-rénal. De là partent les fibres post-synaptiques qui vont innerver le rein[2]. Accessoirement on peut retrouver une innervation du 1er nerf splanchnique lombaire et l'implication des ganglions mésentérique supérieur et rénal.
Pour plus de détails sur l'innervation orthosympathique des viscères de l'abdomen, consultez l'article concernant les plexus prévertébraux.
Physiologie
Le rein a aussi une fonction endocrine (érythropoïétine, système rénine-angiotensine-aldostérone, calcitriol).
En raison de caractéristiques génétiques[3] ou liées aux traits de vie, la capacité des reins varie significativement selon les individus et selon l'âge. Elle est médiocre chez le nouveau-né et décline chez l'adulte avec l'âge. Les capacités fonctionnelles du rein peuvent être dégradées par diverses maladies et par l'exposition à certains toxiques (fluor, plomb, cadmium, autres métaux lourds, alcool ou excès de sodium…). En cas de déficience grave, les derniers recours sont la filtration externe du sang dans un rein artificiel (dialyse), ou la greffe de rein.
Architecture interne du rein
De l'extérieur vers l'intérieur :
Zone corticale
Elle comporte les glomérules, les tubes contournés proximaux et distaux et les tubes collecteurs. Les colonnes de Bertin, dans les espaces entre les pyramides de Malpighi.
Zone médullaire
- Pyramides rénales ou de Malpighi ; dont la base est sous-corticale et la pointe tournée vers l'intérieur, forment les papilles sur lesquelles viennent se ventouser les petits calices. Elles comportent les tubes droits proximaux et distaux ainsi que l'anse de Henle, et les canaux de Bellini.
Une pyramide et ses colonnes forment un lobe du rein.
Les néphrons qui se déversent dans le même canal collecteur forment collectivement un lobule du rein.
Calices
Les petits calices recueillent l'urine émise par les pyramides de Malpighi. L'union des petits calices forment les grands calices, il y a trois ou quatre grands calices par reins. Tube abouché à la pointe de la pyramide rénale, et qui en se rejoignant forment le bassinet.
Pelvis rénal ou bassinet
Tube en forme d'entonnoir qui se jette dans l'uretère. Il est également appelé pyélon. C'est l'endroit où va passer l'urine à sa sortie du néphron via le tube collecteur. Les bassinets tout comme les calices possèdent un tissu musculaire lisse qui se contracte et propulse l'urine par péristaltisme.
Développement et fonction embryonnaire et fœtale du rein
Le rein est issu de la métamérisation (segmentation puis formation de tubules) du mésoblaste intermédiaire (tissu du disque embryonnaire) en cordon néphrogène au cours de la 3e semaine de développement. Ce cordon se divise en 3 régions distinctes dans le temps et l'espace (selon un axe céphalo-caudal) qui vont évoluer successivement:
- - le cordon pronéphrogène (le plus céphalique) qui se métamérise en pronéphros. Ce premier rein ne fonctionne pas et dégénère à la fin de la 4e semaine de développement ;
- - le cordon mésonéphrogène qui se métamérise après la dégénérescence du pronéphros en mésonéphros. Ce rein fonctionne dès la fin de la 4e semaine de développement, mais il dégénérera également ;
- - le cordon métanéphrogène (le plus caudal) qui donne le métanéphros, rein fonctionnel, qui est le rein définitif. Il a la particularité de ne pas se métamériser.
Voir aussi le paragraphe sur l'embryologie du néphron.
Néphron
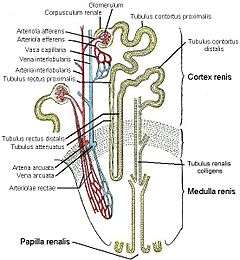
Le néphron est l'unité structurelle et fonctionnelle de base du rein.
C'est un tubule mince consistant en un amas de capillaires appelés glomérules, entourés d'un bulbe creux, la capsule de Bowman.
La capsule de Bowman amène à un long tubule entortillé en deux sections : le tubule contourné proximal, l'anse de Henle, le tubule contourné distal, et le tube collecteur.
Les tubes collecteurs se déversent dans les calices via les papilles, les calices se jettent dans le bassinet (appelé également pyélon), qui est connecté à l'uretère.
Chaque rein humain compte environ un million de néphrons. Le nombre de néphrons, fixé à la naissance, est d'une grande variabilité. Il dépend de multiples facteurs dont l'âge gestationnel, le retard de croissance intra-utérin, l'état nutritionnel maternel.
Capsule de Bowman
Il s'agit du début du néphron. C'est un sac aveugle renflé en ampoule à double-feuillet qui correspond à la partie urinaire du corpuscule de Malpighi. Elle reçoit l'ultrafiltrat du plasma filtré par la paroi du glomérule. Le liquide contenu dans cette capsule de Bowman constitue l'urine primitive. Sa composition va être modifiée dans le reste du néphron.
Tubule proximal
Il est situé après la capsule de Bowman et avant l'anse de Henle ; il participe à la réabsorption de certaines substances.
Réabsorption tubulaire
La réabsorption tubulaire possède deux mécanismes de transport à travers la membrane :
- un transport passif : l'osmose et la diffusion (exemple : l'eau est transférée par osmose) ;
- un transport actif : nécessité d'un travail cellulaire (exemple : le glucose, le sodium).
La paroi du tubule possède des transporteurs qui récupèrent certaines molécules pour les renvoyer dans le milieu intérieur (sang). C'est le cas par exemple du glucose : il est filtré intégralement par le glomérule pour se retrouver dans l'urine primitive au niveau de la capsule de Bowman. Dans des conditions normales, il est totalement réabsorbé par des transporteurs spécifiques et est totalement absent de l'urine finale. Il n'est plus réabsorbé si le taux est supérieur à 1,70 g/L, on parle de substance seuil. Dans le cas d'un diabète où le taux de sucre dans le sang est plus important, on retrouve du glucose dans les urines. C'est un premier témoin de la présence d'un diabète.
Le but de la réabsorption tubulaire est l'élaboration de l'urine définitive.
Il existe deux sortes de réabsorption :
- la réabsorption obligatoire : elle se fait dans le tube contourné proximal et qui a pour but d'élaborer la presque totalité du filtrat glomérulaire (99 %). Elle a lieu pour l'eau et le sodium (la réabsorption active du sodium associe une réabsorption passive de l'eau selon un phénomène d'osmose) ;
- la réabsorption facultative : elle est régulée par deux hormones :
- ADH (vasopressine) : hormone antidiurétique de la posthypophyse. Elle augmente la perméabilité du tube collecteur et favorise la réabsorption de l'eau grâce à l'ouverture de protéine transmembranaire appelée aquaporine. Par conséquent, l'ADH influence la concentration de l'urine sécrétée et influence le volume sanguin et la pression artérielle. La sécrétion de cette hormone est stimulée lors d'une hypovolémie notamment. Cela permet d'augmenter la réabsorption de l'eau dans le sang pour pallier une hypotension ;
- Aldostérone : sécrétée par les corticosurrénales. Elle favorise la réabsorption active du sodium dans le tube contourné distal et ainsi une réabsorption passive de l'eau.
Elle a pour but d'ajuster la composition de l'urine pour répondre aux besoins de l'organisme en maintenant l'homéostasie.
Ce mécanisme se met en route en cas d'hypotension liée à l'hypovolémie, en cas de déshydratation…
Si la volémie chute, la pression intra-rénale chute aussi. L'appareil juxta-glomérulaire (dans la capsule de Bowmann) sécrète alors de la rénine et convertit, lors du passage du sang dans le glomérule, l'angiotensinogène du foie en angiotensine 1. Pendant ce temps, les poumons sécrètent une enzyme de conversion qui transforme l'angiotensine 1 en angiotensine 2.
L'angiotensine 2 permet la vasoconstriction donc une augmentation de pression et une augmentation de la filtration glomérulaire qui n'a lieu que pour une pression suffisante de 60 mmHg.
La rénine déclenche aussi la sécrétion d'ADH et d'aldostérone et donc l'absorption de sodium afin de retrouver un équilibre hydro-électrolytique.
Sécrétion tubulaire
En parallèle avec la réabsorption tubulaire, la sécrétion tubulaire permet le passage de molécules du sang des capillaires péritubulaires vers le filtrat à travers les cellules du tubule. Elle permet d'éliminer dans l'urine des substances indésirables ou en excès qui ont été insuffisamment filtrées au niveau du glomérule. Les mécanismes sont toujours actifs (transport contre le gradient de concentration) et font appel à des transporteurs spécifiques. La sécrétion tubulaire est aussi impliquée dans la régulation du pH sanguin en modulant la sécrétion des ions H+ et de HCO3-.
Anse de Henle
L’anse de Henle est la section du néphron conduisant du tubule proximal au tubule distal. Elle doit son nom à F. G. J. Henle qui l'a décrite. Elle a un diamètre de 12 micromètres. L'anse remonte vers le cortex, avec un coude à 180°. Cette Anse de Henlé est responsable en grande partie de la concentration des urines, ceci avec l'urée, on a constaté que plus l'Anse est longue et plus la concentration des urines se fait.
Branche descendante
La partie descendante (grêle) est totalement perméable à l'eau et imperméable aux ions.
- Résultat : augmentation de l'osmolarité.
Branche ascendante mince
Cette branche est imperméable à l'eau et perméable au sodium et à tous les autres ions.
- Résultat : diminution de l'osmolarité.
Branche ascendante épaisse médullaire
Cette branche est imperméable à l'eau et perméable au sodium et à tous les autres ions.
- Résultat : diminution de l'osmolarité.
Branche ascendante épaisse corticale
Cette branche est imperméable à l'eau et perméable au sodium.
- Résultat : diminution de l'osmolarité.
Tubule distal
Sa partie contournée est en contact avec l'artériole afférente de son néphron au niveau d'une structure appelée l'appareil juxtaglomérulaire. C'est à ce niveau que se fait la sécrétion de rénine, hormone phare du contrôle de la tension artérielle par le rein.
Le tubule distal participe à l'élaboration de l'urine définitive. Il permet notamment si nécessaire la réabsorption de Na+ qui s'accompagne d'une réabsorption de Cl-, donc globalement une réabsorption supplémentaire de NaCl.
Par ailleurs il y a de toute petite réabsorption d'eau car la perméabilité du tubule distal est encore très faible, autrement dit, l'urine qui quitte le tubule distal est une urine toujours peu concentrée (environ 100 mosmols/L).
Le tubule distal permet en outre une réabsorption régulée de Ca, sous l'effet de deux hormones qui sont l'hormone parathyroïdienne (PTH) et le calcitriol (CT), sous l'influence notamment de la vitamine D.
La PTH augmente la réabsorption régulée de Ca tandis que la CT diminue cette réabsorption.
À la suite du tube contourné distal on trouve le tube collecteur cortical.
Tube collecteur
Le tube collecteur possède une partie corticale et une partie médullaire. De manière générale, 6 nephrons s'abouchent dans un tube collecteur.
Tube collecteur cortical
Sous l'effet d'hormones, il y aura modification de la perméabilité de la membrane plasmique. On a trois hormones qui régulent cette perméabilité.
- l'aldostérone (sécrétée au niveau des corticosurrénales) d'une part, qui permet une augmentation de la réabsorption de Na+, et par conséquent d'eau, ce qui entraîne une augmentation du volume sanguin (volémie) et donc une augmentation de la tension artérielle ;
- l'ANP (sécrétée au niveau de l'oreillette cardiaque), qui inhibe la réabsorption de Na+, donc favorise l'élimination d'eau.
Ceci entraîne une diminution de la volémie et donc de la tension artérielle.
C'est cette urine qui va pénétrer dans le tube collecteur dans sa partie médullaire ; - la vasopressine (ADH:Hormone Antidiurétique) qui va augmenter le transport de l'eau, en induisant la synthèse de canaux (Aquaporine 2).
La concentration de l'urine dépend de l'hormone ADH et de sa conséquence sur l'absorption d'eau.
-Tubules collecteurs sont imperméables à l'eau en l'absence d'ADH et l'urine résultante sera diliuée.
-Tubules collecteurs sont perméables à l'eau en présence d'ADH et l'urine résultante sera concentrée.
Tube collecteur médullaire
Les tubes collecteurs sont localisés dans les pyramides de Ferrein. Chacun d'entre eux reçoit les tubes contournés distaux de 11 néphrons en moyenne. Ils descendent de façon rectiligne dans la médullaire rénale, augmentant progressivement de diamètre. Au niveau de la médullaire interne, ils fusionnent par groupes de huit pour former un canal papillaire.
Canaux de Bellini
Les canaux de Bellini possèdent des canaux sodiques permettant l'excrétion finale des ions sodiques.
Irrigation sanguine du néphron
L'irrigation sanguine passe par plusieurs veines et artères. En y allant dans l'ordre :
- aorte,
- artère rénale,
- artère segmentaire,
- artère interlobaire,
- artère arquée,
- artère interlobulaire,
- artériole afférente,
- artériole glomérulaire,
- capsule glomérulaire,
- artériole efférente,
- capillaires péritubulaires et vasa recta,
- veine interlobulaire,
- veine arquée,
- veine interlobaire,
- veine rénale,
- veine cave inférieure.
Fonction du rein
Hormis sa fonction principale de filtration et d'épuration du sang, le rein intervient à bien des niveaux, notamment dans la régulation de la pression artérielle. Par sa fonction de synthèse de substances spécifiques régulatrices, notamment :
- la rénine synthétisée par le rein et qui va provoquer, via l'angiotensine II (ATII), une stimulation de la sécrétion d'aldostérone, qui est une hormone qui va en cas de baisse de pression artérielle, stimuler la réabsorption de sodium ; or les mouvements d'eau suivent les mouvements de sodium, donc cela va entrainer une réabsorption accrue d'eau qui va faire augmenter la volémie au niveau plasmatique et ainsi faire augmenter la pression dans le sang. Ce n'est qu'un aspect schématique et non exhaustif de la rénine car elle a comme effet également de stimuler la sécrétion de noradrénaline, toujours via l'angiotensine II et ainsi provoquer une vasoconstriction ;
- En cas d'hypertension artérielle (HTA), le rein va synthétiser de la kallikréine pour donner en fin de réaction de la bradykinine (qui est une kinine) qui a des effets vasodilatateurs, donc de réduire la pression au niveau des vaisseaux.
Ceci explique pourquoi l'apport excessif de sel fait augmenter la pression artérielle : les mouvements de sodium dans le rein se font également passivement, donc si on augmente notre apport en sodium (sel), cela entrainera une réabsorption accrue d'eau également provoquant une augmentation de volémie donc de pression car :
PA = DC × Rp
DC = FC × VES
PA = pression artérielle
DC = débit cardiaque
Rp = résistance périphérique
FC = fréquence cardiaque
VES = volume d'éjection systolique (volume éjecté par le ventricule cardiaque gauche à chaque contraction)
On sait que les entrées et sorties en sodium sont équivalentes, la quantité absorbée est éliminée au début mais si l'apport en sel n'est plus ponctuel mais continu, alors une autre limite est fixée et l'élimination se fait moins bien ; ceci augmente avec l'âge.
Statistiques
Chez un adulte, on estime que le plasma sanguin est filtré 60 fois par les reins par jour, soit une capacité de traitement d'environ 180 litres. L'urine primitive subit par les différents segments du tubule rénal des modifications, essentiellement des phénomènes de réabsorption. La diurèse quotidienne normale est de 1 à 1,5 L dépendant des apports hydriques. Plus de 99 % de l'eau et des sels filtrés sont réabsorbés.
Lors du sommeil, le taux d'ADH sécrété par l'hypophyse augmente, ce qui a pour effet d'augmenter la réabsorption d'eau par le rein, donc de diminuer la quantité d'urine excrétée.
Le débit de filtration glomérulaire normal est de 120 mL/min soit 173 litres par jour. Une insuffisance rénale commence à être notée lorsque le débit ou taux de filtration glomérulaire est en dessous de 50 mL/min. Il s'agit d'une insuffisance rénale légère. Les insuffisances rénales modérées et sévères sont notées lorsque les taux atteignent respectivement 30 et 10 mL/min. Lorsqu'on est rendu à 10 mL/min et moins, l'insuffisance rénale terminale nécessite l'aide d'un rein artificiel, soit par la dialyse péritonéale ou bien encore par l'hémodialyse.
Maladies
L'insuffisance rénale chronique (IRC) semble en augmentation dans les pays riches, probablement secondairement à
- l'augmentation des cas de diabète (diabète sucré) ;
- l'augmentation des cas d'hypertension artérielle ;
- des néphropathies vasculaires liées au vieillissement de la population ;
- un régime trop riche en sel conduisant à une hypertension artérielle qui peut être fatale au rein ;
- l'alcoolisme ;
- l'obésité ;
- une exposition excessive à certains toxiques rénaux : plomb, cadmium en particulier ou médicaments tels que phénacétine ou ciclosporine…
Elles peuvent être dues à des anomalies génétiques ou à une malformation survenue lors du développement (polykystose rénale le plus souvent, ou reflux vésico-urétéral chez l'enfant), des infections (fréquemment à la suite d'angines, d'infection urinaire, de tuberculose dans les pays en développement) ou à des intoxications ou séquelles d'intoxications. Certains cancers du rein pourraient être précocement induits par des perturbateurs endocriniens. La défaillance du rein peut apparaître brutalement 10 à 40 ans après le début de l'affection.
Malformation congénitale: l'exposition prénatale à l'alcool peut provoquer une diminution de la quantité de néphrons[4], des reins en fer à cheval[5].
On classe généralement les maladies rénales en :
- maladies glomérulaires (glomérulonéphrites primitives dont la cause initiale n'est pas comprise, ou maladies glomérulaires connues telles que le diabète sucré ou lupus érythémateux, ou couramment dans les pays pauvres les amyloses) ;
- néphropathies interstitielles (infection urinaire à pyélonéphrite, intoxication par des toxiques tels que cadmium ou plomb). Chez la femme, une cystite aggravée est la cause première. Chez l'homme, un cancer ou un grossissement de la prostate freinant l'écoulement de l'urine peut faciliter une infection conduisant à une néphropathie interstitielle ;
- néphropathies vasculaires ; le cas le plus fréquent étant une néphroangiosclérose liée à une hypertension artérielle (près de 10 % de la population dans les pays riches).
Traitements
Rein artificiel ou dialyse
Un rein artificiel (ou générateur de dialyse) est un dispositif médical permettant d'épurer le sang des patients dont les reins ne fonctionnent plus.
Greffe de rein
- La première réalisée en France eut lieu à Paris sur le jeune Marius Renard en 1952, par l'équipe du docteur Louis Michon à l'Hôpital Necker ; les suites néphrologiques ont été assurées par le professeur Jean Hamburger et Gabriel Richet, mais le jeune homme est rapidement décédé. La méthode aujourd'hui[Quand ?] utilisée est la méthode « de Kuss » (1913-2006).
- Il se réalise environ 3 000 greffes de reins par an en France.
Notes et références
- Kamina P. Anatomie clinique (Tome 4) organes urinaires et génitaux, pelvis, coupes du tronc. Éditions Maloine. 2008. (ISBN 978-2-224-03067-4)
- Franck Netter, Atlas d'anatomie humaine, Elsevier Masson, , 624 p. (ISBN 2294741242), p. 323
- (en) Dorne J., Walton K. and Renwick A.G. (2004) « Human variability in the renal elimination of foreign compounds and renal excretion-related uncertainty factors for risk assessment » Food and Chemical Toxicology, 42, 2, 275-298.
- (en) Gray Stephen P, Denton Kate M, Cullen-McEwen Luise, Bertram John F et Moritz Karen M, « Prenatal exposure to alcohol reduces nephron number and raises blood pressure in progeny. », Journal of the American Society of Nephrology : JASN, vol. 21, no 11, , p. 1891-902 (PMID 20829403)
- Philippe Dehaene, La grossesse et l'alcool, Presses universitaires de France, , 127 p. (OCLC 32635508)
Voir aussi
Articles connexes
- Néphrologie, urologie
- Diurétique de l'anse
- Néphron
- Physiologie
- Greffe
- Dialyse, hémodialyse, Dialyse péritonéale, Osmolalité
- Hémofiltration, dialysat
- Néphrite (médecine)
- Lithiase urinaire
- Polykystose rénale

Lien externe
- Portail de l’anatomie
- Portail de la médecine
- Portail de la physiologie