Maladie de Lyme
La maladie de Lyme est une zoonose, maladie infectieuse qui touche l'être humain et de nombreux animaux. Transmise par morsure de tiques dures Ixodes, c'est une maladie bactérienne, due à une borrélie (Borrelia burgdorferi, au sens étroit, prédominante en Amérique du Nord).
| Spécialité | Infectiologie (en) |
|---|---|
| Symptôme | Érythème chronique migrant, fatigue, céphalée, arthralgie, myalgie, Tic, fasciculation, paresthésie, vertige et trouble du rythme cardiaque |
| CIM-10 | A69.2 |
|---|---|
| CIM-9 | 088.81 |
| DiseasesDB | 1531 |
| MedlinePlus | 001319 |
| eMedicine | 330178, 965922 et 786767 |
| eMedicine | med/1346 ped/1331neuro/521emerg/588 |
| MeSH | D008193 |
![]()
À proprement parler, on réserve le terme de borréliose de Lyme à la « maladie de Lyme européenne », due à une plus grande diversité de borrélies (principalement Borrelia garinii, B. afzelii... ou B. burgdorferi au sens large).
De façon courante, maladie de Lyme et borréliose de Lyme sont synonymes, et dues alors à Borrelia burgdorferi au sens large.
Les autres borrélioses sont dites fièvres récurrentes (cosmopolite transmise par poux, et régionales par tiques molles).
La maladie est caractérisée par une grande diversité (génétique, épidémiologique, clinique et diagnostique) car multiviscérale (pouvant affecter divers organes) et multisystémique, pouvant toucher divers systèmes. C'est une maladie en expansion, elle est devenue la plus fréquente de toutes les maladies vectorielles transmises à l'Homme dans l'hémisphère nord.
Dans près de 90 % des cas, elle est traitée efficacement par une antibiothérapie de 2 à 4 semaines. Non traitée, elle peut évoluer sur plusieurs années en passant classiquement par trois stades. En réalité ceux-ci sont plus ou moins différenciés, parfois entrecoupés de périodes de latence. Ils peuvent se chevaucher pour certains symptômes. Après une éventuelle phase dormante, cette maladie peut à terme, de manière aiguë et/ou chronique, se manifester par des formes surtout cutanées, articulaires ou neurologiques.
L'existence et la signification de formes non guéries par le traitement standard, ou l'attribution de pathologies chroniques à la maladie de Lyme, posent le problème de la « maladie chronique de Lyme », une controverse sociétale dite Lyme War aux États-Unis ou Scandale de Lyme en France. Cette forme supposée chronique n'est pas validée par les recherches actuelles.
Histoire

Les borrélioses existent sans doute depuis longtemps : le premier homme connu à avoir été infecté par Borrelia burgdorferi est Ötzi, 4550 ans environ avant le présent[1].
La maladie de Lyme, en tant que telle, tire son nom de la ville de Lyme (Connecticut) où elle a été reconnue pour la première fois aux États-Unis en 1977[2]
En fait, la plupart des manifestations de cette maladie avaient déjà été décrites en Europe à partir de la fin du XIXe siècle, mais de façon éparse[3].
Premières descriptions en Europe
- en 1883, un médecin allemand, Alfred Buchwald, décrit (à Breslau) une anomalie de la peau qui semble être ce qu'on nomme aujourd'hui l'acrodermatite chronique atrophiante, mais Buchwald ne l'a pas reliée à une morsure de tique, et ce symptôme ne sera pas présent à Lyme ;
- en 1909, Arvid Afzelius (dermatologue suédois) avait noté l'apparition d'une autre lésion cutanée en forme d'anneau, suivant parfois une morsure de tique Ixodes, et qu'il appelle érythème migrant. En 1913, Bruce Lipschutz (dermatologue autrichien) l'appelle érythème chronique migrant.
- en 1922, les médecins français Garin et Bujadoux associent cette lésion dermatologique avec une atteinte plus générale de paralysie « plus ou moins grave, parfois mortelle, consécutive à la morsure de tiques » (Ixodes hexagonus). Les deux Français attribuent cette méningo-radiculite (méningite avec polynévrite) à un « virus » qu'il faudrait rechercher non dans le sang mais dans les tissus nerveux.
- en 1934, en Allemagne, l'érythème migrant est décrit en association avec des atteintes articulaires.
- en 1941, l'allemand Alfred Bannwarth (de) associe les atteintes articulaires avec une méningo-radiculite de type lymphocytaire (syndrome de Bannwarth).
- en 1951, les effets bénéfiques de la pénicilline sur ces affections font penser à une origine bactérienne[3].
Redécouverte aux États-Unis
En 1969, le premier cas documenté d'érythème chronique migrant, survenu chez un chasseur en forêt, est publié aux États-Unis[3].
En 1975, deux mères de la ville de Lyme, ayant des enfants diagnostiqués comme victimes d'une forme d'arthrite rhumatoïde juvénile avaient observé que de nombreux autres enfants de la commune présentaient des problèmes similaires. Alertée, une équipe d'épidémiologistes de l'université Yale, dirigée par Allen Steere, met rapidement en évidence une situation atypique :
- la prévalence d'oligoarthrite était dans cette commune cent fois plus élevée que celle de l’arthrite rhumatoïde juvénile aux États-Unis ;
- les nouveaux cas étaient plus nombreux en été, et nettement répartis en foyers géographiques ;
- 25 % des patients présentaient une association avec un érythème chronique ;
Allen Steere (en) nomme alors cette maladie « maladie ou arthrite de Lyme » du nom de la ville[3].
De la tique à la bactérie

En 1977, la morsure de la tique Ixodes dammini (devenu Ixodes scapularis) est rapportée à un cas humain d'érythème chronique migrant.
En 1982, Willy Burgdorfer isole une bactérie spirochète dans le tube digestif de I. scapularis, dite « tique du cerf » en Amérique du Nord. Après inoculation au lapin, il montre que ce spirochète peut provoquer un érythème migrant. Il observe aussi une forte réaction entre le sérum de malades et la bactérie. C'est en son honneur qu'on nommera cette bactérie Borrelia burgdorferi en 1984[4]. À la même période, on détecte des spirochètes en Europe (en Suisse), dans des tiques Ixodes ricinus[5].
La responsabilité de ce spirochète sera confirmée en l'isolant dans le sang, la peau et le liquide cérébrospinal de patients atteints de la maladie de Lyme.
En 1984, le dermatologue allemand Klaus Weber montre une augmentation d'anticorps de type IgG dans le sang de patients présentant une acrodermatite chronique atrophiante, établissant ainsi un premier rapport entre les manifestations précoces et tardives de la maladie[3].
Étiologie
Agents
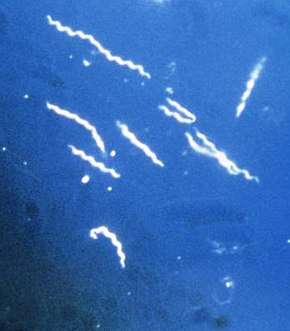
Ce sont toujours des bactéries du genre Borrelia, classées parmi les spirochètes en raison de leur caractère serpentiforme et spiralé[6].
Borrelia burgdorferi sl (sensu lato) désigne un complexe d'une trentaine d'espèces, dont plusieurs sont des pathogènes pour les humains. Les trois principaux étant : B. burgdorferi ss ou st (sensu stricto), B. garinii, B. afzelii.
Quelle que soit l'espèce en cause, l'atteinte initiale peut se manifester par un érythème migrant ; ensuite les évolutions diffèrent. Les associations ne sont pas absolues, mais préférentielles, expliquant en partie la prédominance géographique de certaines formes compliquées de la maladie[7].
En Amérique du Nord, B. burgdorferi ss (sensu stricto) prédomine de façon quasi-exclusive, en provoquant surtout des arthrites de Lyme et des douleurs de type rhumatismales (mais toujours sans acrodermatite).
En Eurasie, B. burgdorferi ss est plus rare, alors que les B. burgdorferi sl (sensus lato) prédominent en ciblant d'autres organes particuliers. Borrelia garinii provoque surtout des atteintes neurologiques ou « neuroborrélioses », alors que Borrelia afzelii provoque surtout des atteintes cutanées, notamment l'acrodermatite chronique atrophiante[7]
Au début du XXIe siècle, les méthodes de génétique moléculaire (typage moléculaire des bactéries) ont permis de détecter d'autres espèces pathogènes pour l'homme : comme B. spielmanii ou B. bavariensis en Eurasie, ou B. bissettii en Eurasie, Amérique, Australie[8].
Vecteurs
Tiques

Les vecteurs sont surtout des tiques du genre Ixodes. Ces vecteurs majeurs ont en commun d'avoir un cycle de transmission à trois hôtes successifs, en forêt ou prairie humide, de 2 à 7 ans selon l'espèce et le climat. En Amérique du Nord, le vecteur principal est Ixodes scapularis [=I. dammini], dans le nord-est et le Midwest. Tous les stades, surtout nymphes et adultes femelles peuvent piquer l'homme. Ixodes pacificus, source de 5 % environ des cas déclarés aux États-Unis, se trouve plutôt dans l'Ouest. Son efficacité pathogène sur l'homme est moindre (seul le stade adulte pique l'homme).
En Eurasie et surtout en Europe, le principal vecteur est Ixodes ricinus. Elle prédomine dans les régions boisées, en piquant l'homme à tous les stades (larves et nymphes au printemps, adultes à la fin de l'été).
En Eurasie tempérée et froide, surtout Asie et presque tout l'ex-URSS, le principal vecteur est Ixodes persulcatus.
Certains arthropodes hématophages tels que les taons, les moustiques... pourraient être des vecteurs potentiels de Lyme. Ce rôle éventuel de vecteur accessoire est en discussion.
Relations tiques-borrélies
La proportion de tiques infectées est très variable, selon le stade de développement, les espèces, les saisons et les régions : moins de 2 % des I. pacificus en Californie, jusqu'à 30 % de tiques contaminées en France, 60 % en Autriche[9], et 100 % à Long Island[10].
La bactérie se développe en deux stades : elle se multiplie d'abord dans l'intestin moyen de la larve, à ce stade, la bactérie est « non-motile », c'est-à-dire incapable de se déplacer par ses propres moyens. Puis, dans une seconde phase, sous l'effet du repas de sang (d'un premier hôte petit rongeur), la bactérie devient motile et capable de pénétrer l'hémocèle de la tique, et de gagner les « glandes salivaires » de la nymphe ou de la tique adulte[11].
De là, elle passe dans la salive et est injectée chez les hôtes suivants (mammifère, oiseau, reptile…). Ceci explique pourquoi c'est généralement via la morsure d'une nymphe de tique, et non par morsure de larve, que la bactérie est transmise aux grands mammifères[12].
De façon exceptionnelle[8], la bactérie peut aussi diffuser vers les ovaires de la tique, ce qui donne lieu à une transmission transovarienne dite « verticale », la tique transmettant directement la bactérie à sa descendance. Ceci explique que, dans ces cas là, une larve de tique peut être infectante, avant même d'avoir effectué un repas sanguin[10].
En 2017, l'INRA a lancé un projet de sciences citoyennes pour une meilleure connaissance des vecteurs de la maladie de Lyme[13], en lien avec le plan national de lutte contre la maladie de Lyme[14]. Une application pour Smartphone permet notamment à chaque citoyen de signaler les morsures de tiques, et ceux-ci sont invités à transmettre les tiques aux laboratoires pour les analyser et ainsi mieux connaître la répartition des espèces de vecteurs et de borrélies.
Réservoirs

Le réservoir des borrelia est constitué par des petits rongeurs, hôtes principaux des tiques au stade de larves ou de nymphes. À ce stade initial, les larves et nymphes se nourrissent d'abord sur une même espèce de petit rongeurs. Au début de l'été, les nymphes infectées contaminent leur hôte, et à la fin de l'été l'hôte infecté contamine les larves. Les larves infectées muent, deviennent nymphes et le cycle recommence l'année suivante[15]. Ce cycle initial est essentiel pour le maintien des borrelia dans la nature.
En poursuivant leur développement (de la nymphe à l'adulte), les tiques contaminées transmettent la bactérie à d'autres hôtes (rongeurs, grands mammifères, oiseaux, parfois reptiles)[16]. À ce stade, les tiques se reproduisent et le cycle recommence. Cette partie du cycle est indispensable pour le maintien des tiques, mais pas pour les borrelia.
Les espèces qui jouent un rôle réel de réservoir peuvent varier selon les pays et régions. En Europe, plus de 300 espèces ont été ainsi identifiées : ce sont majoritairement les petits rongeurs, mais aussi les mammifères de taille moyenne (renard, lièvre...) ou de grande taille comme les cervidés, ou encore les oiseaux. Ces espèces-réservoirs sont celles d'animaux sauvages vivant en zone boisées, broussailles, prairies, humides et tempérées... en contact régulier et permanent avec l'habitat habituel des tiques. Les cycles européens paraissent plus complexes et plus variés qu'en Amérique.
En Amérique du Nord, contrairement à l'Europe, les espèces-réservoirs prédominantes se distinguent plus nettement. Par exemple, dans le nord-est et le Midwest : la souris à pattes blanches et le cerf de Virginie[17]. Les oiseaux migrateurs pourraient jouer un rôle dans l'expansion des tiques au Canada[15].
Des animaux domestiques peuvent aussi être infectés, en particulier les chiens, les moutons, bovins et chevaux[18], lesquels peuvent présenter des atteintes articulaires (chevaux)[19] ou rénales (chiens)[20] contrairement aux espèces sauvages à infections inapparentes.
L'homme qui s'insère dans ce cycle, en s'exposant aux tiques, est en fait un hôte accidentel terminal des tiques[7].
Co-infections
Les tiques pouvant transmettre d'autres agents que les Borrelia, des co-infections sont possibles. En pratique, aux États-Unis, la tique Ixodes scapularis peut transmettre le plus souvent Anaplasma phagocytophilum (agent de l'ehrlichiose humaine), et ensuite Babesia microti (agent de la babésiose), Borrelia miyamotoi et Borrelia mayonii (agents de fièvres récurrentes à tiques)[21].
Le plus souvent, ces agents provoquent des symptômes non spécifiques (maux de tête, douleurs articulaires et musculaires, fatigue...) et une fièvre plus importante que dans la maladie de Lyme, mais pas de troubles chroniques.
En Europe, la tique Ixodes Ricinus peut aussi transmettre Anaplasma phagocytophilum et Babesia microti, et aussi l'encéphalite à tique (due à un virus)[21].
Modalités de contamination
Morsures de tiques

Les humains se contaminent lors d'une rencontre avec les tiques vectrices (contaminées) qui se trouvent en particulier dans les milieux boisés humides avec sous-bois embroussaillés ; du printemps au début de l'automne. Elles sont situées dans le tapis végétal à moins d'un mètre de hauteur.
Elles chassent « à l'affût » en détectant la présence d'un hôte à proximité grâce à des capteurs sensibles au CO2, à la chaleur et substances biochimiques (organe de Haller).
Une fois sur le corps de l'hôte, une tique recherche les zones chaudes et humides comme les plis du corps : chez l'homme, creux du coude ou du genou, aisselle, aine... Elle peut passer sous les vêtements et atteindre la peau où elle se fixe par son rostre pour faire son repas sanguin.
Ce repas sanguin dure de 3 à 5 jours. La transmission se fait au cours du repas, par passage de bactéries du tube digestif de la tique, à ses glandes salivaires. Salive et bactéries sont inoculées dans l'épiderme, et non directement dans un vaisseau sanguin. Cette progression ne débute qu'après la morsure de la tique, il faut plusieurs heures avant qu'elle ne soit contaminante. Aussi une tique retirée assez rapidement ne transmet pas de maladies[8].
Le risque de développer une maladie de Lyme après morsure de tique est de l'ordre de 1 à 5 %[21]. Seul un tiers des patients atteints de maladie de Lyme a eu conscience ou se souvient d'une morsure de tique[22].
Autres
La transmission directe mère-enfant in utero est possible quand la mère est infectée durant la grossesse. La maladie n'a pas d'effet sur le fœtus, si la mère est traitée par antibiothérapie adaptée[23].
Les autres modes de transmission n'ont pas été démontrés : de personne à personne (par toucher, baiser, ou acte sexuel), par air, eau, aliments, allaitement maternel, transfusion sanguine[15],[23]…
Il n'existe pas de risques de contamination directe à partir d'un animal de compagnie infecté.
Le CDC américain recommande aux malades de Lyme ayant une infection active en cours d'antibiothérapie de ne pas donner leur sang, ceux qui ont terminé leur traitement pouvant être donneurs[24]. En France, l'attitude est similaire (report temporaire)[25].
Épidémiologie
Données actuelles
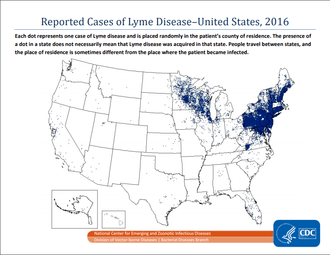
La maladie de Lyme existe sur tous les continents, mais elle prédomine dans les régions tempérées de l'hémisphère nord, en étant la première des maladies vectorielles.
Aux États-Unis, près de 30 000 cas sont signalés chaque année aux CDC, dont 95 % des cas dans 14 États du nord-est et du Midwest, mais des études estiment que le nombre de cas diagnostiqués serait de l'ordre de 300 000, avec la même distribution géographique[26].
En Europe, son incidence augmente selon un gradient sud-nord et ouest-est, généralement entre une latitude de 35° N et 60 ° N, et au-dessous d'une altitude de 1300 m. Elle est estimée à 65 000 cas par an, répartis de façon hétérogène, avec un maximum en Slovénie et en Autriche avec plus de 100 cas pour 100 000 habitants[27].
En Belgique, on compte en moyenne 200 à 300 personnes hospitalisées par an pour une maladie de Lyme, et près de 10 000 consultant un généraliste pour érythème migrant (2000-2016)[28].
En Suisse, le nombre de consultations (nouveaux cas) pour maladie de Lyme est estimé entre 200 et 600 par an (2008-2018)[29].
En France, son incidence est évaluée à 43 cas pour 100 000 habitants, mais avec de grandes différences selon les régions : exceptionnelle sur le pourtour méditerranéen (climat trop sec pour le vecteur[7]), et plus de 100 cas pour 100 000 habitants dans l'Est et le Limousin[8].
Toutes les activités qui exposent à des tiques sont à risques : promenade en forêt, camping, jardinage, travaux agricoles ou forestiers... La maladie est plus fréquente chez les jeunes enfants et les adultes de plus de 45 ans. Le pic de fréquence correspond à l'activité des tiques (début du printemps à la fin de l'automne).
Synthèse épidémiologique
L'épidémiologie de la maladie de Lyme est celle d'une zoonose « à foyers naturels », c'est-à-dire dont la répartition est irrégulière avec des zones endémiques localisées, séparées par des zones indemnes (à l'échelle nationale — différences régionales — comme à l'échelle régionale — différences locales —, etc.).
Cette situation est fluctuante dans le temps et dans l'espace, selon les conditions climatiques et écologiques, le nombre et le déplacement des hôtes (oiseaux, gros mammifères...) accompagnés de leurs tiques.
La progression constatée de la maladie depuis les années 1970 résulte pour l'essentiel d'une réelle augmentation d'incidence et d'une extension des régions atteintes[30], et dans une moindre partie d'une amélioration du dépistage et des moyens de surveillance[27],[10].
Facteurs d'émergence
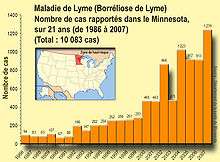
Cette augmentation peut résulter d'une évolution génétique des agents, des vecteurs et des hôtes, en rapport avec les modifications des éco-systèmes.
Le réchauffement climatique[31] entraine des températures minima plus élevées (nocturnes et hivernales) et des printemps plus précoces, ce qui retentit probablement sur la distribution locale des tiques, leur densité de population et leur taux de survie[27],[32].
À ce phénomène global, s'ajoutent les aménagements forestiers et agricoles : le drainage, la fragmentation forestière et des paysages, les coupes rases, le reboisement, etc. Ces activités humaines peuvent entraîner une perturbation de la dynamique des populations faunistiques et des équilibres sylvocynégétiques.
Ces processus réduisent la biodiversité, considérée comme élément stabilisateur[33]. Ils se manifestent par une augmentation de densité des vertébrés domestiques et sauvages (hôtes réservoirs compétents) avec un recul de leurs grands prédateurs.
Amérique du Nord

Par exemple, en Amérique, le cerf de Virginie et la souris à pattes blanches (hôtes principaux pour les tiques vectrices de Lyme) ont connu une augmentation rapide de densité.
Dans le nord-est, du XVIIe siècle au début du XIXe siècle, les colons ont défrichés de vastes étendues de forêts pour leurs activités agricoles avec une quasi-disparition des cervidés et de leurs prédateurs. À la fin du XIXe siècle, la région s'industrialise et l'agriculture décline ; les terres abandonnées se reboisent, habitat favorable pour la multiplication du cerf de Virginie. Au cours du XXe siècle, cette reforestation s'accompagne d'un développement résidentiel péri-urbain en zone boisée. Les conditions sont alors réunies pour une plus grande proximité permanente souris-cerfs-tiques-humains[34].
Europe
En Europe, comme en Amérique du Nord, une présence humaine accrue en forêt ou en lisière de forêt (habitat péri-urbain, activités de chasse ou de loisir...) accroit la possibilité de contact entre la tique, l'homme et ses animaux domestiques (chien, cheval...)[27].
Le contexte de guerre et de guerre civile pourrait aussi favoriser ce type de zoonoses ; ainsi en Serbie, peu après le début des guerres dites Guerres de Yougoslavie, on a constaté une forte augmentation des cas de borrélioses de Lyme[35].
La mondialisation, le commerce et le tourisme internationaux jouent également un rôle, par diffusion géographique d'hôtes et de parasites. Par exemple, en France, un nouvel animal de compagnie, l'écureuil de Corée ou tamia de Sibérie, relâché dans la nature par ses propriétaires, a été suspecté d'être un nouvel hôte réservoir, car il s'est rapidement adapté : une des plus grandes populations de tamias (entre dix et vingt mille individus) se trouve ainsi dans la forêt de Sénart[36].
Physiopathologie
Réactions immunitaires
Après inoculation, il y a peu de réaction inflammatoire immédiate. Les borrélies sont capables de modifier leurs antigènes de surface, Outer surface proteins ou Osp (A-F), et d'échapper aux premières défenses immunitaires. En l'absence de traitement, elles diffusent localement dans la peau à partir du site d'inoculation (érythème migrant).
Puis elles diffusent par voie sanguine vers les tissus articulaires, neurologiques et cardiaques. Chez le sujet immunocompétent, après plusieurs semaines ou mois, les réponses anticorps finissent par contrôler l'infection disséminée, même en l'absence de traitement, et les symptômes s'estompent[15].
Chez les espèces-réservoirs de borrélies, comme la souris, les infections ne sont pas pathogènes malgré la persistance à vie de la bactérie. Ceci suggère que les systèmes immunitaires des hôtes sauvages ont évolué (coévolution) de façon à « ignorer » cette présence qui ne produit ni toxine, ni facteurs agressifs.
Chez les humains, qui ne sont pas des hôtes réservoirs naturels, le système immunitaire est en permanence activé, jusqu'à ce que la bactérie soit éliminée, celle-ci pouvant persister longtemps dans des sites localisés[15]. Cette persistance selon les différentes tissus fait l'objet de discussions. En l'absence de traitement, la bactérie a pu être mise en évidence plusieurs années après l'inoculation, notamment dans les lésions cutanées tardives (acrodermatite chronique atrophiante ou ACA)[8].
Chez l'homme, après une infection, il n'y a pas d'immunité protectrice, même si des anticorps restent présents[8].
Histoire naturelle de la maladie
Classiquement, la maladie évolue en trois phases, non obligatoires. Chaque phase peut être révélatrice ou s'intriquer avec une autre, avec des poussées ou des rémissions à chaque phase. Outre les variations selon les zones géographiques (Amérique et Eurasie), la maladie est aussi variable selon les patients (certains ne présentent que la phase primaire, d'autres la phase tertiaire)[17].
La phase primaire, ou précoce localisée, qui survient 3 à 30 jours après l'inoculation, est une phase cutanée, représentée par l'érythème migrant. Dans 20 à 30 % des cas, elle est absente ou passe inaperçue[37].
La phase secondaire, ou précoce disséminée, se manifeste dans les semaines ou mois après inoculation. Elle peut être révélatrice (apparaître en premier). Selon les cas (germe causal en rapport avec la zone géographique), les troubles peuvent être neurologiques, articulaires, cardiaques, ou cutanés.
Ces deux premières phases sont parfois regroupées en une seule phase dite précoce, surtout en Europe, car les troubles sont divers (plus grande variété de borrélies). La maladie de Lyme se présente comme un ensemble polymorphe (maladies apparemment différentes). Alors qu'en Amérique du Nord, la maladie de Lyme se présente plutôt sous une forme articulaire, unique ou prédominante.
La phase tertiaire se produit des mois ou des années après inoculation. Elle signe une infection persistante ou résurgente, elle peut être aussi révélatrice. Ces formes tardives sont reconnues lorsqu'elles forment des ensembles typiques et cohérents d'un point de vue clinique et biologique. Elles sont discutées ou controversées quand la clinique n'est pas caractéristique et la biologie non validée.
Formes cliniques
L'existence et l'importance de formes asymptomatiques est en discussion. Leur fréquence serait de l'ordre de 5 % de sujets séropositifs en zone d'endémie, et jusqu'à 20 % dans des populations à risques (travailleurs forestiers). Ces cas asymptomatiques indiqueraient un contact ancien avec la bactérie, ou une ancienne infection guérie.
Phase primaire
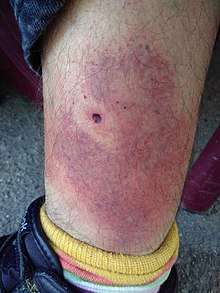
C'est une phase précoce et locale, réalisant l'érythème migrant caractéristique. Elle correspond à une infection initiale cutanée, localisée autour du point de morsure.
Cette lésion apparait de 3 à 30 jours après. Elle siège le plus souvent aux membres inférieurs ou à la partie inférieure du tronc ; plus rarement à la tête (petits enfants)[38].
Il s'agit d'un érythème annulaire avec une bordure active qui s'étend de façon centrifuge, tandis que le centre s'éclaircit avec petite tache rouge centrale (séquelle de la morsure de tique). Le diamètre initial de l'anneau est de quelques cm, puis jusqu'à 15 cm en moyenne, pouvant dépasser les 20 cm (un cas de 70 cm a été publié)[38].
Cet érythème migrant peut présenter quelques différences entre sa forme américaine et européenne.
Forme européenne
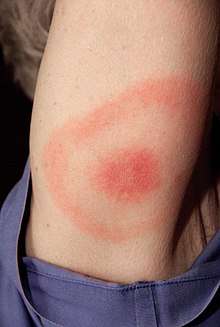
La lésion est unique, légèrement chaude, mais indolore, et sans prurit. En Europe, où la maladie est plus souvent due à B. afzelii ou B. garinii, l'inflammation est à ce stade généralement moins intense qu'en Amérique du Nord, et la croissance (migration) de l'érythème y est souvent plus lente.
Cet érythème migrant est habituellement isolé, sans fièvre, sans syndrome inflammatoire. Plus rarement, il peut exister des signes de dissémination précoce avec fièvre, douleurs, troubles neurologiques.
Forme américaine
Elle est souvent faite de lésions multiples. La partie centrale reste rouge ou foncée et devient plus indurée. Son bord externe reste également rouge, mais plus rarement, la portion de peau située entre le centre et le bord retrouve une couleur normale. Parfois une nécrose centrale, ou une vésicule apparaît à l'emplacement de la morsure, éventuellement avec prurit intense persistant, si la maladie n'a pas été soignée précocement.
Plus souvent qu'en Europe, il peut exister des signes de dissémination précoce avec fièvre, douleurs, troubles neurologiques[39].
Quand les aspects caractéristiques de ces deux formes sont présents, l'érythème migrant est pratiquement pathognomonique, et suffit à lui seul au diagnostic.
Cet érythème migrant disparait spontanément en 4 à 6 semaines. Avec un traitement précoce, l'évolution est plus rapide : la lésion disparait en moins d'une semaine, et la maladie n'évolue pas vers des formes plus compliquée.
Phase secondaire
Elle survient le plus souvent à partir de quelques semaines à quelques mois après l'inoculation, lorsque la lésion initiale est restée absente ou passée inaperçue, ou sans antibiothérapie adaptée.
Ce stade correspond à une dissémination bactérienne, suivie d'une focalisation sur des tissus particuliers.
Les manifestations sont dominées en Europe par des troubles neurologiques (« neuroborréliose ») et en Amérique par des troubles rhumatologiques (« arthrite de Lyme »). Plus rarement se rencontrent des troubles cardiaques, cutanés et oculaires.
Si la phase primaire est absente (phase secondaire révélatrice), le diagnostic peut être confirmé par l'association d'arguments cliniques, épidémiologiques et biologiques (à ce stade, l'infection active est habituellement détectable dans le liquide céphalorachidien et sur les tests sérologiques pertinents, mieux qu'en phase trois).
Neuroborréliose
L'incidence de ces neuroborrélioses (formes neurologiques de la maladie de Lyme) varie selon les pays et les régions. En Europe, on trouve plus de 15 % de neuroborréliose parmi les maladies de Lyme, alors qu'aux États-Unis, cette proportion ne dépasse pas les 8 %.
En Europe, elle varie aussi selon les régions, pour cent mille habitants : Danemark 0,5 cas, Suède 1 cas, Allemagne 3 cas, Alsace 10 cas[40].
Les formes les plus fréquentes (70 à 80 % des neuroborréliose) sont les méningoradiculites (polynévrite avec infection du liquide cérébro-spinal). Elles apparaissent après 3 semaines à plus de 3 mois après la morsure de tique.
Il s'agit d'abord de troubles sensitifs, plus souvent que moteurs, de la zone de l'érythème migrant. Les douleurs sont sévères (brûlure, arrachement), souvent à recrudescence nocturne et provoquant l'insomnie. Ces douleurs n'ont pas toujours un trajet radiculaire strict. Il peut exister une atteinte associée des nerfs crâniens, se manifestant surtout par une paralysie faciale périphérique, bilatérale dans un tiers des cas.
La ponction lombaire permet de confirmer une méningite lymphocytaire. En cas de paralysie faciale périphérique, une sérologie positive est considérée comme suffisante pour confirmer le diagnostic et prescrire une antibiothérapie (grade C).
Les radiculites hyperalgiques résistent aux antalgiques habituels. Elles peuvent disparaître spontanément en quelques semaines ou mois. Elles cèdent plus rapidement en quelques jours avec une antibiothérapie adaptée.
Plus rarement, on peut trouver des méningites aiguës, des myélites aiguës, des encéphalites aiguës dont le caractère rare et isolé rend le diagnostic plus difficile.
Arthrite de Lyme
Les manifestations articulaires ont été à l'origine de la redécouverte de la maladie aux États-Unis, où elles sont plus fréquentes (60 % des malades) qu'en Europe (10 à 15 %)[8]. Elle s'observe à tout âge, mais plus souvent chez l'enfant.
En Europe, elles sont précoces (quelques jours à quelques semaines après l'inoculation) et guérissent spontanément le plus souvent. En Amérique, elles sont plus tardives (6 mois en moyenne jusqu'à 2 ans), pour devenir plus souvent chroniques, réalisant le tableau de l'arthrite de Lyme. En Europe, les troubles articulaires sont classés en phase secondaire, alors qu'en Amérique, ils appartiennent à la phase tertiaire[41].
Dans sa forme la plus typique, l'arthrite de Lyme réalise une atteinte d'une seule grosse articulation (mono- ou oligo-arthrite), avec douleurs et épanchement de liquide synovial, surtout au genou (moins souvent épaule, coude...). Cette atteinte est asymétrique, récidivante (avec poussées et rémissions), parfois permanente, et susceptible de durer plusieurs années en l'absence de traitement[41].
Habituellement, la plupart des patients guérissent par antibiothérapie adaptée, mais d'autres conservent une synovite post-infectieuse, réfractaire aux antibiotiques[41].
Autres manifestations
A l'exception d'une asthénie marquée, les troubles généraux sont rares. En particulier, il n'y a pas en général de fièvre dans une maladie de Lyme.
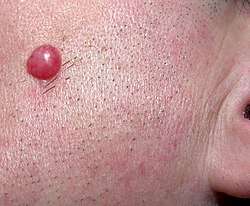
Dans moins de 5 % des cas, il peut exister des troubles cardiaques par bloc atrio-ventriculaire, se manifestant comme des palpitations intermittentes. Ces derniers troubles sont spontanément régressifs. Une péricardite d'évolution prolongée est possible.
Dans la même proportion, on peut trouver une manifestation dite lymphocytome borrélien. C'est un nodule rouge violacé, de 1 à 2 cm, qui siège le plus souvent au niveau de la face, du lobule de l'oreille, de l'aréole mammaire ou du scrotum.
Dans 1 % des cas, il existe des troubles ophtalmologiques divers : conjonctivite, uvéite, kératite, etc[8]...
Phase tertiaire
La limite entre les formes secondaire et tertiaire est difficile à établir. Une forme secondaire se prolonge devenant tertiaire, ou des manifestations tertiaires apparaissent, apparemment primitives, des années après l'infection.
Des phénomènes immunitaires pourraient expliquer ces symptômes, mais la responsabilité directe de la bactérie au cours de ces manifestations tardives reste discuté[42].
Il s'agit de formes chroniques : cutanées, articulaires ou neurologiques. Du point de vue clinique, elles ne sont guère spécifiques (elles peuvent aussi se rencontrer en dehors de la maladie de Lyme), à l'exception de l'acrodermatite chronique atrophiante.
Formes cutanées
L'acrodermatite chronique atrophiante, ou ACA, autrefois aussi nommée « maladie de Pick-Herxheimer », est liée à la maladie de Lyme de manière certaine : le germe a pu être isolé dans les biopsies de la lésion. C'est le symptôme le plus net de cette troisième phase, mais il n'est principalement observé qu'en Europe et pas chez tous les patients.
L'ACA commence avec un changement de couleur et de texture d'une surface de peau, habituellement sur une région exposées au soleil des membres supérieurs ou inférieurs. L'atrophie se traduit par des surfaces de peau qui deviennent très fines et transparentes, prenant une apparence rappelant un papier froissé de cigarette et une couleur rouge à violacée, avec parfois l'apparence de certains lichens plan. L'ACA d'abord localisée peut ensuite s'étendre peu à peu et parfois se bilatéraliser.
Formes rhumatologiques
Il s'agit d'une arthrite de Lyme (voir section phase secondaire) qui persiste et se prolonge en étant réfractaire à l'antibiothérapie.
Formes neurologiques
La « neuroborréliose tardive » regroupe plusieurs entités, dont l'encéphalite (atteinte cérébrale) et les polyneuropathies (atteinte des nerfs).
L'encéphalite ou encéphalomyélite, chronique ou tardive, se manifeste par des troubles variés : troubles cognitifs, difficultés de concentration parfois associés un état de fatigue, douleurs, faiblesse musculaire, troubles moteurs... Le lien avec une maladie de Lyme est reconnu lorsqu'on retrouve une synthèse d'anticorps spécifiques dans le liquide cérébro-spinal.
Une polyneuropathie se manifeste d'abord avec des pics de douleurs, parfois accompagnés d'engourdissements et picotements dans les mains ou les pieds. Elle est classiquement associée à l'acrodermatite atrophiante. Il peut s'agir aussi de douleurs radiculaires chroniques isolées se manifestant comme une sciatique
Formes discutées ou controversées
Elles sont mal connues et difficiles à rattacher formellement à une borréliose[42].
Des manifestations dermatologiques (autres que le lymphocytome et l'acrodermatite) ont été décrites : morphée, sclérodermie, dermatomyosite..., mais le lien avec une maladie de Lyme reste hypothétique et discuté.
Certains patients, après un traitement bien conduit, présentent des troubles subjectifs chroniques (céphalées, fatigue, et douleurs articulaires) alors que la clinique et la biologie objectives sont en faveur de la guérison. On parle alors de « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease Syndrom[43].
À partir de là, et selon une continuité confuse, le terme de « maladie chronique de Lyme » est apparu. Non ou mal défini, il regroupe tout un ensemble de pathologies chroniques diverses, rapportées à une maladie de Lyme. Il s'agit de revendications, apparues aux États-Unis dans les années 1990, et portées tout autant par des patients soignés et traités, mais non guéris, que par des patients ni diagnostiqués, ni traités auparavant pour maladie de Lyme. Ce mouvement associatif entend défendre ce diagnostic et bénéficier de thérapies alternatives[44],[45].
Diagnostic
Diagnostic positif
L'examen clinique reste l'élément de base de la démarche diagnostique d'une maladie de Lyme, On recherche la notion de morsure de tique et d'érythème migrant, l'origine géographique et les activités du malade en évaluant le caractère plus ou moins caractéristique des lésions. Les différents examens s'organisent et s'interprètent en fonction de ces données cliniques[46].
Sérologie
Il existe des difficultés de diagnostic sérologiques en Europe du fait de la diversité des espèces pathogènes impliquées, comme celle des réactifs ; d'où l'absence d'une standardisation. Alors qu'aux États-Unis, la sérologie est plus facile à interpréter (critères standards du CDC), du fait de la présence d'une espèce pathogène très prédominante (B. Burdorgferi au sens strict)[47],[48]
Lors de la phase primaire, le diagnostic est exclusivement clinique pour l'érythème migrant. À ce stade, la sérologie est inutile, la production d'anticorps étant encore insuffisante. De même les données biologiques, toujours à ce stade, sont habituellement normales. La présence d'un syndrome inflammatoire important doit faire évoquer un autre diagnostic[42].
Lors de la phase secondaire, les examens sérologiques (dosages d'anticorps) se discutent en fonction du contexte. Il existe deux méthodes couramment utilisées en pratique : ELISA et Western Blot. Le test ELISA est utilisé en première intention, s'il est positif ou douteux, il doit être confirmé par Western-Blot.
Cette sérologie se pratique dans le sang (lymphocytome, atteinte cardiaque, arthrite…), dans le liquide articulaire (arthrite) ou dans le liquide cérébro-spinal (neuroborréliose).
Une sérologie positive n'a de valeur pathologique que dans un contexte clinique évocateur. Inversement, une sérologie négative dans le même contexte incite à répéter ou poursuivre l'investigation.
PCR
La PCR vise à détecter la présence du génome d'une borrelia. C'est un examen optionnel, en deuxième intention, dans des cas douteux (contexte clinique et épidémiologique évocateur, mais sérologie négative). Il se fait sur des localisations particulières (prélèvement cutané, liquide cérébro-spinal, liquide articulaire) selon le contexte.
La PCR est très spécifique, mais reste imprécise pour démontrer une infection active, car l'ADN des borrélies peut persister après leur mort (élimination sous antibiotiques). Aussi aux États-Unis comme en Europe, la sérologie reste, en pratique courante, la seule méthode immédiatement disponible pour le diagnostic[49].
Diagnostic différentiel
À la phase primaire, lorsqu'il est atypique, l'érythème migrant peut être confondu avec un eczéma nummulaire, un érythème polymorphe, une dermatophytose, etc. et, dans le sud-est des États-Unis à un STARI (acronyme de Southern tick-associated rash illness)[50].
Lorsque l'érythème migrant est absent ou passé inaperçu, de nombreux diagnostics peuvent être évoqués à la phase secondaire : neurologiques (encéphalite ou myélite virale, Guillain-Barré, paralysie faciale a frigore, sclérose en plaques...), rhumatologiques (polyarthrite rhumatoïde, arthrite réactionnelle, arthrite juvénile...).
À la phase tardive, l'acrodermite chronique peut être confondue avec des troubles liés à une insuffisance veineuse, ou à des sclérodermies localisées. Les troubles généraux font discuter d'une fibromyalgie ou d'une fatigue chronique.
La différence peut être faite par la sérologie, et par le fait que les symptômes s'améliorent sous antibiothérapie.
La situation la plus complexe se présente lorsque un patient est étiqueté « malade chronique de Lyme » ou CLD Chronic Lyme Disease. Cette entité n'est pas reconnue par la communauté scientifique à cause d'une absence de définition de ces patients, et de l'incapacité de déterminer la présence de germes actifs persistant après traitement standard.
Diagnostic de Lyme chronique
Aux États-Unis, ces diagnostics seraient effectués dans le cadre d'une « contre-culture » rassemblant des associations, des laboratoires de tests diagnostiques non validés, et des médecins auto-proclamés spécialistes de l'affection ou « Lyme literate medical doctors » (LLMD), ayant des activités de lobbying auprès du Congrès américain et sur Internet[51].
Ces diagnostics de « maladie chronique de Lyme » se répartissent en quatre catégories[44] :
La catégorie 1 est un diagnostic basé uniquement sur des symptômes non spécifiques (fatigue, douleurs chroniques, troubles cognitifs ou de l'humeur...) sans trouble biologique décelable. Ces troubles non spécifiques sont présents dans au moins 10 % de la population générale, sans rapport avec une répartition endémique de la maladie de Lyme.
La catégorie 2 sont les patients ayant une autre maladie (qu'ils aient déjà ou pas, une histoire de maladie de Lyme non démontrée). Par exemple, des patients ont du mal à accepter le diagnostic de sclérose en plaques, et trouvent un médecin disposé à les traiter pour une maladie chronique de Lyme.
La catégorie 3 n'a pas de troubles cliniques objectifs évoquant une maladie de Lyme, mais ils présentent des anticorps contre B. burgdoferi. Des médecins proposent un essai empirique d'antibiothérapie pour traiter leurs symptômes.
La catégorie 4 sont les patients (diagnostiqués et traités Lyme) ayant des manifestations chroniques réalisant un « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease Syndrom. Il s'agit de troubles subjectifs pouvant persister un an et plus après le traitement. Ces patients posent le problème plus général des états de fatigue et de douleurs chroniques[52].
Traitement
Antibiothérapie
Principes de base
L'objectif du traitement antibiotique est de guérir les manifestations cliniques et d'éviter l'évolution vers des formes secondaires et tertiaires, ce qui s'obtient par l'éradication complète des Borrelia. On ne cherche pas à obtenir une sérologie négative[53].
En pratique, on utilise une cycline, et en deuxième intention ou dans des cas particulier, une β-lactamine (céphalosporine).
En phase primaire (érythème migrant), l'amoxicilline ou la doxycycline doivent être prescrits durant 14 à 21 jours, au plus tôt : dans les 72 heures si possible pour un meilleur résultat.
En phase secondaire et tertiaire, pour les neuroborrélioses, les céphalosporines sont principalement utilisées, habituellement la ceftriaxone, pour une durée de 21 à 28 jours, au moins ; par voie veineuse périphérique en cas de méningo-encéphalite.
Pour les formes tertiaires, des durées plus longues peuvent être proposées selon les cas[42].
Chez environ 15 % des patients, l'antibiothérapie peut provoquer une réaction de Jarisch-Herxheimer, liée à la lyse des bactéries, avec exacerbation des symptômes. Il s'agit d'une réaction transitoire sans gravité, qui disparait en quelques heures[54], ou un à deux jours[50].
Efficacité
Les infections traitées en phase primaire sont guéries par les antibiotiques recommandés. Si la phase primaire passe inaperçue, ou insuffisamment traitée, la maladie continue d'évoluer.
Environ 10 % des patients traités, et peut être plus chez ceux ayant une neuroborréliose, continuent d'avoir des troubles subjectifs (fatigue, douleurs musculaires, troubles cognitifs...). Ces troubles persistent plus de 6 mois après antibiothérapie préconisée, et jusqu'à plus de 10 ans, au moins de façon intermittente[55].
Même si la plupart des patients s'améliorent au fil des mois, cet état affecte durablement la qualité de vie. C'est le « syndrome post-borréliose de Lyme », ou PLDS Post-Lyme Disease Syndrom. Dans cette situation, les études contrôlées ne montrent pas de différence entre une antibiothérapie prolongée et un placebo[45],[52].
Autres approches
Plus ou moins reconnues
Si l'antibiothérapie prolongée n'est pas une solution pour ces états chroniques, de nouvelles stratégies de prise en charge doivent être mises en œuvre ; en sachant que près de 40 % des patients chroniques de « post-borréliose de Lyme » sont améliorés par un placebo[44]. Le malade « post-Lyme » rejoint alors les millions de personnes qui, dans le monde, souffrent de fatigue et douleurs chroniques d'origine indéterminée[52].
Ainsi, les troubles dépressifs sont à traiter selon les normes habituelles, et les douleurs persistantes selon une approche multidisciplinaire analogue à celle du traitement de la fibromyalgie. Il existe donc des combinaisons de médicaments (antalgiques, d'antidépresseurs...), de thérapies comportementales, kinésithérapie et acupuncture[56].
Des techniques d'origine neurochirurgicales, dites de neuromodulation par stimulation spinale, ont été développées pour traiter des syndromes complexes de douleurs chroniques ou des douleurs post-opératoires. Elles semblent pouvoir diminuer la douleur de patients atteints d'arthrite de Lyme chronique et résistante aux traitements classiques (médicaments, kinésithérapie)[57],[58].
Non reconnues ou non recommandées
De nombreux traitements alternatifs sont proposés sur le net[59]. Sans preuve d'efficacité, certains présentent un risque certain d'effet indésirable[60],[61].
- Antibiothérapie non préconisée, par exemple de très longue durée ; intermittente ; répétée (pour un même épisode de Lyme) ; pour des co-infections sans preuve.
- Médecine hyperbare.
- Thérapies « à radiation ou à énergie »
- Thérapies « nutritionnelles ».
- Chélation de métaux lourds.
- Pyrothérapie.
- Médicaments divers : immunoglobulines, hormones, venin d'abeille...
Des préparations phytothérapeutiques[62],[63],[64],[65] sont proposées ou distribuées par divers laboratoires.
En France, l'une d'elles, le Tic Tox, est un mélange d'huiles essentielles et de propolis mis au point par Bernard Christophe (1949-2016), un pharmacien alsacien spécialisé en phyto-aromathérapie. Ce produit a été suspendu en 2012, en attendant sa mise en conformité avec la réglementation, par l'Agence nationale de sécurité du médicament et des produits de santé (AFSSAPS), arguant notamment de sa contenance en sauge officinale (potentiellement toxique selon les doses ingérées) et d'un terpène, la thuyone[66], outre une « absence d'autorisation de mise sur le marché[66],[67] » (AMM).
Toutefois, selon les dires du professeur Christian Perronne, spécialiste de la maladie de Lyme, ainsi que selon les déclarations de la société fabricant la préparation mise en cause, ce retrait serait discutable[68],[69]. Le produit est ainsi légalement disponible à l'étranger, notamment dans plusieurs officines allemandes.
Prévention
Éviter l'exposition aux tiques
La prévention primaire (agir directement sur la cause : hôtes et vecteurs) est difficile, à cause de la diversité du réservoir animal. Agir sur l'un des facteurs d'émergence (voir section épidémiologie) est toujours discuté, car si l'on cerne à peu près ces facteurs, la façon dont ils réagissent entre eux est mal connue. Par exemple, aux États-Unis où la diversité des réservoirs est moins grande, la réduction de la population des cerfs de Virginie, comme moyen de réduire la maladie humaine, fait débat[70].
Les mesures recommandées sont l'évitement d'une exposition aux tiques.
Forêts

- Porter en forêt des habits couvrants (chaussures fermées, pantalon long enfilé dans chaussettes, chemise à col fermé et manches longues boutonnées aux poignets ; port de guêtres pour travailleurs forestiers et cueilleurs de champignons). Proscrire les tongs et sandalettes, les shorts et les tee-shirts ;
- Éviter les zones à très haut risque (taillis, sous-bois... surtout humides) en restant autant que possible au milieu des chemins ; limiter la manipulation du gibier pour les chasseurs ;
- L'utilisation de répulsifs en zone à risque est possible, mais l'imprégnation vestimentaire par des insecticides est moins utilisée (nuisances et effets secondaires).
- S'inspecter attentivement après les promenades ou le travail en forêt ; en particulier les aisselles, le nombril, les organes génitaux, les plis du genou, et chez les enfants la tête et le cuir chevelu.
Jardins
Une étude de sciences participatives lancée l’été 2017 en France par l'Inra, basée sur une application (« Signalement Tiques ») permettant de cartographier les lieux où ont eu lieu les morsures de tiques vient de montrer que - contre toute attente- si 53% des cas concernent la forêt, 1/3 (27% exactement) des morsures déclarées volontairement ont eu lieu dans des jardins de maisons privés, et « seulement 10 % dans des prairies ». Les déclarants sont invités à photographier la tique et à l’envoyer par courrier aux chercheurs (54 envois par jour en moyenne en mai 2018) Un biais probable joue en la faveur des déclarations sur l’humain et le public des répondants n'est sans doute pas représentatifs de toute la population. Pour 1254 signalements de piqûres sur les animaux, 4198 l’ont été chez l’Homme. Les piqures concernent d’abord des personnes de 20 à 40 ans (30% des cas), et de 40 à 60 ans (26%). Ce taux chute à 17 % chez les 5-20 ans. Suivent les personnes de plus de 60 ans (15% des cas), et les enfants de moins de 5 ans (12% des cas). Pour les animaux, les déclarations concernent surtout les chiens (45% des cas) et chats (44%) et moindrement les chevaux et le bétail (6 et 5% des cas)[71].
Parmi les mesures parfois préconisées :
- Entretenir ses jardins, notamment faucher les hautes herbes dans les zones fréquentées et détruire ou faire enlever les feuilles mortes[72] ;
- L'abondance des tiques pourrait être réduite dans certaines zones (parcs et jardins péri-forestiers…) par une zone-tampon dépourvue de litière de feuilles mortes (par exemple garnie de mulch ou de gravier entre la lisière forestière et les zones de jeu d'enfant, de pique nique, etc.) et par des mesures interdisant l'intrusion d'animaux tels que sangliers ou cervidés[73],[74]), toute en favorisant les prédateurs naturels des tiques ;
Animaux domestiques
- Munir les animaux de compagnie de collier anti-tiques et les inspecter régulièrement, surtout en retour de balade en forêt et les débarrasser des tiques. Les chiens peuvent être éventuellement vaporisés par des insecticides adaptés[75] ;
- Les chats sont extrêmement sensibles aux produits chimiques. Il ne faut pas appliquer d'insecticide ou de répulsifs aux chats sans avis vétérinaire[75] ;
- Un modèle prédictif de risque a été créé pour les chiens en combinant des facteurs climatiques, géographiques et sociétaux, avec des résultats de tests sérologiques. Ce modèle pourrait être utile pour aider les vétérinaires à évaluer le risque pour les chiens, et peut-être indirectement l'homme[76].
Ces précautions ne sont pas toujours suffisantes, car les nymphes de tique sont à la limite de la visibilité (1 à 2 mm) et leur morsure est indolore.
Soins en cas de morsure de tique
La contamination nécessite un temps long de présence de la tique sur la peau. Si le risque débute dès la première heure, il est proportionnel au temps de contact, avec un maximum entre 48 et 72 heures (le repas sanguin de la tique durant de 2 à 5 jours).
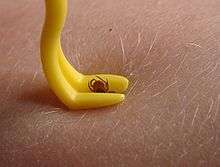
Si la tique est retirée de la peau dans les 36 premières heures après qu'elle s'y est fixée, les risques de contamination sont réputés faibles ; inférieurs à 1 %, car les borrelia ne sont à ce moment pas encore dans les glandes salivaires de la tique mais dans son tube digestif. Pour infecter l'hôte, elles doivent encore migrer du tube digestif aux glandes salivaires, ce qui peut demander 2 à 3 jours, cette durée pouvant être raccourcie en Europe.
Retrait de la tique
Les méthodes folkloriques, qui utilisent une goutte de divers produits visant à endormir, étouffer, ou détacher la tique sont trop lents ou font risquer une régurgitation de la tique : éther, benzine, essence, gazoil, huile de table, vernis à ongle, chaleur par cigarette allumée... Il ne s'agit pas d'attendre, la tique doit donc être retirée le plus rapidement possible, sans la manipuler[77],[78].
Divers modèles de pinces spéciales ou de sortes de petits pieds de biche qui permettent d'extraire les tiques en les tournant doucement sont vendus en pharmacie (avec un modèle plus petit pour les larves et nymphes). Il ne faut pas tirer, mais tourner doucement comme pour dévisser[79], on peut extraire sans peine la tique, au moins si elle n'est pas ancrée depuis trop longtemps. Ce geste évite le risque de laisser le rostre ou la tête et son cément fichés dans la peau, ce qui peut provoquer une infection, voire un abcès.
À défaut de tire-tique, on peut utiliser une pince fine à épiler, pour tirer la tique sans la tordre ou l'écraser[77],[78].
Traitement de la plaie
Après le retrait de la tique (et non avant, pas de produit sur une tique attachée), la plaie doit être soigneusement désinfectée et surveillée. À ce stade, l'antibiothérapie prophylactique n'est pas recommandée pour une morsure simple de tique, en raison de la faible probabilité de contamination. Celle-ci peut se discuter dans certains cas particuliers (femme enceinte, personne immunodéprimée...) ou encore, en zone hyperendémique, lorsque la tique est retirée tard et gorgée de sang[42].
Il en est de même aux États-Unis où, après morsure de tique, l'antibiothérapie prophylactique n'est pas généralement recommandée par les CDC. Les exceptions concernent les zones hyperendémiques où toute personne mordue de plus de 8 ans peut recevoir une dose unique de 200 mg de doxycycline dans les 72 h après le retrait de la tique. Pour cela, toutes les conditions suivantes doivent être réunies : pas de contre-indication à la doxycycline, tique I. scapularis identifiée, tique gorgée de sang avec un temps estimé supérieur à 36 h d'attachement[80].
Après morsure de tique, une surveillance de la plaie est nécessaire et suffisante. Dans les jours ou semaines qui suivent, il est impératif de consulter un médecin pour antibiothérapie adaptée, si une tache apparait et grandit progressivement (érythème migrant). Il en est de même en cas d'apparition d'un état fébrile ou grippal (plus souvent en Amérique qu'en Europe).
Vaccin
Chez l'homme, il n'existe pas, en 2018, de vaccin disponible contre la maladie de Lyme. Des vaccins vétérinaires existent, notamment pour le chien, soit basés sur la bactérie entière tuée, soit sur des sous-unités (protéines de surface OspA ou OspC)[81].
Premier vaccin
Un vaccin, le Lymarix de Smith-Kline-Beecham, a été commercialisé aux États-Unis de décembre 1998 à février 2002. Ce vaccin ciblait une des protéines de surface les plus communes de B. Burgorferi, Osp A. Il a été recommandé pour les personnes à risques en zone d'endémie, et 1 à 4 millions de doses ont été distribuées. Les études ont montré que son efficacité était de l'ordre de 70 à 80 % sans effets secondaire significatif, mais que son effet protecteur était de courte durée, nécessitant des rappels annuels.
En 1999, des rumeurs associent le vaccin à des arthrites auto-immunes, et conduisent à des poursuites judiciaires, une action collective est ainsi menée par 121 plaignants. Les études effectuées par le CDC et la FDA ne confirment pas de relations de causalité, en estimant que les avantages du vaccin l'emportent sur les risques. Le vaccin reste donc à disposition du public, mais les ventes s'effondrent par la couverture médiatique des procès en cours, et des polémiques sur le risque théorique d'auto-immunité.
En 2002, le fabricant retire de lui-même son vaccin du marché, pour des raisons économiques. En 2003, un agrément est conclu avec les plaignants : ils cessent toute poursuite judiciaire en échange d'un million de $ servant à rembourser les frais d'avocats et de justice[82].
Recherches en cours
Les recherches vaccinales cherchent à cibler les protéines de surface les plus constantes de la bactérie[81],[83]. Un vaccin de ce type pour l'Europe et les États-Unis est en préparation[84]
La vaccination orale d'un réservoir animal comme la souris Peromyscus leucopus est envisagée en Amérique du Nord, sur le modèle de la vaccination orale des renards contre la rage. D'autres recherches ciblent le vecteur, comme des composants de la salive de tique. Ce qui, théoriquement, aurait l'avantage théorique de protéger contre l'ensemble des maladies transmises par les tiques[81].
Selon Stanley Plotkin, le vaccin idéal contre la maladie de Lyme doit avoir au moins 80 % d'efficacité sur deux ans, des deux côtés de l'Atlantique, être bien toléré, ne pas comporter de déterminant antigénique à risque théorique, et être utilisable chez l'enfant. Pour éviter les fautes de communication commises lors de l'affaire du Lymarix, la production d'un nouveau vaccin devrait se faire à la suite d'une demande concertée des acteurs de santé publique, afin de démontrer qu'il existe un besoin et un marché pour un tel vaccin[84].
Controverse sociétale
Il s'agit de thèses et arguments développés par un courant alternatif, opposé aux recommandations officielles des sociétés savantes qui, elles, font consensus à leur niveau international, et qui sont reprises par l'ensemble des autorités sanitaires en Amérique du Nord comme en Europe.
Ce courant alternatif est apparu aux États-Unis, dans les années 1990, où des médecins se sont rassemblés dans une International Lyme and Associated Diseases Society (ILADS), appuyée par des associations de malades. Ce courant soutient que les recommandations officielles sont trop restrictives, que la maladie est sous-diagnostiquée et sous-traitée. Il cherche donc à promouvoir de nouvelles attitudes thérapeutiques auprès des pouvoirs publics, notamment par la reconnaissance d'une « maladie chronique de Lyme », et d'une antibiothérapie de très longue durée, parfois associée à des thérapies non-conventionnelles.
Hypothèses non validées
Le terme de « Lyme chronique » peut désigner, soit les complications chroniques reconnues et attribuées à la maladie de Lyme, soit les formes chroniques contestées (non attribuées par la communauté scientifique), soit les deux, ce qui prête à confusion.
Pour l'ILADS, la maladie est vue comme ubiquitaire, répandue partout, sous des formes ou des transmissions méconnues (par exemple sexuelle). Le Lyme chronique n'a pas de définition sinon des symptômes persistants (fatigue, douleurs, troubles du sommeil, cognitifs et neurologiques) à traiter par antibiothérapie prolongée.
Le caractère chronique, d'abord silencieux, puis résistant aux antibiotiques, s'expliquerait par des formes « kystiques » ou des forme-L de la bactérie survivant sous la forme d'un biofilm[85]. Mais il s'agit là de variants morphologiques dont le rôle clinique n'a pas été démontré[86]. De même, le concept de « crypto-infections » est avancé, par co-infections de morsure de tique (la tique pouvant transmettre plusieurs maladies), mais ici les co-infections sont très larges comprenant des bactéries non connues pour être transmissibles par tiques, voire des pathogènes fantaisistes[45].
La maladie s'exprimerait le plus souvent par des symptômes subjectifs, mais elle serait alors diagnostiquée par divers tests, tels que des tests urinaires, un comptage de lymphocytes CD 57, immunofluorescence pour mettre en évidence des formes L de Borrelia, etc. mis au point par des « laboratoires spécialisés de Lyme », et qui sont autant de tests non cliniquement validés, et non agréés par la FDA.
L'argumentation s'appuie aussi sur des expériences animales (chiens, poneys…) indiquant que des borrélies peuvent persister malgré un traitement antibiotique approprié. Mais cette présence est fréquente chez l'animal infecté, sans qu'il présente de maladies.
Ces arguments d'ordre scientifique s'accompagnent d'appels aux pouvoirs publics et de poursuites judiciaires contre les sociétés médicales savantes, accusées d'avoir des liens cachés avec les sociétés d'assurances pour limiter la durée, donc le remboursement de l'antibiothérapie[87]. Dans le Connecticut, une enquête sans précédent a eu lieu sur l'IDSA (Infectious Diseases Society of America), société savante accusée de violer la loi antitrust, au motif que ses recommandations étaient les seules à être reprises par les autorités sanitaires[44].
Un compromis temporaire est apparemment trouvé avec la publication, en 2011 (révisée en 2014), des recommandations de l'ILADS sur un site officiel[88], mais il s'agit en fait d'un site qui ne fait que recenser des recommandations sans les valider. Les recommandations officielles américaines restent donc celles publiées sur les sites du CDC ou du NIH.
Pour la communauté scientifique, il s'agirait d'attitudes reposant sur des présomptions, ou des convictions subjectives, et non sur des éléments scientifiques validés[46]. Le courant du « Lyme chronique » serait un ensemble de microbiologie, immunologie, et pharmacologie « alternatives »[51], se diffusant sur internet et autres médias, mêlées à des témoignages de patients. Ce courant représenterait 2 % des médecins dans le Connecticut, l'une des régions où l'endémie de Lyme est la plus forte[45].
Selon Lantos « Des controverses, comme celle de la maladie chronique de Lyme, sont appelées à persister aussi longtemps que des patients continueront à souffrir de symptômes inexpliqués, affectant leur qualité de vie »[45].
Situation française
La définition, les limites et la valeur des moyens diagnostiques de la « maladie chronique de Lyme » restent discutés. Cette question est devenue un problème sociétal, par les polémiques qu'elle provoque. En France, elle entraînerait une double perte de confiance « pour les patients qui perdent confiance en leur médecin, pour les médecins qui perdent confiance en eux-mêmes » dans un climat de méfiance réciproque[89].
Associations de patients
Les principales associations sont Lyme sans frontières fondée en 2012, 700 adhérents en France et en Belgique en 2013, dont 90 % de malades ; et France Lyme créée en 2008, 400 adhérents. Il existe d'autres associations plus petites à vocation locale. La majorité des dirigeants sont des femmes, appartenant à la catégorie des cadres et professions intellectuelles supérieures[90].
Selon la HAS (Haute Autorité de Santé), ces associations sont plus proches, du fait qu'elles « demeurent le plus souvent crispées sur leur ressentiment à l'encontre du corps médical et des experts », de l'attitude des anti-vaccin que celle des associations de lutte contre le VIH[91].
Il existerait un « face-à-face acrimonieux » entre la légitimité des associations et l'autorité de la science. Les premiers défendent leur savoir par expérience personnelle et intime, la seconde se fonde sur l'observation, et la déduction scientifique (médecine basée sur des faits). Le fait d'être victime équivaudrait à un monopole de vérité, puisque prétendument libre de tout conflit d'intérêt[92].
Débats en cours
Jusqu'en juin 2018, la prise en charge se basait sur une conférence de consensus de 2006[93], établissant des protocoles officiels.
En février 2015, l'opposition dépose un projet de loi sur la lutte contre cette maladie qui est rejeté, suivi de plusieurs questions sur la reconnaissance de la maladie de Lyme.
En juin 2016, Matthias Lacoste effectue une grève de la faim pour alerter les autorités de santé et demander le « droit de guérir »[94]. En juillet 2016, plus de cent médecins français dont Christian Perronne (chef du service en infectiologie à l'hôpital de Garches) et des associations de patients (France Lyme, Lyme sans frontières, Lymp'act... regroupées dans la Fédération française contre les maladies vectorielles à tiques) se plaignent d'une situation qui ne tient pas compte de leur expérience et de leur vécu[95],[96],[97].
Les critiques portent sur la fiabilité des tests et la sous-estimation du nombre des cas chroniques, qui entrainent un manque de reconnaissance officielle, ainsi que sur les modalités de traitement. Ils estiment que « le test sérologique n’est pas fiable, et que la maladie dans sa forme chronique n’est pas guérie après 3 semaines d’antibiothérapie »[98],[99].
Ces critiques sont rejetées par la société de pathologie infectieuse de langue française, qui considère que les recommandations de 2006 restent suffisamment valables au regard des connaissances validées actuelles[100]. Elle est suivie en cela par l'Académie de Médecine[101].
Un plan national de lutte contre la maladie de Lyme est présenté par Marisol Touraine, alors Ministre des affaires sociales et de la santé, en septembre 2016[102].
Selon la Haute Autorité de santé (HAS), « Au même titre que les autres acteurs, les associations doivent pouvoir librement s'exprimer. Elles doivent aussi être écoutées. S'il ne leur revient pas de dire la science ou de conduire les politiques, il leur revient par contre de faire entendre la voix des patients »[103].
Pour sauver le dialogue et la confiance nécessaire, la HAS fait de la borréliose de Lyme, non seulement un fait bio-médical, mais aussi un fait social. Elle propose une écoute plus ouverte des récits et discours des patients par le biais de recherches en sciences sociales[104].
Le 20 juin 2018, la HAS publie de nouvelles recommandations de prise en charge de la borréliose de Lyme. Elles confirment, en les précisant, les protocoles de diagnostic et de traitement déjà adoptés. En revanche, à l'instar de la situation américaine distinguant un « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease, la HAS distingue « la/le symptomatologie/syndrome persistant(e) polymorphe après possible piqûre de tique » ou SPPT[105].
Il s'agit d'une dénomination de compromis, en l'absence de consensus, mais qui facilite la prise en charge adaptée des patients[105]. Le 2 juillet 2018, l'Académie de médecine « exprime clairement sa profonde déception » devant ce texte[106]. De même, le 19 juillet 2018, l'ensemble de sociétés savantes et professionnelles refusent de cautionner cette dénomination de SPPT et d'en suivre les recommandations[107].
Personnalités atteintes
Notes et références
- DVD La mystérieuse histoire d'Ötzi. La momie des glaces, éd. National Geographic, coll. Les grandes énigmes de notre histoire, 2008
- site du Figaro-Santé, article "Pourquoi il faut faire attention à la maladie de Lyme", publié le 21 juillet 2017
- (en) Robert D. Leff, Lyme Borreliosis, Cambridge University Press, (ISBN 0-521-33286-9), p. 852-854dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- (en) Johnson RC, F. W. Hyde, G. P. Schmid et D. J. Brenner « Borrelia burgdorferi sp. nov.: etiological agent of Lyme disease » Int J Syst Bacteriol. 1984;34:496-497.
- Barbour, A. G., W. Burgdorfer, S. F. Hayes, O. Péter et A. Aeschlimann. « Isolation of a cultivable spirochete from Ixodes ricinus ticks of Switzerland » Current Microbiology 1983;8:123- 126.
- (en) Ryan KJ, Ray CG ; Sherris Medical Microbiology ; 4e édition (page 434-437) Ed: McGraw Hill ;2004 ; (ISBN 978-0-8385-8542-9)
- Sylvie De Martino, « La borréliose de Lyme », La Revue du Praticien, vol. 55, , p. 471-477.
- E. Pilly, Maladies infectieuses et tropicales, Alinea Plus, (ISBN 978-2-916641-66-9), p. 377-378.
- Evison J, Aebi C, Francioli P, Péter O, Bassetti S, Gervaix A, Zimmerli S, Weber R, « Diagnostic et traitement de la borréliose de Lyme chez l’adulte et l’enfant : recommandations de la Société suisse d’infectiologie : Borréliose de Lyme 1re partie : épidémiologie et diagnostic [Lyme disease Part I: epidemiology and diagnosis] », Rev Med Suisse, vol. 2, no 60, , p. 919-24. (PMID 16673723, lire en ligne [html])
- F. Rodhain, « Maladie de Lyme : épidémiologie », La Revue du Praticien, vol. 39, no 15, , p. 1291-1293.
- (en) S.M. Dunham-Ems, M.J. Caimano, U. Pal, C.W. Wolgemuth, C.H. Eggers, A. Balic et J.D. Radolf, « Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks », J Clin Invest, vol. 119, no 12, , p. 3652–3665 (DOI 10.1172/JCI39401, lire en ligne)
- (en) Tilly K, Rosa PA, Stewart PE. « Biology of infection with Borrelia burgdorferi » Infect Dis Clin North Am. 2008;22:217-234.
- INRA, « Réservoir de recherches, vecteur de solutions : rôle clé de l'Inra sur les maladies à tiques », sur www.inra.fr, (consulté le 17 décembre 2017)
- « Marisol Touraine lance le Plan national de lutte contre la maladie de Lyme et les maladies transmises par les tiques », Ministère des Solidarités et de la Santé, (lire en ligne)
- Allen C. Steere, Franc Strle, Gary P. Wormser et Linden T. Hu, « Lyme borreliosis », Nature reviews. Disease primers, vol. 2, , p. 3. (ISSN 2056-676X, PMID 27976670, PMCID PMC5539539, DOI 10.1038/nrdp.2016.90, lire en ligne)
- (en) Dennis DT, Piesman, JF. « Overview of tick-borne infections in humans » In: Goodman JL, Dennis DT, Sonenshine DE, eds. Tick-borne infections of humans. Washington, DC: ASM Press, 2005.
- (en) Allen C. Steere, « The emergence of Lyme Disease », J Clin Invest, vol. 113, no 8, , p. 1093-1101 (lire en ligne)
- Trap D (1996) Aspects cliniques, épidémiologiques, diagnostiques et moyens de lutte dans la maladie de Lyme chez les animaux domestiques. Bull. des GTV., 2 , 55-59
- Lamouraux, Cécile (2005), La borréliose de Lyme chez le cheval, thèse de doctorat vétérinaire soutenue à la faculté de médecine de Créteil ; École nationale vétérinaire d'Alfort
- Meryl P. Littman, Richard E. Goldstein, Mary A. Labato et Michael R. Lappin, « ACVIM Small Animal Consensus Statement on Lyme Disease in Dogs: Diagnosis, Treatment, and Prevention », Journal of Veterinary Internal Medicine, vol. 20, no 2, , p. 422–434 (ISSN 0891-6640 et 1939-1676, DOI 10.1111/j.1939-1676.2006.tb02880.x, lire en ligne)
- Steere 2016, op. cit., p. 13 (en format pdf).
- M. Alcalay, « La maladie de Lyme », La Revue du Praticien, vol. 44, no 12, , p. 1611-1618.
- (en-US) « Lyme disease transmission », sur www.cdc.gov (consulté le 30 avril 2018)
- (en-US) « Lyme Disease Frequently Asked Questions (FAQ) | Lyme Disease | CDC », sur www.cdc.gov (consulté le 14 août 2017)
- « Maladie de Lyme et don de sang | Etablissement francais du sang », sur dondesang.efs.sante.fr (consulté le 30 avril 2018)
- (en-US) « How many people get Lyme disease? | Lyme Disease | CDC », sur www.cdc.gov (consulté le 28 avril 2018)
- (en) A Rizzoli, H C Hauffe, G Carpi et G I Vourc’h, « Lyme borreliosis in Europe », Eurosurveillance, vol. 16, no 27, (ISSN 1560-7917, DOI 10.2807/ese.16.27.19906-en, lire en ligne)
- (en-US) « LYME », sur epidemio.wiv-isp.be (consulté le 29 avril 2018)
- Office fédéral de la santé publique OFSP, « Maladies transmises par les tiques – Situation en Suisse », sur www.bag.admin.ch (consulté le 29 avril 2018)
- Ogden NH, Lindsay LR, Morshed M, Sockett PN, Artsob H. (2009) The emergence of Lyme disease in Canada. CMAJ ;180:1221-4
- Jacques Exbalin, Le réchauffement climatique et ses impacts, t. II : Le cas de la France, Paris, éditions L'Harmattan, , 296 p., avec les témoignages de Jean Jouzel, Nicolas Hulot, Yann Arthus-Bertrand, Yves Cochet et Brice Lalonde (ISBN 2336349515 et 9782336349510, OCLC 887816626, notice BnF no FRBNF43832179, lire en ligne), p. 230
- Stone, B. L., Tourand, Y., & Brissette, C. A. (2017). Brave New Worlds: The Expanding Universe of Lyme Disease. Vector-Borne and Zoonotic Diseases | résumé.
- Tougeron K, Perez G, Gillard M, Seimandi-Corda G, Balbi M, et al..(2015) La biodiversité sur ordonnance? Les effets de la perte de biodiversité sur la santé, l’exemple de la maladie de Lyme au Québec. Prix de la vulgarisation scientifique de l’Université de Montréal, Canada. <hal-01162524>
- (en) Joshua Lederberg, Emerging infections, National Academy Press, (ISBN 0-309-04741-2), p. 27-28
- (en) Z. Popović, S. Popović. « Forest Transition and Zoonoses Risk » Encyclopedia of Environmental Health Pages 803–811 (Résumé)
- Jean-Louis Chapuis, « Borréliose de Lyme : introduction d'un nouvel hôte, le tamia de Sibérie », Bulletin épidémiologique hebdomadaire, , p. 6-8
- Sylvie de Martino, « Borréliose européenne et maladie de Lyme », Le Concours Médical, vol. 126, no 33, , p. 1919-1924
- (en) Carrie D. Tibbles, « Does this patient have Erythema Migrans ? », Journal of the American Medical Association, vol. 297, no 23, , p. 2617-2626
- Speere 2016, op. cit., p. 9-10.
- Frédéric Blanc, « Neuroborréliose : quand y penser ? », La Revue du Praticien - médecine générale, vol. 21, nos 782-783, , p. 843-846.
- Steere 2016, op. cit., p. 10-11.
- Pilly 2017, op. cit., p.379-380.
- (en) Johannes Nemeth, « Update of the Swiss guidelines on post-treatment Lyme disease syndrome », Suisse Medical Weekly, (lire en ligne)
- (en) Feder HM, Johnson BJ, O'Connell S. et al. « A critical appraisal of "chronic Lyme disease" » N Engl J Med. 2007;357(14):1422-30. DOI:10.1056/NEJMra072023.
- Paul M. Lantos, « Chronic Lyme Disease », Infectious disease clinics of North America, vol. 29, no 2, , p. 325–340 (ISSN 0891-5520, PMID 25999227, PMCID PMC4477530, DOI 10.1016/j.idc.2015.02.006, lire en ligne)
- François Bricaire, « Maladie de Lyme », La Revue du Praticien - médecine générale, vol. 29, no 934, , p. 55-57
- HAS 2012, p. 26.
- Steere 2016, op. cit., p. 12 et 32.
- Steere 2016, op. cit., p. 11-12.
- (en) Eugene D. Shapiro, « Lyme Disease », The New England Journal of Medicine, vol. 370, no 18, , p. 1724-1731.
- Paul G Auwaerter, Johan S Bakken, Raymond J Dattwyler et J Stephen Dumler, « Antiscience and ethical concerns associated with advocacy of Lyme disease », The Lancet. Infectious diseases, vol. 11, no 9, , p. 713–719 (ISSN 1473-3099, PMID 21867956, PMCID PMC4489928, DOI 10.1016/S1473-3099(11)70034-2, lire en ligne)
- (en) Michael T. Melia, « Time for a Different Approach to Lyme Disease and Long-Term Symptoms », The New England Journal of Medicine, vol. 374, no 13, , p. 1277-1278.
- « conférence de consensus 2006 borréliose de Lyme », sur infectiologie.com (consulté le 4 mai 2018)
- Thomas Butler, « The Jarisch–Herxheimer Reaction After Antibiotic Treatment of Spirochetal Infections: A Review of Recent Cases and Our Understanding of Pathogenesis », The American Journal of Tropical Medicine and Hygiene, vol. 96, no 1, , p. 46–52 (ISSN 0002-9637, PMID 28077740, PMCID PMC5239707, DOI 10.4269/ajtmh.16-0434, lire en ligne)
- Steere 2016, op. cit., p. 16.
- Steere 2016, op. cit., p. 17.
- Simpson EL, Duenas A, Holmes MW, Papaioannou D, Chilcott « Spinal cord stimulation for chronic pain of neuropathic or ischaemic origin: systematic review and economic evaluation » ; J. Health Technol Assess. 2009 Mar; 13(17):iii, ix-x, 1-154. (résumé)
- Shui Y, Tao W, Huang D, Li Y, Fan B. « Spinal cord stimulation for chronic pain originating from lyme disease » ; Pain Physician. 2012 Nov;15(6):511-4. (résumé)
- Paul M. Lantos, Eugene D. Shapiro, Paul G. Auwaerter et Phillip J. Baker, « Unorthodox Alternative Therapies Marketed to Treat Lyme Disease », Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, vol. 60, no 12, , p. 1776–1782 (ISSN 1058-4838, PMID 25852124, PMCID PMC4490322, DOI 10.1093/cid/civ186, lire en ligne)
- Steere 2016, op. cit., p. 17 et 33.
- (en-US) Natalie S. Marzec, Christina Nelson, Paul Ravi Waldron et Brian G. Blackburn, « Serious Bacterial Infections Acquired During Treatment of Patients Given a Diagnosis of Chronic Lyme Disease — United States », MMWR. Morbidity and Mortality Weekly Report, vol. 66, no 23, , p. 607–609 (ISSN 0149-2195 et 1545-861X, DOI 10.15585/mmwr.mm6623a3, lire en ligne)
- (en) Matthew Wood, The book of Herbal Wisdom, North Atlantic Books, Berkeley, California, 1997, (ISBN 978-1-55643-232-3).
- Wolf-Dieter Storl (trad. Christophe Bernard), Guérir naturellement la maladie de Lyme : traitement holistique et utilisations pratiques, Guy Trédaniel, (1re éd. 2011 en allemand c/o Weltbild sous le titre « Borreliose natürlich heilen: ganzheitliche Behandlung und praktische Anwendungen » puis 2012 en néerlandais sous le titre « De ziekte van lyme »), 274 p. (ISBN 2813206180 et 9782813206183, notice BnF no FRBNF43668365, présentation en ligne)
- (de) Petra Gutmann, « Borreliose: Natürliche Therapie », A. Vogel newsletter, Teufen « 9. Heilpflanzen, die helfen », (lire en ligne [Zecken, Borreliose, FSME: Informationen über Begriffe und Behandlung von Lyme Borreliose und FSME]) Cf. cardère sauvage (dipsacus silvestris), griffe du chat (uncaria tomentosa).
- (en) Brorson O, Brorson SH, « Grapefruit seed extract is a powerful in vitro agent against motile and cystic forms of Borrelia burgdorferi sensu lato », Infection, vol. 35, no 3, , p. 206-8. (PMID 17565468) [lire en ligne] : cliquer sur l'onglet Look inside pour prendre connaissance des deux premières pages du texte.
- Guilhem Denis, « Tiques : le remède Tic Tox interdit », Europe 1, (lire en ligne) « La vente d'un produit, présenté comme remède préventif ou curatif des morsures de tiques (maladie de Lyme, borrélioses...) par la société Nutrivital, vient d'être interdite par l'Agence des produits de santé (Afssaps). L'Afssaps constate que ce produit fait l'objet de promotion vantant ses effets thérapeutiques alors qu'il n'a pas d'autorisation de mise sur le marché (AMM) au titre de médicament et qu'il présente en outre des risques de neurotoxicité, même pris sur une courte durée par voie orale. »
- Décision de l'Afssaps[PDF], 2012.
- Pryska Ducoeurjoly, « Dossier : l´interdiction du Tic Tox intervient dans un contexte polémique », Ouvertures : le temps du citoyen « Maladie de Lyme », (lire en ligne) Interview du professeur Christian Perronne, spécialiste de la maladie de Lyme, chef du département des maladies infectieuses à l´hôpital Raymond-Poincaré de Garches (92), président de la Commission spécialisée des maladies transmissibles du Haut Conseil de la santé publique (HCSP).
- article du Docteur Bernard Christophe au sujet du « TIC-TOX ».
- K. J. Kugeler, R. A. Jordan, T. L. Schulze et K. S. Griffith, « Will Culling White-Tailed Deer Prevent Lyme Disease? », Zoonoses and public health, vol. 63, no 5, , p. 337–345 (ISSN 1863-1959, PMID 26684932, PMCID PMC4912954, DOI 10.1111/zph.12245, lire en ligne)
- Attention aux tiques : les jardins lieux à risques, News de TWC France ;
- (en-US) « Preventing Tick Bites on People | Lyme Disease | CDC », sur www.cdc.gov (consulté le 5 mai 2018)
- (en)Piesman J, Eisen L. Prevention of tick-borne diseases. Annu Rev Entomol 2008;53:323--43.
- (en)Ginsberg HS, Butler M, Zhioua E. Effect of deer exclusion by fencing on abundance of Amblyomma americanum (Acari: Ixodidae) on Fire Island, New York, États-Unis, J Vector Ecol 2002;27:215--21.13,14).
- (en-US) « Preventing Ticks on Your Pets | Lyme Disease | CDC », sur www.cdc.gov, (consulté le 5 mai 2018)
- Watson SC, Liu Y, Lund RB, Gettings JR, Nordone SK, McMahan CS, et al. (2017) A Bayesian spatio-temporal model for forecasting the prevalence of antibodies to Borrelia burgdorferi, causative agent of Lyme disease, in domestic dogs within the contiguous United States. PLoS ONE 12(5): e0174428. https://doi.org/10.1371/journal.pone.0174428
- Gétaz L, Loutan L, Mezger N, « Maladies transmises par des tiques d’ici et d’ailleurs [Diseases transmitted by ticks locally and abroad] », Rev Med Suisse, vol. 8, no 340, , p. 974-6. (PMID 22662624, lire en ligne [html])
- (en-US) « Tick removal and testing | Lyme Disease | CDC », sur www.cdc.gov, (consulté le 5 mai 2018)
- L'instruction de tourner doucement dans le sens INVERSE des aiguilles d'une montre figure bien en toutes lettres sur une boîte contenant deux « tire-tique », produit, vendu en pharmacie, des laboratoires Clément-Thékan à Montrouge (France). En fait, il faut choisir un sens de rotation et tourner l'instrument dans ce sens, deux ou trois tours ou plus s'il le faut, sans changer de sens pendant l'opération, pour que la tique se détache. Le sens inverse des aiguilles d'une montre (comme pour dévisser) serait plus pratique pour les droitiers, et l'autre (comme pour visser) pour les gauchers : questions fréquentes sur les pinces à extraire les tiques.
- (en) « Prophylaxie morsure de tique (p. 20) », sur cdc.gov (consulté le 5 mai 2018)
- Monica E. Embers et Sukanya Narasimhan, « Vaccination against Lyme disease: past, present, and future », Frontiers in Cellular and Infection Microbiology, vol. 3, (ISSN 2235-2988, PMID 23407755, PMCID PMC3569838, DOI 10.3389/fcimb.2013.00006, lire en ligne)
- L. E. NIGROVIC et K. M. THOMPSON, « The Lyme vaccine: a cautionary tale », Epidemiology and Infection, vol. 135, no 1, , p. 1–8 (ISSN 0950-2688, PMID 16893489, PMCID PMC2870557, DOI 10.1017/S0950268806007096, lire en ligne)
- (en) Hanner M., Schüler W., Meinke A., Lundberg U., Plos One Design and development of a novel vaccine for protection against Lyme borreliosis, PLoS ONE 9(11): e113294. Doi:10.1371/journal.pone.0113294.
- (en) Stanley A Plotkin, « Need for a New Lyme Disease Vaccine », The New England Journal of Medicine, vol. 375, no 10, , p. 911-913
- "Lyme Santé Vérité"
- Paul M. Lantos, Paul G. Auwaerter et Gary P. Wormser, « A Systematic Review of Borrelia burgdorferi Morphologic Variants Does Not Support a Role in Chronic Lyme Disease », Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, vol. 58, no 5, , p. 663–671 (ISSN 1058-4838, PMID 24336823, PMCID PMC3922218, DOI 10.1093/cid/cit810, lire en ligne)
- (en) « Past Lyme Disease Advocacy Events ».
- (en) « Evidence assessments and guideline recommendations in Lyme disease: the clinical management of known tick bites, erythema migrans rashes and persistent disease. | National Guideline Clearinghouse », sur www.guideline.gov (consulté le 8 février 2017)
- Y. Hansmann, « La maladie de Lyme chronique existe-t-elle ? », La Revue du Praticien, vol. 66, , p. 711-714.
- HAS 2014, p. 41-42
- HAS 2014, p. 44.
- HAS 2014, p. 46.
- « consensus 2006 »
- « Maladie de Lyme : Matthias, en grève de la faim, réclame "le droit de guérir" », L'Obs, (lire en ligne)
- « MALADIE DE LYME. Le cri d'alarme de 100 médecins : "Il y a urgence" », L'Obs, (lire en ligne)
- « Maladie de Lyme : le long combat du professeur Perronne », leparisien.fr, (lire en ligne)
- « Maladie de Lyme : « J'ai dû faire passer mon dossier pour celui d'un animal » », leparisien.fr, (lire en ligne)
- http://francais.medscape.com/voirarticle/3602193
- « Maladie de Lyme: Pourquoi la France est à ce point en retard », Le Huffington Post, (lire en ligne)
- « Maladie de Lyme: position de la SPILF - Maladie de lyme: position de », sur www.infectiologie.com (consulté le 8 février 2017)
- « conclusions maladie de Lyme », sur academie-medecine.fr (consulté le 7 mai 2018)
- « synthèse du plan 2016 »
- HAS 2014, p. 39.
- HAS 2014, p. 47.
- « Haute Autorité de Santé - Borréliose de Lyme et autres maladies vectorielles à tiques », sur www.has-sante.fr (consulté le 5 juillet 2018)
- « Communiqué de presse du 2 juillet 2018 : "Mise au point de la Haute Autorité de Santé (HAS) à propos de la maladie de Lyme : Réactions et déception de l'Académie nationale de médecine" - Académie nationale de médecine | Une institution dans son temps », Académie nationale de médecine | Une institution dans son temps, (lire en ligne)
- « Communiqué de presse de l'ensemble des sociétés savantes impliquées dans la prise en charge des maladies transmises par les tiques », 19 juillet 2018.
- RTL Newmedia, « Shania Twain, atteinte de la maladie de Lyme, s'est retrouvée sans voix: "J 'ai vraiment pensé que c'était la fin de ma carrière" », RTL People, (lire en ligne)
- (en) Steve Ginsburg, « Lyme disease never far from thoughts of WNBA star Delle Donne », Yahoo !, (consulté le 15 septembre 2015)
- (en) http://www.dailymail.co.uk/tvshowbiz/article-3265978/Bella-Anwar-Hadid-battling-Lyme-disease-mom-Yolanda-Foster-reveals.html
- « 8 stars victimes de la maladie de Lyme », sur Medicite.fr, (consulté le 5 juillet 2018)
- « Maladie de Lyme : les stars touchées par la maladie », sur Doctissimo.fr (consulté le 5 juillet 2018)
Voir aussi
Articles connexes
- Éco-épidémiologie
- Maladie émergente
- Borrélioses
- Maladies vectorielles à tiques
Bibliographie
- « HAS. Borreliose de Lyme », (consulté le 11 mai 2018)
- Roger Lenglet et Chantal Perrin, L'affaire de la maladie de Lyme, Actes Sud, , 160 p. (ISBN 978-2-330-05800-5, présentation en ligne).
- Judith Alberta, Maladie de Lyme : Mon parcours pour retrouver la santé, Thierry Souccar, , 224 p. (ISBN 978-2-365-49001-6).
- Christian Perronne (Pr), La Vérité sur la maladie de Lyme, Odile Jacob, , 304 p. (ISBN 978-2-738-13509-4, présentation en ligne).
Filmographie
- La Maladie de Lyme. Quand les tiques attaquent !. Documentaire français diffusé sur France 5 en 2014. Réalisé en 2014, 52'. Page web (description).
Liens externes
- Enquête nationale sur la cartographie des morsures pour la France
- « Maladie de Lyme », sur Ministère des Affaires sociales et de la santé (France), (consulté le 26 janvier 2017)
- Jean-Paul Krivine, « La maladie de Lyme : entre psychose et fausses informations », SPS n°321, sur www.pseudo-sciences.org, AFIS, (consulté le 15 août 2017)
- Aurélie Haroche, « Maladies de "non Lyme" : les souffrances ignorées de notre société », sur Journal International de Médecine, (consulté le 6 avril 2018)
- Portail de la médecine