Helicobacter pylori
Helicobacter pylori est une bactérie qui infecte la muqueuse gastrique. Sa structure externe est hélicoïdale (d'où son nom « Helicobacter »). Elle est munie de flagelles.

| Règne | Bacteria |
|---|---|
| Division | Proteobacteria |
| Classe | Epsilon Proteobacteria |
| Ordre | Campylobacterales |
| Famille | Helicobacteraceae |
| Genre | Helicobacter |
Nom binominal
(Marshall et al., 1985) Goodwin et al., 1989
80 % des ulcères gastro-duodénaux sont causés par des infections de Helicobacter pylori[1], même si, chez beaucoup d'humains infectés, la maladie reste asymptomatique. Elle favorise de multiples maladies si elle reste dans l'estomac trop d'années.
Helicobacter pylori est une bactérie très commune (trouvée chez 50 % des humains). Elle vit exclusivement dans l'estomac humain et est la seule bactérie connue pouvant survivre dans un environnement aussi acide. Son enveloppe hélicoïdale pourrait l'aider à se visser dans le mucus de la paroi stomacale afin de la coloniser et d'y persister.
Cette bactérie est à l'origine notamment des ulcères gastro-duodénaux ou de gastrite chronique atrophique.
Histoire

En 1875, des scientifiques allemands découvrirent une bactérie hélicoïdale dans des estomacs humains. Celle-ci ne pouvant être cultivée, les recherches la concernant furent finalement abandonnées.
Une découverte accidentelle
Cette bactérie fut redécouverte accidentellement en 1982 par deux chercheurs australiens, J. Robin Warren (pathologiste) et Barry J. Marshall (gastroentérologue), qui isolaient et cultivaient des organismes à partir d'estomacs humains. Dans leur publication originelle, Warren et Marshall soutinrent que la plupart des ulcères stomacaux et gastriques étaient causés par une infection de cette bactérie, et non par le stress ou la nourriture épicée, comme on le pensait auparavant. Cette découverte leur valut le prix Nobel de physiologie et de médecine 2005.
La communauté médicale mit du temps avant de reconnaître le rôle de cette bactérie dans les ulcères gastriques, pensant qu'aucune bactérie ne pouvait survivre bien longtemps dans l'environnement acide de l'estomac. Après que des études complémentaires eurent été réalisées, dont celle durant laquelle Marshall ingurgita un tube à essai de H. pylori, contracta une gastrite (il n'eut pas la patience d'attendre le développement d'un ulcère) et se soigna avec des antibiotiques (satisfaisant de ce fait trois des quatre postulats de Robert Koch), la communauté médicale commença à changer d'avis[réf. nécessaire]. En 1994, les National Institutes of Health publièrent un texte soutenant que la plupart des ulcères gastriques récurrents étaient causés par H. pylori, et recommandaient que des antibiotiques soient inclus dans le traitement.
Avant que soit reconnu le rôle de cette bactérie, les ulcères stomacaux étaient habituellement soignés par des médicaments qui neutralisaient l'acidité stomacale, ou diminuaient sa production. Bien que cette technique donnât de bons résultats, les ulcères réapparaissaient très souvent. Un médicament classiquement utilisé était le subsalicylate de bismuth. Il fonctionnait assez bien, mais fut finalement abandonné, son mécanisme d'action étant inconnu et le bismuth étant un métal toxique. Il semble maintenant plausible que le sel de bismuth fonctionne comme un toxique tuant les bactéries (antibiotique)[réf. nécessaire]. La plupart des ulcères sont maintenant efficacement traités par des antibiotiques ciblant H. pylori.
Cette bactérie fut initialement appelée Campylobacter pyloridis, puis C. pylori (après correction grammaticale latine). Finalement, après que le séquençage de son ADN eut montré que la bactérie n'appartenait pas au genre Campylobacter, elle fut placée dans un nouveau genre : Helicobacter. Le nom pylori tire son origine du latin « pylorus », qui signifie « gardien de l'ouverture », et qui fait référence à l'ouverture circulaire (pylore) menant de l'estomac au duodénum.
Alors que H. pylori reste la seule espèce connue capable de coloniser l'estomac humain, d'autres espèces de Helicobacter ont été identifiées chez d'autres mammifères, ainsi que chez certains oiseaux.
Une autre équipe de chercheurs a montré qu'Helicobacter pylori était déjà présente dans l'estomac d'environ la moitié des Homo sapiens il y a 58 000 ans dans la souche africaine, avant les grandes migrations des êtres humains vers l'Asie et l'Europe. Ces chercheurs ont en effet observé que la diversité génétique de H. pylori diminue lorsque l'on s'éloigne de l'Afrique de l'est, de la même façon que dans la lignée humaine, et que la bactérie semble avoir migré en dehors de l'Afrique vers -58 000[2].
Structure de la bactérie

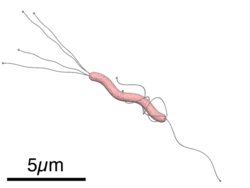
H. pylori est une bactérie Gram négatif de forme hélicoïdale, d'environ trois micromètres de long et d'environ 0,5 micromètres de diamètre. Elle porte quatre à six flagelles[3]. Elle est dite microaérophile, c'est-à-dire qu'elle nécessite un apport d'oxygène, mais dans des proportions inférieures à celles trouvées dans l'atmosphère. Enfin, signalons encore qu'elle peut produire son énergie par méthanogenèse à partir d'hydrogène.
Grâce à sa forme hélicoïdale et à ses flagelles, la bactérie se glisse à travers le mucus et parfois les muqueuses de l'estomac en s'ancrant aux cellules épithéliales grâce à des adhésines (protéines fixatrices). Elle sécrète alors une enzyme appelée « uréase » qui transforme l'urée en ammoniac et en dioxyde de carbone. Cet ammoniac va partiellement neutraliser l'acidité gastrique (qui sert à prédigérer les aliments, tout en tuant la plupart des bactéries). Malheureusement, l'ammoniac est toxique pour les cellules épithéliales, et va, de concert avec d'autres produits sécrétés par H. pylori (protéases, catalases, phospholipases, etc.) endommager la surface des cellules épithéliales, enclenchant de ce fait le processus de formation d'ulcères.
Des études récentes montrent que certaines souches de cette bactérie possèderaient un mécanisme particulier d'injection d'agents inflammatoires dans les cellules stomacales. Pour s'accrocher sur la paroi stomacale, elles perturbent aussi le cycle naturel du fer dans l'épithélium[4].
Génétique
Le génome de H. pylori est séquencé depuis 1997. La position et le nombre des gènes régulateurs, qui régulent la synthèse des produits d'autres gènes, restent mal connus. Une soixantaine de petites molécules d'ARN dites « small RNAs » (sRNAs) jouent également un rôle régulateur-inhibiteur, en se fixant à des séquences de gènes, ce qui a pour effet de bloquer la traduction des protéines codées par ces gènes. Elles ont été identifiées en 2009/2010[5], par séquençage à haut débit. Ceci a surpris les chercheurs car on pensait antérieurement que H pylori était dépourvue de sRNAs. Or, H pylori présente autant voire plus de sRNAs que des bactéries intestinales telles qu'Escherichia coli et les salmonelles. Cependant, une protéine réputée indispensable à la régulation des sRNAs est absente chez H pylori, ce qui laisse penser qu'elle dispose de systèmes de signaux internes aujourd'hui inconnus.
Des nouveaux vaccins contre H pylori pourraient éventuellement être développés sur ces bases.
Épidémiologie
Environ deux tiers de la population mondiale est infectée par cette bactérie. Le taux d'infection varie d'un pays à l'autre : environ 25 % dans les pays occidentaux avec d'importantes disparités. Le taux est plus élevé dans les pays du Tiers-Monde. Dans ces derniers, il est courant de rencontrer des enfants infectés, probablement à cause des mauvaises conditions sanitaires. Aux États-Unis, par contre, les personnes atteintes sont essentiellement des personnes âgées (plus de 50 % de personnes contaminées au-delà de 60 ans, contre environ 20 % chez les moins de 40 ans), ainsi que les personnes les plus démunies.
Une mutation sur le gène TLR1 codant un récepteur de type Toll pourrait être un facteur favorisant l'infection[6].
Le taux d'infection est essentiellement fonction des conditions d'hygiène, ainsi que du degré d'utilisation des antibiotiques. Néanmoins, des résistances contre certains antibiotiques sont apparues chez certaines souches de H. pylori. Par exemple, on peut trouver en Grande-Bretagne certaines souches résistantes au métronidazole.
Infection
Transmission
Cette bactérie a été isolée dans des selles, de la salive et sur des plaques dentaires, ce qui laisse supposer qu'une transmission est possible par ingestion d'aliments ou d'eau contaminés par les selles ou par voie gastro-orale.
Si elle n'est pas soignée par une prise d'antibiotiques, il semblerait qu'une infection par H. pylori puisse persister durant toute la vie d'un individu. Le système immunitaire humain ne serait donc pas capable d'éradiquer cette bactérie, en raison des mécanismes dont elle dispose pour déjouer les défenses immunitaires. L'infection peut alors conduire à plusieurs maladies graves : reflux gastro-œsophagien, ulcère gastro-duodénal ou duodénal ou gastrique, ou encore cancer de l'œsophage et cancer de l'estomac.
Symptômes

L'infection peut être symptomatique ou asymptomatique (c'est-à-dire avec ou sans effets visibles).
Divers symptômes sont associés à H. pylori, mais plutôt vagues et pouvant varier dans le temps. Ils sont non-spécifiques ou induits par une autre pathologie associée.
On estime que 70 % à 80 % des infections sont asymptomatiques[7].
L'inflammation ou des dommages plus profonds à la paroi stomacale (gastrite) due à H. pylori peuvent causer des réactions légères ou graves, avec :
- douleurs stomacales ou abdominales ;
- reflux acide ;
- régurgitation ;
- vomissements ;
- éructations ;
- flatulences ;
- nausées.
- Pâleur[réf. nécessaire].
- Dépression .
- Courbatures à répétitions[réf. nécessaire].
- Somnolence[réf. nécessaire].
- Constipation[réf. nécessaire].
- Rosacé[réf. nécessaire].
Diagnostic
Il est possible de détecter la présence de H. pylori par différentes méthodes :
- le dosage d'anticorps spécifiques, le test sérologique étant fiable pour détecter une infection mais ne l'étant pas pour vérifier le succès d'un traitement anti-helicobacter car les anticorps subsistent plusieurs mois après une éventuelle éradication). Il existe des kits de dépistage sérologique permettant un dépistage quasi immédiat, de fiabilité moindre toutefois qu'une sérologie traditionnelle[8].
- par ingestion d'urée marquée au carbone 13 (si le patient est infecté, cette urée est métabolisée par H. pylori, produisant ainsi du CO2 marqué, qui est ensuite expulsé hors du corps via les poumons, et peut donc être détecté par analyse du gaz expiré)[9]. Ce test non invasif, a une très bonne fiabilité et est remboursé à 65 % par la sécurité sociale[10].
- détection dans les selles par dosage immunochromatograhique ou immunoassay. Cette méthode a été démontré comme fiable pour le primo-diagnostic ainsi que pour vérifier le succès d'un traitement. World J Gastroenterol. 2013 Dec 7; 19(45): 8188–8191.
Les biopsies réalisées lors de la gastroscopie permettent aussi de constater d'éventuelles lésions atrophiques sur l'antre et le fundus. Un test à l'uréase peut être fait directement : cette dernière convertit l'urée en ammoniaque, détectée par colorimétrie pH, permettant un dépistage quasi immédiat de l'hélicobacter[11].
La plupart de ces tests (à part le test au carbone 13) perdent en sensibilité en cas d'hémorragie digestive d'origine gastrique ou duodénale[12]. De même, le test au carbone 13 peut être faussé en cas de prise d'inhibiteurs de la pompe à protons qui doivent être arrêtés idéalement deux semaines avant le test[13].
Maladies liées à cette infection
Helicobacter pylori cause plusieurs maladies plus ou moins graves suivant les individus. Ce germe cause :
- une dyspepsie non ulcéreuse ;
- des ulcères gastriques et/ou duodénaux ;
- des gastrites chroniques le plus souvent localisées sur l'antre mais qui s'étendent parfois sur le fundus. On parle alors dans ce cas de pangastrite ;
- une malabsorption de la vitamine B12 ;
- des gastrites atrophiques entraînant une hypochlorydrie voire une achlorhydrie ;
- des métaplasies intestinales qui traduisent un stade précancéreux ;
- des cancers (le cancer de l'estomac - adénocarcinome - et le lymphome du MALT gastrique) : l'helicobacter serait l'un des facteurs de risque principal du cancer gastrique[14]. L'éradication de ce germe permet de diminuer notablement la fréquence de ce type de cancer[15],[16].
- le risque de développer une forme sévère d'acné ;
H. pylori pourrait contribuer à la survenue de la maladie de Parkinson[17] ; l'éradication d'Helicobacter pylori améliorerait les résultats du traitement par lévodopa[18].
Avantages
La présence de l'helicobacter serait protectrice contre le cancer de l'œsophage[19]. Ce type de cancer est cependant beaucoup plus rare que celui de l'estomac que la bacterie contribue à provoquer. Des découvertes récentes ont montré que la bactérie n'est pas nécessairement pathogène, et qu'elle peut avoir des effets protecteurs contre l'obésité et le diabète de type 2 [20]. Le caractère pathogène résulterait en réalité de l'interaction du patrimoine génétique de la bactérie avec le système immunitaire.
Il semble qu'elle contribue parmi d'autres points positifs à combattre également l'obésité[21]. Les traitements antibiotiques qui éliminent H. pylori ont pour effet secondaire de favoriser l'obésité. Ceci pourrait peut-être contribuer à l'obésité enfantine chez certains sujets[réf. nécessaire].
Traitement de l'infection
Il existe plusieurs recommandations internationales sur la prise en charge de l'helicobacter. Les recommandations européennes sont connues sous le nom de Conférence de consensus Maastricht III et ont été publiées en 2007[22]. Les recommandations américaines ont été publiées la même année[23].
Le traitement diminue sensiblement le risque de récidive d'un ulcère gastrique et en améliore la cicatrisation[24].
En cas de dyspepsie non compliquée, il en améliore les symptômes[25].
Il pourrait par ailleurs diminuer le risque de survenue d'un cancer de l'estomac en cas de lésion précancéreuse[26].
L'efficacité du traitement est vérifiée le plus souvent par la négativation du test respiratoire à l'uréase.
La capsaïcine (extraite du piment) inhibe la croissance d'Helicobacter pylori[27].
Traitement antibiotique
Le traitement recommandé, en 2012, par la Société française de gastro-entérologie, est un traitement dit « séquentiel » avec une efficacité de 90 % pour l'éradication de la bactérie[28]. Il comprend deux séquences successives de cinq jours chacune, associant des antibiotiques à un inhibiteur de la pompe à protons (IPP) pour neutraliser l'acidité gastrique :
- d'abord amoxicilline 2 g/j + IPP à double dose pendant cinq jours,
- puis métronidazole 1 g/j + clarithromycine 1 g/j + IPP à double dose pendant cinq jours.
Ce traitement d'éradication de dix jours peut être suivi, selon les cas, d'un traitement par IPP simple dose pour quatre à six semaines.
Auparavant, il était recommandé une trithérapie associant deux antibiotiques (à choisir parmi amoxicilline, clarithromycine et métronidazole) à un IPP. La durée habituelle de traitement était alors entre une et deux semaines[29].
La lévofloxacine et la rifabutine lorsque celles-ci sont associées à l'amoxicilline auraient également une bonne efficacité. Cependant, ces traitements ne doivent être utilisés qu'en seconde ligne. Une résistance aux antibiotiques commence cependant à apparaître avec près de 20 % d'échecs d'éradication[30]. Une autre piste consiste en un traitement séquentiel comportant deux cures successives de cinq jours avec plusieurs antibiotiques différents. Cette approche semble plus efficace mais plus complexe que le traitement standard[31].
Suivi de l'éradication
En raison du risque d’échec du traitement, il faut vérifier systématiquement que Helicobacter pylori a bien été éliminé de l’estomac.
Cette vérification sera le plus fréquemment effectuée par un test respiratoire, qui est l’examen de référence.
Ce test respiratoire n'a toutefois de valeur que s'il est pratiqué au moins 4 semaines après l'arrêt des antibiotiques et au moins deux semaines après l'arrêt d'un traitement par inhibiteur de la pompe à protons (IPP).
Autres traitements
Il existe des approches préventives ou des thérapeutiques dites naturelles[32].
D'après certains auteurs, le traitement par antibiotique a une efficacité limitée à 70 % des cas, moindre que dans d'autres études[33] à cause de la présence de biofilms[34]. Une vision plus récente de la microbiologie constate que la bactérie est hébergée par au moins la moitié de la population[35], ce qui en fait plutôt une bactérie du microbiote qui dans 80 % à 90 %[36] des cas ne donnera pas d'ulcère ou de cancer. De plus la bactérie a une action contre l'obésité et le diabète[37]. L'action de la bactérie serait plutôt liée à sa capacité[38] à former un biofilm qui en attaquant la muqueuse crée l'ulcère ou le cancer[39],[40],[41],[42]. L'Acétylcystéine serait un inhibiteur de son biofilm[43],[44],[45].
Au lieu de vouloir éliminer la bactérie (qui finit souvent par réinfecter les sujets traités par des antibactériens), il serait plus judicieux de la contrôler en diminuant sa concentration gastrique. La souche probiotique Lactobacillus reuteri DSMZ 17648[46] fait preuve d'un effet inhibiteur encourageant, dont plusieurs études démontrant une réduction significative du taux de H. pylori. Les patients ayant recourt à ce traitement voient leur symptômes régresser jusqu'à disparaitre en quelques semaines.
Les huiles essentielles anti-infectieuses sont surtout les huiles essentielles à Phénol comme Origanum compactum, Thymus vulgaris à thymol, Melaleuca alternifolia, Cinnamomum zeylanicum feuilles. La Girofle (Eugenia caryophyllata) inhibe la croissance d'Helicobacter pylori[réf. souhaitée]. Une publication italienne (2017) fait l'inventaire des extraits d'agrumes reconnus pour leur activité anti-Helicobacter pylori seuls ou en association[47].
Plusieurs huiles essentielles comme Mentha piperita et Lemongrass ont montré in vitro une inhibition nette de la prolifération du HP[48].
Voir aussi : Jean-Pierre Wilhem : https://jpwillem.lettre-medecin-sante.com/helicobacter-pylori-a-60-ans-avez-chance-deux-de-lavoir/
L'efficacité de la mastication de résine de Pistacia lentiscus (lentisque pistachier), arbre méditerranéen exploité surtout dans l'île grecque de Chio, un temps alléguée[49] est aujourd'hui scientifiquement contestée [50].
Les probiotiques contribuent à diminuer la puissance de la bactérie[51].
Des essais cliniques ont validé l'efficacité d'extraits de Lithraea molleoides and A. argentinae[52].
Des sels de bismuth (métal lourd) peuvent aussi être utilisés en association avec une trithérapie. Cependant le bismuth est interdit en France depuis les années 1970 à la suite de cas d'intoxication avec troubles rénaux, ainsi que des encéphalopathies répertoriées. Le bismuth continue d'être prescrit avec succès dans de nombreux autres pays. Compte tenu d'une baisse d'efficacité de la trithérapie classique due essentiellement aux résistances à la clarithromycine (évaluée à 20 %), et à la suite des résultats d'une étude montrant l'intérêt du bismuth dans cette situation, une demande d'AMM européenne d'une association fixe de citrate de bismuth, métronidazole et tétracycline, avec prise concomitante d'oméprazole, a été déposée en 2011[53].
En 2002, un essai vaccinal avait été tenté mais celui-ci a été abandonné parce que les effets secondaires étaient trop importants. Ces effets étaient liés à l'adjuvant utilisé (toxine cholérique). De plus, l'immunisation n'était pas suffisamment efficace. Seule une réduction de la concentration bactérienne a été observée. Les chercheurs tentent de mettre au point des adjuvants non toxiques permettant de stimuler efficacement la réponse immunitaire. L'immunisation des muqueuses est très complexe. Le vaccin est toujours en cours d'étude et pourrait voir le jour dans quelques années. Celui-ci devrait permettre de traiter l'infection ainsi que la prévenir. Au cours de l'année 2007 les chercheurs ont élucidé les mécanismes permettant à la bactérie d'échapper au système immunitaire[54].
Il est aussi possible de réduire l'infection (dans les cas où les différents traitements ont échoué), sans pour autant l'éliminer, en buvant du jus de canneberge. Certaines molécules (proanthocyanidines à haut poids moléculaire) présentes dans la canneberge seraient efficaces pour empêcher l'adhésion de la bactérie aux cellules gastriques. Les bactéries sont alors éliminées naturellement lorsque l'estomac se vide[55].
Les médecins cubains traitent les cas de gériadis, d'ulcères ou d'inflammation gastriques et/ou intestinale par des huiles végétales ozonées (produit naturel dû à l'embargo), avec des résultats positifs[56].
Les Indiens Kunas d'Amérique centrale sont habitués à traiter les maux d'estomac avec du Piper multiplinervium, herbe contenant des substances efficaces contre le germe[57].
Lors d'une expérience, l'ingestion (après mastication) de 14, 28, ou 56 g de pousses de brocoli, deux fois par jour pendant 7 jours a diminué ou supprimé la présence de la bactérie, et amélioré les symptômes chez un nombre significatif de patients[58]. En revanche, la bactérie réapparaît après quelques mois. Le brocoli, et d'autres choux, peuvent ainsi être utilisés de manière préventive (l'expérience a été menée au Japon sur environ 50 patients dont la moitié consommait des germes de luzerne et l'autre moitié du brocoli)[réf. nécessaire]. Le brocoli semble par ailleurs présenter des propriétés anticancéreuses[59].
Notes et références
- (en) Chuan Zhang, Nobutaka Yamada, Yun-Lin Wu, Min Wen, Takeshi Matsuhisa, Norio Matsukura, « Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer », World journal of gastroenterology: WJG, vol. 11, no 6, , p. 791-796 (ISSN 1007-9327, PMID 15682469, lire en ligne)
- (en) Linz B, Balloux F, Moodley Y et Als. An African origin for the intimate association between humans and Helicobacter pylori, Nature, 2007;445:915-918 doi:10.1038/nature05562
- « Helicobacter pylori »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 30 mars 2013)
- Tan S, J Noto, J Romero-Gallo, R Peek, Jr., and M Amieva (2011), Helicobacter pylori perturbs iron trafficking in the epithelium to grow on the cell surface. PLoS Pathog 7: e1002050
- (en) Sharma, Hoffmann, Darfeuille, Reignier, Findeiß, Sittka, Chabas, Reiche, Hackermüller, Reinhardt, Stadler & Vogel ; The primary transcriptome of the major human pathogen Helicobacter pylori, - Nature - 17/02/1984 Télécharger l'étude ; Travail piloté par Jörg Vogel du groupe « Biologie des ARN » de l'Institut Max Planck berlinois, en collaboration avec des scientifiques de Leipzig et de l'unité de recherche INSERM 869 de l'université de Bordeaux.
- Mayerle J, den Hoed CM, Schurmann C et al. Identification of genetic loci associated with Helicobacter pylori serologic status, JAMA. 2013;309:1912-1920
- Boyanova, L (editor) (2011). Helicobacter pylori. Caister Academic Press (en). (ISBN 978-1-904455-84-4).
- (en) Loy CT, Irwig LM, Katelaris PH, Talley NJ, Do commercial serological kits for Helicobacter pylori infection differ in accuracy? A meta-analysis, Am J Gastroenterol, 1996;91:1138-44
- "haute autorité de santé, tests respiratoire à l'urée"
- "test respiratoire à l'urée"
- (en) Vaira D, Vakil N, Gatta L et al. Accuracy of a new ultrafast rapid urease test to diagnose Helicobacter pylori infection in 1000 consecutive dyspeptic patients, Aliment Pharmacol Ther, 2010;31:331-8
- (en) Gisbert JP, Abraira V, Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis, Am J Gastroenterol, 2006;101:848-63
- (en) Laine L, Estrada R, Trujillo M, Knigge K, Fennerty MB, Effect of proton-pump inhibitor therapy on diagnostic testing for Helicobacter pylori, Ann Intern Med, 1998;129:547-50
- (en) Talley NJ, Fock KM, Moayyedi P, « Gastric Cancer Consensus conference recommends Helicobacter pylori screening and treatment in asymptomatic persons from high-risk populations to prevent gastric cancer » Am J Gastroenterol. 2008;103:510-514
- (en) Fukase K, Kato M, Kikuchi S et al. for the Japan Gast Study Group. « Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial » Lancet. 2008;372:392-397
- (en) Fuccio L, Zagari RM, Eusebi LH et al. « Meta-analysis: Can Helicobacter pylori eradication treatment reduce the risk for gastric cancer? » Ann Intern Med. 2009;151:121-128
- (en) Dr Testerman Traci, Bacteria 'linked' to Parkinson's disease, BBC Online, consulté le 23 mai 2011.
- (en) Hashim H, Azmin S, Razlan H, Yahya NW, Tan HJ, Manaf MR, Ibrahim NM, « Eradication of Helicobacter pylori infection improves levodopa action, clinical symptoms and quality of life in patients with Parkinson's disease », PLoS One, vol. 9, no 11, , e112330. (PMID 25411976, PMCID PMC4239049, DOI 10.1371/journal.pone.0112330, lire en ligne [html])
- (en) Rokkas T, Pistiolas D, Sechopoulos P, Robotis I, Margantinis G, Relationship between Helicobacter pylori infection and esophageal neoplasia: a meta-analysis, Clin Gastroenterol Hepatol, 2007;5: 1413-1417
- "Futura Santé, 03/3013:Une bactérie virulente nous protègerait contre l’obésité et le diabète"
- (en) Plasma ghrelin following cure of Helicobacter pylori,
- (en) Malfertheiner P, Megraud F, O’Morain C, Bazzoli F, El-Omar E, Graham D, et al. « Current concepts in the management of Helicobacter pylori infection: the Maastricht III consensus report », Gut, 2007;56:772-81
- (en) Chey WD, Wong BCY, American College of Gastroenterology, « Guideline on the management of Helicobacter pylori infection » Am J Gastroenterol, 2007;102:1808-25
- (en) Ford AC, Delaney BC, Forman D, Moayyedi P, « Eradication therapy in Helicobacter pylori positive peptic ulcer disease: systematic review and economic analysis » Am J Gastroenterol, 2004;99:1833-55
- (en) Zagari RM, Fuccio L, Bazzoli F, « Investigating dyspepsia » BMJ, 2008;337:a1400
- (en) Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, et al. China Gastric Cancer Study Group. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial, JAMA, 2004;291:244-5
- « Capsaicin as an inhibitor of the growth of the gastric pathogen Helicobacter pylori »(en)
- http://www.snfge.asso.fr/01-Bibliotheque/0K-Conseils-pratique/pdf/Conseil-de-Pratique-SNFGE--H-pylori.pdf
- (en) Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D et al. « Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report » Gut, 2007;56:772-81
- (en) Vakil N. « Helicobacter pylori treatment: a practical approach » Am J Gastroenterol. 2006;101:497-9
- (en) Jafri NS, Hornung CA, Howden CW, « Meta-analysis: Sequential therapy appears superior to standard therapy for Helicobacter pylori infection in patients naive to treatment » Ann Int Med. 2008;148:923-931
- (en) English J, Dean W, « A natural approach to a healthy digestive tract, new research on H. pylori »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 30 mars 2013)
- "Helicobacter Pilori, efficacité traitement antibiotique"
- "2015:Biofilm Formation by Helicobacter pylori and Its Involvement for Antibiotic Resistance."
- "Groupe d'étude français des helicobacter"
- "British Society of Gastroenterology: Helicobacter pylori"
- "Mars, 2013: Hélicobacter pylori, la bactérie qui combat obésité et diabète"
- "Sciences daily, Juillet 2016: Genes found in H. pylori that influence biofilm formation"
- "Microbiology - Helicobacter Pylori (Ulcer)"
- "Pasteur contre Béchamp : le combat stérile des partisans"
- "Effect of curcumin on Helicobacter pylori biofilm formation"
- "Probiotic Lactobacillus fermentum UCO-979C biofilm formation on AGS and Caco-2 cells and Helicobacter pylori inhibition"
- "2010, Nbci:Biofilm demolition and antibiotic treatment to eradicate resistant Helicobacter pylori: a clinical trial."
- "Nbci,2015;Biofilm Formation by Helicobacter pylori and Its Involvement for Antibiotic Resistance"
- "2012:Review article: biofilm formation by Helicobacter pylori as a target for eradication of resistant infection"
- Heidrun Mehling et Andreas Busjahn, « Non-Viable Lactobacillus reuteri DSMZ 17648 (Pylopass™) as a New Approach to Helicobacter pylori Control in Humans », Nutrients, vol. 5, no 8, , p. 3062–3073 (ISSN 2072-6643, PMID 23917169, PMCID PMC3775242, DOI 10.3390/nu5083062, lire en ligne)
- (en) Giuseppina Mandalari et al., « Effectiveness of Citrus Fruits on Helicobacter pylori », Hindawi - Evidence-Based Complementary and Alternative Medicine - Volume 2017, Article ID 8379262, , p. 8 pages (lire en ligne)
- http://www.labosp.com/fr/liste_des_etudes_scientifiques/helicobacter_pylori_traitements_naturels_pour_son_eradication.doc.php
- (en) Huwez F.U., Thirlwell D., « Mastic Gum kills Helicobacter pylori » New-England Journal of Medicine, 339:1946, Dec. 24, 1998
- (en) James R. Bebb, Nathalie Bailey-Flitter, Dlawer Ala’Aldeen, John C. Atherton, « Mastic gum has no effect on Helicobacter pylori load in vivo », Journal of Antimicrobial Chemotherapy, vol. 52, no 3, , p. 522-523 (ISSN 0305-7453 et 1460-2091, PMID 12888582, DOI 10.1093/jac/dkg366, lire en ligne)
- (en) Drahoslava Lesbros-Pantoflickova, Irène Corthésy-Theulaz, André L. Blum, « Helicobacter pylori and Probiotics », The Journal of Nutrition, vol. 137, no 3, , p. 812S-818S (ISSN 0022-3166 et 1541-6100, PMID 17311980, lire en ligne)
- "Juillet 2017:Inhibition of Helicobacter pylori and Its Associated Urease by Two RegionalPlants of San Luis Argentina"
- Résultats d'une étude phase III : citrate de bismuth, métronidazole et tétracycline versus une trithérapie comportant de la clarithromycine : (en) Peter Malfertheiner, Franco Bazzoli, Jean-Charles Delchier, Krysztof Celiñski, Monique Giguère, Marc Rivière, Francis Mégraud for the Pylera Study Group, « Helicobacter pylori eradication with a capsule containing bismuth subcitrate potassium, metronidazole, and tetracycline given with omeprazole versus clarithromycin-based triple therapy: a randomised, open-label, non-inferiority, phase 3 trial », The Lancet, vol. 377, no 9769, , p. 905-913 (ISSN 0140-6736, PMID 21345487, DOI 10.1016/S0140-6736(11)60020-2, lire en ligne)
- (en) Mario Milco D’Elios, Leif P. Andersen, « Helicobacter pylori Inflammation, Immunity, and Vaccines », Helicobacter, vol. 12, , p. 15–19 (ISSN 1523-5378, PMID 17727455, DOI 10.1111/j.1523-5378.2007.00530.x, lire en ligne)
- (en) Burger O, Ofek I, Tabak M, Weiss EI, Sharon N, Neeman I., « A high molecular mass constituent of cranberry juice inhibits helicobacter pylori adhesion to human gastric mucus », FEMS Immunol Med Microbiol, vol. 29, , p. 295-301 (PMID 11118911, DOI 10.1111/j.1574-695X.2000.tb01537.x, lire en ligne)
- (en) Kulyoshina NV, Kiseloyova SV, Fatichov RR, Peretyagin SP, Kostina OV, Kuleshin VN, Struchkov AA, O3 Ozone therapy of a duodenum ulcerous disease, 4to Simposio Internacional de Aplicaciones del Ozono, 2004
- (en) Rüegg T, Calderón AI, Queiroz EF, Solís PN, Marston A, Rivas F, Ortega-Barría E, Hostettmann K, Gupta MP, « 3-Farnesyl-2-hydroxybenzoic acid is a new anti-Helicobacter pylori compound from Piper multiplinervium » Jour. of Ethnopharmacology, 2006;103:461-7
- (en) Mark V. Galan, Arfana A. Kishan et Ann L. Silverman, « Oral Broccoli Sprouts for the Treatment of Helicobacter pylori Infection: A Preliminary Report » Digestive Diseases and Sciences Volume 49, Numbers 7-8, 1088-1090, DOI:10.1023/B:DDAS.0000037792.04787.8a (résumé, en anglais)
- (en) Elizabeth H. Jeffery and Marcela Araya, « Physiological effects of broccoli consumption » Biomedical and Life Sciences Phytochemistry Reviews Volume 8, Number 1, 283-298, DOI:10.1007/s11101-008-9106-4 ; From the issue entitled « Glucosinolate Biology, Chemistry and Biochemistry, and its Application to Human Health and Agriculture » (PSE meeting Jena, Germany, 10–14 September 2006) » (Résumé, en anglais)
Voir aussi
Articles connexes
Liens externes
Bibliographie
- (en) Hatakeyama M (2011), Anthropological and clinical implications for the structural diversity of the Helicobacter pylori CagA oncoprotein. Cancer Sci102:36-43
- Portail de la microbiologie
- Portail de la médecine