Fibrillation atriale
La fibrillation atriale, également appelée fibrillation auriculaire (FA) est le plus fréquent des troubles du rythme cardiaque. Elle fait partie des troubles du rythme supra-ventriculaires. Elle correspond à une action non coordonnée des cellules myocardiques auriculaires, entraînant une contraction rapide et irrégulière des oreillettes cardiaques.
.jpg)
| Spécialité | Cardiologie |
|---|
| CISP-2 | K78 |
|---|---|
| CIM-10 | I48 |
| CIM-9 | 427.31 |
| OMIM | 611819 et 615770 613120, 611819 et 615770 |
| DiseasesDB | 1065 |
| MedlinePlus | 000184 |
| eMedicine | 151066 |
| eMedicine | med/184 emerg/46 |
| MeSH | D001281 |
![]()
Le terme de fibrillation auriculaire est d'usage habituel, mais depuis 1998 la dénomination académique est « fibrillation atriale », les oreillettes cardiaques ayant été renommés « atria » dans la nouvelle nomenclature anatomique[1]. D'autres noms sont également rencontrés : arythmie complète par fibrillation auriculaire (AC/FA ou ACFA) et parfois tachy-arythmie complète par fibrillation auriculaire (TAC/FA).
La fibrillation atriale est parfois dénommée par abus de langage arythmie ; cependant ce terme est synonyme de trouble du rythme, notion plus large et qui inclut la fibrillation atriale.
Historique
La fibrillation auriculaire a été décrite pour la première fois chez l'homme en 1906, à la suite de l'observation d'un syndrome analogue chez l'animal[2], et cela sans utilisation de l'électrocardiogramme, outil de diagnostic encore inexistant. Willem Einthoven, l'inventeur de l'électrocardiogramme, publie le premier tracé de fibrillation la même année[3]. Le caractère commun des syndromes initialement observés est reconnu dès 1909[4].
Terminologie
On parle de fibrillation atriale[5] :
- paroxystique : durée inférieure à 7 jours (généralement 48h), se terminant spontanément ou par cardioversion ;
- persistante : durée supérieure à 7 jours, arrêtée spontanément ou par cardioversion ;
- persistante prolongée : durée supérieure à 1 an pour laquelle une stratégie de contrôle du rythme est envisagée ;
- permanente : si l'arythmie est acceptée et qu'on ne tentera plus de l'arrêter.
- Les formes paroxystique ou persistante pouvant être récurrentes.
Épidémiologie
C'est le trouble du rythme cardiaque le plus fréquent, en particulier chez l'adulte âgé. L'incidence et la prévalence de la FA augmentent considérablement avec l'âge[6],[7]:
- Incidence : moins de 1 cas nouveau pour 1000 par an avant l'âge de 40 ans, 5/1000 par an vers la soixantaine (augmentation supérieure à un facteur 5) et 15 à 20/1000 par an après l'âge de 80 ans (incidence multipliée par 20 entre les âges de 40 et 80 ans) ;
- Prévalence : de l'ordre de 1 pour cent de la population avant 60 ans et de l'ordre de 10 pour cent ou plus après 80 ans (compte tenu des longévités respectives hommes/femmes dans cette dernière classe d'âge). De par le monde, la fibrillation atriale touche plus de 33 millions de personnes (données 2010, avec une prévalence plus forte en Amérique du Nord et plus faible en Asie) et son incidence tend à s’accroître[8].
Causes
Plusieurs pathologies cardiaques peuvent être associées à la survenue du trouble rythmique. Ainsi une augmentation chronique de la pression sanguine dans l'oreillette gauche, due à un rétrécissement mitral ou encore à une insuffisance mitrale, une hypertension artérielle, une insuffisance cardiaque (quelle qu'en soit la cause), constituent un terrain favorisant la survenue d'une arythmie sinusale. De même, toute anomalie anatomique ou histologique (voies de conduction anormales) des oreillettes prédispose à la survenue de troubles du rythme supra-ventriculaire. Il peut s'agir enfin d'une complication d'une intervention de chirurgie cardiaque.
En dehors des pathologies cardiaques, on recherchera systématiquement les circonstances pathologiques, aiguës ou chronique, favorisant la survenue du syndrome : l'hyperthyroïdie, l'embolie pulmonaire, un état d'alcoolisation aiguë ou chronique[9]. La prise de certains stupéfiants (cocaïne et crack), de certains médicaments (tous les neuro-excitants (sympathomimétiques), la prise de traitements contre le rhume, la prise de théophylline (pour l'asthme) ou d'acide zolédronique (traitement adjuvant de certains cancers ou encore de l'ostéoporose).
On sait également que la présence d'un bloc auriculo-ventriculaire du premier degré multiplie par quatre le risque de survenue d'une fibrillation auriculaire[10].
Il existe enfin des facteurs génétiques prédisposant à la fibrillation atriale[11]. Plusieurs gènes, indépendamment de ceux qui sont directement facteurs de pathologies cardiaques, ont été identifiés comme étant des facteurs indépendants de risque de fibrillation atriale : mutation sur le gène du peptide natriurétique auriculaire[12], gène SCN5A[13], gène KCNH2[14] ou mutation sur un locus du chromosome 4q25[15],[16].
Le rôle du tabagisme est discuté, l'augmentation du risque de fibrillation atriale semblant faible[17].
Les cardiologues du sport connaissent enfin par ailleurs l'existence d'épisodes de FA paroxystique associés à un habitus d'entraînement intense et très régulier en endurance (cyclistes, marathoniens, skieurs de fond…). Ce contexte particulier multiplierait le risque de FA spontanée par 2 ou 3 :
- le risque de FA idiopathique apparaît en fait corrélé à la majoration du diamètre et du volume de l'oreillette gauche OG, modifications fonctionnelles liées elles-mêmes à la surcharge de travail chronique de l'OG due à l'entraînement intense et régulier[18] ;
- le déconditionnement progressif, c'est-à-dire l'astreinte à une pratique physique régulière d'endurance très limitée en intensité, pourrait (hypothèse controversée) diminuer progressivement ce risque selon certains auteurs[19].
- différentes observations cliniques laissent penser que certains épisodes de FA paroxystique, notamment ceux affectant les sujets surconditionnés en endurance aérobie, pourraient paradoxalement être traités par un exercice physique d'intensité et de durée appropriées[20].
Physiopathologie
La contraction cardiaque normale procède d'une dépolarisation (inversion de la polarité électrique de la membrane cellulaire) cyclique d'un groupe de cellules situé au niveau de la partie haute de l'oreillette droite et constituant le nœud sinusal (ou nœud sino-atrial - NSA). Cette dépolarisation se propage très rapidement (en moins d'un dixième de seconde), de haut en bas et de proche en proche, à l'ensemble des cellules des deux oreillettes, déclenchant leur contraction quasi synchrone, ainsi qu'en direction du nœud atrio-ventriculaire (NAV). L'activation du NAV par les potentiels d'action issus de l'oreillette déclenchera à son tour la contraction des deux ventricules, mais de façon légèrement retardée relativement à celle des oreillettes. Pour mémoire, la contraction des oreillettes permet un surcroît de remplissage des ventricules (de l'ordre de 20 à 30 % selon l'âge du sujet), juste avant la systole : c'est la phase dite de remplissage actif.
Lors de la phase d'initiation de la fibrillation auriculaire (FA), des rétro-boucles du courant de dépolarisation (circuits dit de réentrée) apparaissent, lesquelles vont venir réexciter de façon précoce des fibres musculaires sortant juste de leur période réfractaire, générant alors une activation électrique inappropriée et désynchronisée de ces fibres. La généralisation de ce mécanisme à l'ensemble du tissu auriculaire conduira alors à la fibrillation des oreillettes. L'activation du NAV par des trains de potentiels d'action désynchronisés se fera alors de façon anarchique, le NAV transmettant alors aux ventricules une onde de dépolarisation (via le faisceau de His) de fréquence très irrégulière et le plus souvent anormalement rapide (mais pas toujours) : c'est le classique phénomène de tachyarythmie. Dans ce phénomène d'initiation de la FA, on incrimine également l'intervention de foyers dits ectopiques, centres d'hyperexcitabilité à fréquence de décharge très rapide. Ces foyers ectopiques peuvent se localiser à de nombreux endroits différents des oreillettes, mais principalement au niveau des orifices des veines pulmonaires dans l'oreillette gauche. Ces deux types de mécanismes pourraient agir de façon plus ou moins synergique dans le phénomène déclenchant la fibrillation. Enfin, une anomalie primitive ou secondaire - i.e. à une affection aiguë ou chronique par exemple - des fibres des oreillettes, caractérisées alors par un raccourcissement pathologique de leur période réfractaire, va encore accentuer le mécanisme de réentrée décrit précédemment. À cet égard il a été montré par de nombreux auteurs que, en cas de fibrillation auriculaire permanente, la période réfractaire des fibres auriculaires a « naturellement » tendance à se raccourcir progressivement, remodelage tissulaire permanent qui va contribuer par lui-même à pérenniser l'état de fibrillation. La vocation naturelle de la FA est donc de s'autorenforcer dans une sorte de « cercle vicieux ». On dit que « la FA entraîne la FA », de sorte que si le traitement médical ne réussit pas rapidement à réduire l'état de fibrillation (par traitement médicamenteux), passé un certain délai la cardioversion devient difficilement réalisable, quels que seront alors les moyens électriques ou pharmacologiques mis en œuvre [21].
Cette disparition de la synchronisation de contraction des fibres musculaires auriculaires a deux types de conséquences ou risques :
- des conséquences hémodynamiques : les oreillettes vont devenir mécaniquement inefficaces : elles ne se contractent plus (perte de la systole physiologique) ; il y a donc disparition du remplissage ventriculaire actif en fin de systole, d'où une diminution mécanique du débit ventriculaire et par le fait du débit cardiaque. De plus, du fait de la tachycardie le plus souvent associée à la fibrillation atriale, le remplissage passif des ventricules au cours de la diastole va également lui aussi être limité par l'importante réduction de la durée diastolique.
- des risques emboliques : l'absence de contraction auriculaire favorise une certaine stagnation du sang dans les oreillettes, un état de stase sanguine dont on sait qu'elle favorise l'apparition de thrombus (ou thrombi) par phénomène de coagulation spontanée (au niveau de l'auricule particulièrement). En présence d'une FA, et tant que la cardioversion n'est pas réalisée, il convient donc d'administrer un traitement anticoagulant héparinique (en aigu) ou sous forme d'antivitamines K (AVK) pour les FA permanentes irréductibles. En cas de contre-indication aux anticoagulants, un traitement par anti-agrégants plaquettaires peut constituer une solution alternative pour le traitement des FA permanentes (voir détails infra avec la section « Traitement »).
| Conduction | ||
Rythme sinusal  |
Fibrillation auriculaire  | |
La survenue d'un état de fibrillation atriale est globalement favorisée :
- lorsque l'oreillette gauche est dilatée (diamètre supérieur à 5 cm à l'échographie) ;
- lorsque les fibres auriculaires sont soumises à une élévation permanente du taux de thyroxine, ou de catécholamines.
Lors d'une fibrillation auriculaire, la fréquence auriculaire peut atteindre les 300 battements par minute. Du fait de la présence du nœud auriculo-ventriculaire, l'intégralité du signal électrique auriculaire se voit filtrée, entraînant ainsi une limitation marquée de la fréquence cardiaque ventriculaire de base. Le ventricule bat alors à une fréquence bien moindre que les oreillettes, même s'il reste assez rapide, permettant ainsi le plus souvent, grâce au traitement médicamenteux associé, une bonne tolérance de la pathologie par le patient (au repos notamment).
Diagnostic
Signes fonctionnels
Le patient peut être totalement asymptomatique et la fibrillation découverte au cours d'un électrocardiogramme systématique ou réalisé pour une tout autre raison.
- Les palpitations sont parfois ressenties par le patient comme étant discrètes, mais parfois comme très irrégulières.
- Le patient peut se plaindre d'une fatigue (asthénie), de malaises (lipothymies), d'un essoufflement (dyspnée), d'un sentiment d'angoisse dans certains cas.
- Il peut se plaindre enfin de douleurs thoraciques, en cas d'angor fonctionnel notamment.
Examen clinique
- Le rythme cardiaque est irrégulier, plus ou moins rapide. La fréquence cardiaque doit impérativement, dans ce cas, être estimée à l'auscultation cardiaque et non par la seule mesure du pouls. Dans le cas contraire, le chiffre trouvé pourrait être erroné par sous-estimation.
- On recherche de manière systématique des signes d'insuffisance cardiaque.
- On recherche encore par l'interrogatoire (ou des témoignages de proches) une notion de déficit neurologique transitoire (accident ischémique transitoire) ou patent (accident vasculaire cérébral constitué), signe alors d'une complication grave et urgente de l'arythmie atriale.
- On recherche enfin des signes en faveur d'une cause particulière : HTA, souffle cardiaque, signes d'hyperthyroïdie, d'embolie pulmonaire, de péricardite (frottement péricardique)…
Examens complémentaires
ECG
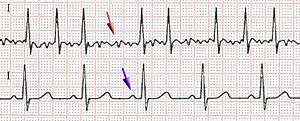
Cet examen est la clé du diagnostic. On note l'absence d'activité auriculaire organisée avec disparition des ondes P au profit d'une trémulation de la ligne iso-électrique. La fréquence ventriculaire (QRS) est irrégulière. Les QRS sont fins (sauf bloc de branche pré-existant). L'électrocardiogramme permet également dans certains cas d'orienter vers certaines causes.
Le diagnostic est parfois moins aisé puisqu'une étude de 2007 montre que les logiciels d'interprétation automatisée de l'ECG ignorent ce diagnostic dans près de 20 % des cas[22].
Le diagnostic peut être fait également sur un enregistrement électrocardiographique prolongé (holter cardiaque).
L'aspect peut parfois être confondu avec celui d'une flutter auriculaire ou d'une tachysystolie, surtout si la conduction auriculo-ventriculaire est irrégulière. Si l'arythmie est rapide et régulière, la ligne iso-électrique n'est pas visible et un diagnostic de tachycardie jonctionnelle peut-être donc être avancé de façon erronée. Il est important alors d'avoir un tracé de durée suffisante afin de démasquer les irrégularités signant la fibrillation. Dans les rares cas litigieux, une injection d'adénosine triphosphate permet de bloquer transitoirement le nœud auriculo-ventriculaire, permettant ainsi de démasquer les oscillations irrégulières de la ligne de base, signant la fibrillation auriculaire.
Échographie cardiaque
l'échocardiographie permet de visualiser le cœur et ses cavités par technique ultrasonore. Elle permet ainsi de rechercher la cause d'une arythmie et d'en évaluer le retentissement sur le muscle cardiaque :
- étude des valves cardiaques, recherche d'anomalies de la valve mitrale pouvant orienter vers la cause de l'arythmie ;
- étude des cavités cardiaques : recherche d'une hypertrophie ventriculaire gauche (HVG), d'un thrombus de l'oreillette gauche, d'une dilatation auriculaire, cette dernière pouvant être la cause de l'arythmie mais aussi la conséquence de celle-ci, notamment si elle est ancienne ;
- caractéristiques de l'insuffisance cardiaque (systolique ou diastolique) si elle existe.
Autres examens
Au minimum :
- bilan biologique standard, comportant un bilan de la coagulation, un traitement anticoagulant étant susceptible d'être prescrit ;
- dosage de la TSH à la recherche d'une hyperthyroïdie.
Suivant les cas :
- radiographie pulmonaire pour l'évaluation de la taille du cœur et la recherche d'une surcharge vasculaire témoignant d'une insuffisance cardiaque ;
- Holter cardiaque (enregistrement de l'ECG sur 24h) si l'arythmie est paroxystique ;
Évolution et complications
La fibrillation auriculaire est généralement contrôlée par un traitement adapté. Cependant, sa tendance « naturelle » est d'évoluer vers la chronicité : de paroxystique devenant progressivement persistante, puis permanente. Cet état chronique est potentiellement à la source de multiples complications possibles :
- augmentation de la mortalité cardiovasculaire (risque multiplié par 2 en moyenne) et de la mortalité globale ;
- accidents thrombo-emboliques : le risque d'accident vasculaire cérébral est en particulier multiplié d'un facteur 5 en l'absence de traitement anticoagulant ou anti-agrégant adéquat[23]. Ce risque peut être estimé de façon systématique par le calcul d'un score de risque embolique ;
- insuffisance cardiaque par 'cardiomyopathie rythmique' ;
- maladie rythmique de l'oreillette ('maladie du sinus') : dysfonction du nœud sinusal qui se caractérise par l'alternance d'épisodes itératifs de bradycardie (passage en rythme ventriculaire lent) ou au contraire de fibrillation paroxystiques, FA paroxystique pouvant devenir à terme permanente.
- complications iatrogènes (secondaires aux traitements médicamenteux ou médico-chirurgicaux) ;
- dans le cas particulier (et très rare) du syndrome de Wolff-Parkinson-White : un épisode de fibrillation auriculaire paroxystique à conduction rapide expose au risque majeur de fibrillation ventriculaire et donc de mort subite.
Le pronostic des formes paroxystiques et des formes non paroxystiques reste discuté : les recommandations américaines stipulent que le risque thromboembolique est identique dans les deux formes[24] mais certaines données montrent le caractère plus péjoratif des formes non paroxystiques[25].
Traitement
La prise en charge de la fibrillation auriculaire a fait l'objet de plusieurs publications de recommandations : la dernière version européenne date de 2016[26] et celles, américaines[24], ont été mises à jour en 2014.
L'éviction de certains excitants (alcool et caféine) peut assez souvent contribuer à espacer les crises paroxystiques. Le régime méditerranéen associé à une supplémentation en huile d'olive pourrait réduire le risque de survenue de ce trouble rythmique[27]. Le traitement médical repose sur plusieurs points :
- réduction de la fibrillation (médicamenteuse ou par cardioversion), c'est-à-dire, obtenir un retour à un rythme sinusal, normal ;
- réduire le risque de récidive ;
- ralentir la fréquence cardiaque pendant l'arythmie, permettant ainsi une meilleure tolérance de celle-ci ;
- prévention des complications emboliques surtout.
La réduction de la fibrillation
Elle consiste en un retour à un rythme normal dit sinusal. Elle est également appelée cardioversion.
Elle peut être obtenue par l'administration de médicaments ou par choc électrique externe. En cas de fibrillation auriculaire de moins de 48 h, elle peut être tentée d'emblée, sans précaution particulière[28]. Si la date de début est inconnue ou plus ancienne, elle doit être précédée d'une mise sous traitement anticoagulant efficace pendant au minimum 3 semaines, ou après échographie transœsophagienne de contrôle destinée à vérifier l'absence de thrombus constitué dans les oreillettes.
La cardioversion apparaît d'autant plus rentable sur le plan médical que la fibrillation est récente, datant de moins de six mois[29]. Le risque de récidive à court terme de la FA apparaît en effet d'autant plus limité que l'état de fibrillation a été très court et contrôlé d'emblée, qu'il n'y a pas eu préalablement de tentatives répétées et infructueuses de réduction et bien sûr qu'il n'y a aucune notion d'un état cardiaque pathologique déjà ancien.
La réduction médicamenteuse peut être réalisée par l'administration d'anti-arythmiques de type amiodarone ou flécaïnide, par voie orale ou par voie intraveineuse. Dans certains cas, cette réduction peut être faite par le patient lui-même en ambulatoire (sans hospitalisation), par la prise orale d'une dose unique d'un anti-arythmique dès l'apparition des symptômes[30] (pill-in-the-pocket approach).
La réduction électrique (défibrillation) se fait sous anesthésie générale brève, par délivrance d'un choc électrique de courte durée au niveau de la poitrine du patient. Il ne doit pas y avoir de surdosage en digitaliques éventuellement prescrits lors de la réalisation du choc.
Le maintien en rythme sinusal
Après réduction, il s'effectue par la prescription de médicaments anti-arythmiques par voie orale (exemples de molécules utilisables : amiodarone, dronédarone[31], propafenone, disopyramide, sotalol (bêta-bloqueur à effet stabilisant de membrane - ASM), flécaïnide et quinidine). Le taux de récidives reste cependant élevé.
La prescription d'un traitement médicamenteux anti-arythmique n'est pas obligatoire s'il s'agit d'une première crise, de résolution rapide, avec une tolérance correcte et l'absence de maladie cardiaque sous-jacente.
La perte de poids (chez l'obèse) permet de diminuer substantiellement le risque de récidive[32]. De même l'exercice physique contribue à stabiliser le rythme[33].
La maîtrise de la fréquence cardiaque
Lorsque les tentatives de réduction se sont soldées par un échec, ou qu'il y a une contre-indication à la réduction, on se contentera de ralentir le rythme cardiaque afin d'éviter l'apparition de symptômes invalidants et d'une mauvaise tolérance cardiaque. Se contenter du ralentissement de l'arythmie, serait plus efficace, en termes de durées d'hospitalisations et de mortalité, que d'essayer de régulariser le rythme ou d'empêcher la récidive du trouble rythmique[34]. De même, en cas d'insuffisance cardiaque, une attitude agressive visant à réduire la fibrillation et à maintenir le rythme sinusal par des moyens médicamenteux ne semble pas supérieure en termes de morbi-mortalité et d'évolution dans le temps au regard d'une attitude se contentant de ralentir et contrôler la fréquence cardiaque[35].
Des médicaments tels que les bêta-bloquants, les inhibiteurs calciques bradycardisants (diltiazem et vérapamil), ainsi que la digoxine - et dans une moindre mesure l’amiodarone, en raison de ses multiples effets secondaires à long terme - peuvent être utilisés.
L'objectif est de maintenir la fréquence cardiaque de repos à moins de 80 battements par minute, mais un contrôle moins strict (fréquence de repos inférieure à 110/min) semble tout aussi efficace[36].
En cas d'échec, il est possible de réaliser une « déconnexion » entre les oreillettes et les ventricules cardiaques par une technique de radio-fréquence qui va détruire le faisceau de His. Cette méthode nécessite la mise en place d'un stimulateur cardiaque définitif.
Prévention de la formation d'un thrombus dans l'oreillette
Lorsque le traitement anticoagulant est instauré dans le cadre de la prévention des accidents thrombo-emboliques cérébraux, il n'est pas nécessaire d'organiser un relais avec une héparine (héparine non fractionnée), à la différence du traitement de la maladie thromboembolique veineuse (phlébite ou embolie pulmonaire)[37].
En règle générale, le traitement anticoagulant est poursuivi au moins 1 mois après la réduction puis arrêté si l'arythmie a disparu et qu'il existe une forte probabilité pour qu'elle ne récidive pas.
Si l'arythmie persiste ou si le maintien en rythme sinusal semble aléatoire (fibrillation auriculaire paroxystique), le maintien de l'anticoagulation doit être discuté selon le risque estimé de complication thrombo-embolique. En 2001 a été créé dans ce but le score CHADS2[38], les lettres étant les initiales de « Cardiac insufficiency » (insuffisance cardiaque), « Hypertension », « Âge » (supérieur à 75 ans), « Diabète » et « Stroke » (antécédent d'accident vasculaire-cérébral). La présence de chaque item compte pour un point, sauf pour le dernier (accident neurologique), comptant pour deux points (expliquant le « 2 » du nom du score). Ce score est corrélé avec le risque de complications thrombotiques. Ce score a été complété en 2010, appelé CHA2DS2-VASc, comportant en plus d'autres critère : le sexe féminin, la présence d'une maladie vasculaire et un âge intermédiaire (entre 65-75 ans)[39]. En pratique, un score à 1 ou à 0 indique un score faible et l'absence de nécessité d'un traitement anticoagulant[5]. En cas, de valvulopathie mitrale significative (rétrécissement mitral ou insuffisance mitrale), le risque thrombotique est élevé, quel que soit le score CHADS2 et le traitement anticoagulant est indiqué. Le risque varie également en fonction du type de fibrillation : il est plus important si cette dernière est permanente ou persistante que si elle est seulement paroxystique[40],[41]. De même, il n'est pas clair si le risque se majore au delà d'un seuil (« charge en fibrillation atriale ») ou si cette augmentation du risque est continue avec la durée de l'arythmie[42].
Dans certains cas, le risque du traitement anticoagulant apparaît plus élevé que le bénéfice attendu ; on préfère alors utiliser les antiagrégants plaquettaires : essentiellement l'aspirine. Cette dernière molécule a démontré une certaine efficacité dans la prévention des accidents emboliques, mais à un degré sensiblement moindre que le traitement anticoagulant[43]. L'ajout de clopidogrel diminue significativement le risque vasculaire mais majore le risque hémorragique[44].
Le ximélagatran, un inhibiteur de la thrombine, serait au moins aussi efficace que les antivitamines K, mais son développement a été arrêté en raison d'effets secondaires hépatiques[43]. Une autre molécule du même type, le dabigatran, semble prometteuse avec une efficacité au moins comparable aux antivitamines K et un risque de saignement moindre[45]. D'autres molécules, de la classe des inhibiteurs du facteur Xa comme le rivaroxaban[46] et l'apixaban[47] ont des résultats équivalents. Ces médicaments présentent l'avantage de ne pas nécessiter de surveillance régulière de l'INR par prélèvements sanguin répétés. Leurs inconvénients sont l'absence d'antidote (mais ils sont cours d'élaboration) en cas de saignement (mais la demi-vie courte des molécules considérées limite en principe ce risque) ainsi que leur coût non négligeable.
L'un des problèmes essentiels de ce type de traitement, quel qu'il soit, est l'estimation empirique du risque hémorragique. Il peut être aidé par le calcul d'un score HAS-BLED[48] reposant sur plusieurs critères : hypertension artérielle non contrôlée (1), insuffisance rénale (1) ou hépatique (1), antécédent d'accident vasculaire cérébral (1), antécédent de saignement(1), INR instable(1), âge supérieur à 65 ans, consommation de médicaments(1) ou d'alcool(1). Ce score est 9. C'est un acronyme de l'anglais « Hypertension, Abnormal renal or hepatic fonction, Stroke, Bleeding, Labile INR, Eldery, Drugs or alcohol ». On note toutefois que certains critères de risque hémorragiques sont les mêmes que ceux de risque d'accident embolique. Un score HAS-BLED élevé ne contre-indique pas la prescription d'AVK, tout dépend de la balance bénéfice risque. Les patients avec un score HAS-BLED élevé doivent être surveillés de manière plus rapprochée s'ils sont traités.
Une alternative, en cas de contre-indication aux anti-coagulants, est la fermeture de l'auricule gauche, petite poche en cul-de-sac de l'oreillette gauche où se constituent le plus fréquemment les thrombus[49]. Cette technique est réalisée par cathétérisme transeptal (passage dans l'oreillette gauche en traversant le septum interauriculaire), sous scopie et contrôle par échographie transœsophagienne chez un patient sous anesthésie générale. Elle conduit à la mise en place d'un dispositif permettant d'occlure l'auricule. Elle donne des résultats équivalents aux antivitamines K[50].
Traitement de la cause
Si une cause a été déterminée, le traitement de cette dernière, lorsqu'elle est possible, est souvent le moyen le plus simple de traiter l'arythmie de manière définitive : traitement d'une hyperthyroïdie, chirurgie valvulaire…
Techniques ablatives
La plupart des fibrillations auriculaires proviennent de foyers d'activation situés au niveau de l'arrivée des veines pulmonaires dans l'oreillette gauche[51] : l'isolement électrique des veines pulmonaires par voie endocavitaire (ablation par radio-fréquence) permet de diminuer très sensiblement le risque de récidive par rapport au traitement anti-arythmique classique[52] et est pratiqué dès la fin des années 1990[53]. Il s'agit cependant d'une technique longue et complexe (nécessitant de passer un cathéter spécial dans l'oreillette gauche en passant à travers le septum inter-auriculaire : cathétérisme trans-septal), avec un risque de complications d'un peu plus de 5 %[53] avec, essentiellement, des rétrécissements des veines pulmonaires et des épanchements péricardiques compressifs (tamponnade). Le risque embolique reste controversé après la procédure et il est généralement recommandé la poursuite des anticoagulants pendant quelques mois[54]. Enfin, la récidive de l'arythmie est une éventualité fréquente, même à long terme, pouvant conduire à une nouvelle intervention. Il n'est donc pas possible, dans ces conditions, de parler de « guérison »[55].
Ces techniques, sont pour l'instant, essentiellement utilisées en cas de fibrillation auriculaire récidivante et mal tolérée malgré un traitement anti-arythmique optimal[56]. Elles peuvent cependant être discutées en 1re intention dans certains cas (AC/FA paroxystique sur cœur sain, notamment chez le sujet sportif, ou cardiomyopathie rythmique[5]). Son utilisation en cas d'insuffisance cardiaque semble se révéler plus intéressante pour le confort des patients concernés[57].
Notes et références
- http://www.sfcardio.fr/enseignement/cardiologues-en-formation/documents-de-travail/cardiologie/ p. 168
- Cushny AR, Edmunds CW, Paroxysmal irregularity of the heart and auricular fibrillation, In: Bulloch W, ed. Studies in pathology. Aberdeen, Scotland: University of Aberdeen, 1906:95-110
- Einthoven W. Le télécardiogramme. Arch Int Physiol 1906;4:132-164
- Lewis T, Auricular fibrillation: a common clinical condition, BMJ, 1909;2:1528-1528
- Kirchof P, Benussi S et al. "2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS". Eur Heart J. 2016. doi: 10.1093/ eurheartj/ehw210. Forthcoming.
- (en) Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM, Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study), Am J Cardiol, 1994;74:236-241
- (en) Miyasaka Y, Barnes ME, Gersh BJ et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence, Circulation, 2006;114:119-125
- (en) Chugh SS, Havmoeller R, Narayana K et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study Circulation. 2014;129:837–847
- Larsson SC, Drca N, Wolk A, Alcohol consumption and risk of atrial fibrillation: A prospective study and dose-response meta-analysis, J Am Coll Cardiol, 2014;64:281-289
- (en) Cheng S, Keyes MJ, Larson MG et al. « Long-term outcomes in individuals with prolonged PR interval or first-degree atrioventricular block » JAMA, 2009;301:2571–7
- (en) Fox CS, Parise H, D'Agostino RB Sr et al. « Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring » JAMA. 2004;291:2851-2855.
- (en) Hodgson-Zingman DM, Karst ML, Zingman LV et al. Atrial natriuretic peptide frameshift mutation in familial atrial fibrillation, N Engl J Med, 2008;359:158-165
- Olson TM, Michels VV, Ballew JD et al. Sodium channel mutations and susceptibility to heart failure and atrial fibrillation, JAMA, 2005;293:447-454.
- Sinner MF, Pfeufer A, Akyol M et al. The non-synonymous coding IKr-channel variant KCNH2-K897T is associated with atrial fibrillation: results from a systematic candidate gene-based analysis of KCNH2 (HERG), Eur Heart J, 2008;29:907–914
- Gudbjartsson DF, Arnar DO, Helgadottir A et al. Variants conferring risk of atrial fibrillation on chromosome 4q25, Nature, 2007;448:353–357
- (en) Kaab S, Darbar D, van NC et al. Large scale replication and meta-analysis of variants on chromosome 4q25 associated with atrial fibrillation, Eur Heart J, 2009;30:813–19
- Zhu W, Yuan P, Shen Y, Wan R, Hong K, Association of smoking with the risk of incident atrial fibrillation: a meta‐analysis of prospective studies, Int J Cardiol, 2016;218:259–66
- (en) Molina L, Mont L, Marrugat J, Berruezo A, Brugada J, Bruguera J, Rebato C, Elosua R. « Long-term endurance sport practice increases the incidence of lone atrial fibrillation in men: a follow-up study » Europace. 2008 May;10(5):618-23
- (en) Mozaffarian D, Furberg CD, Psaty BM, Siscovick D. [Physical activity and incidence of atrial fibrillation in older adults: the cardiovascular health study.], Circulation. 2008 Aug 19;118(8):800-7
- (en) Ragozzino W, Snyder J, Nayak. [Self-Cardioversion of Paroxysmal Lone Atrial Fibrillation with Exercise], N Engl J Med, 2002;347,25:2085
- (fr) Le Heuzey JY, Copie X, Henry P et al. [Mechanisms of atrial fibrillation. ], Presse Med. 1996 Apr 6;25(12):590-4. Review
- (en) Mant J, Fitzmaurice DA, Hobbs FDR, et als. Accuracy of diagnosing atrial fibrillation on electrocardiogram by primary care practitioners and interpretative diagnostic software: analysis of data from screening for atrial fibrillation in the elderly (SAFE) trial, BMJ, 2007;335:380-2
- (en) Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study, Stroke, 1991;22:983-988
- January CT, Wann LS, Alpert JS et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation : A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society, JACC, 2014;64:e1–e76
- Ganesan AN, Chew DP, Hartshorne T et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis, Eur Heart J, 2016;37:1591-1602
- Kirchhof P, Benussi S, Kotecha D, 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS, Eur Heart J, 2016;37:2893-2962
- Martínez-González MA, Toledo E, Arós F et al. Extravirgin olive oil consumption reduces risk of atrial fibrillation: The PREDIMED (Prevención con Dieta Mediterránea) Trial, Circulation, 2014;130:18-26
- Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC), Eur Heart J, 2010;31:2369-2429
- Frick M, Frykman V, Jensen-Urstad M et al. Factors predicting success rate and recurrence of atrial fibrillation after first electrical cardioversion in patients with persistent atrial fibrillation, Clin Cardiol, 2001;24:238–244
- Paolo Alboni, M.D., Giovanni L. Botto, M.D. et al. Outpatient Treatment of Recent-Onset Atrial Fibrillation with the “Pill-in-the-Pocket” Approach, N Engl J Med 2004; 351:2384-2391.
- Hohnloser SH, Crijns HJ, van Eickels M et al. ATHENA Investigators, Effect of dronedarone on cardiovascular events in atrial fibrillation, N Engl J Med, 2009;360:668-78
- Pathak RK, Middeldorp ME, Meredith M et al. Long-term effect of goal-directed weight management in an atrial fibrillation cohort: A long-term follow-up study (LEGACY), J Am Coll Cardiol; 2015;65:2159-2169
- Malmo V, Nes BM, Amundsen BH, Tjonna AE, Stoylen A, Rossvoll O, Wisloff U, Loennechen JP, Aerobic interval training reduces the burden of atrial fibrillation in the short term: a randomized trial, Circulation, 2016;133:466–473
- (en) The AFFIRM investigators, A comparison of rate control and rhythm control in patients with atrial fibrillation, N Engl J Med, 2002; 34: 1825–1833
- (en) Roy D, Talajic M, Nattel S et al. [358:2667-2677 Rhythm control versus rate control for atrial fibrillation and heart failure], N Eng J Med, 2008;358:2667-2677
- Van Gelder IC, Groenveld HF, Crijns HJ et al. Lenient versus strict rate control in patients with atrial fibrillation, N Engl J Med, 201;362:1363–1373
- Wigle P, Hein B, Bloomfield HE, Tubb M, Doherty M. Updated guidelines on outpatient anticoagulation, Am Fam Physician, 2013 Apr 15;87(8):556-66. PubMed .
- Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ, Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation, JAMA, 2001;285:2864-2870
- (en) Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ, « Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart survey on atrial fibrillation » Chest. 2010;137:263-272
- (en) Steinberg BA, Hellkamp AS, Lokhnygina Y et al. « Higher risk of death and stroke in patients with persistent vs. paroxysmal atrial fibrillation: results from the ROCKET-AF Trial » Eur Heart J. 2015;36:288-296
- (en) Vanassche T, Lauw MN, Eikelboom JW et al. « Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES » Eur Heart J. 2015;36:281-288.
- Chen LY, Chung MK, Allen LA et al. Atrial fibrillation burden: Moving beyond atrial fibrillation as a binary entity: A scientific statement from the American Heart Association, Circulation, 2018;137:e623-e644
- (en) Hart RG, Pearce LA, Aguilar MI, Meta-analysis: Antithrombotic Therapy to Prevent Stroke in Patients Who Have Nonvalvular Atrial Fibrillation, Ann Int Med, 2007:146:857-867
- (en) The ACTIVE Investigators, Effect of clopidogrel added to aspirin in patients with atrial fibrillation, N Engl J Med, 2009;360:2066-2078
- (en) Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation, N Eng J Med, 2009;361:1139-1151
- Mahaffey KW, Fox KAA, Rivaroxaban Once-daily oral direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation
- Granger BC, Alexander JH, McMurray J JV et al. for the ARISTOTLE Committees and Investigators, Apixaban versus Warfarin in patients with atrial fibrillation, N Engl J Med, 2011 (10.1056/NEJMoa1107039)
- (en) Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY, « A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey » Chest. 2010;138:1093-1100
- (en) Stoddard MF, Dawkins PR, Prince CR, Ammash NM, « Left atrial appendage thrombus is not uncommon in patients with acute atrial fibrillation and a recent embolic event: a transesophageal echocardiographic study » J Am Coll Cardiol, 1995;25:452–459
- (en) Reddy VY, Doshi SK, Sievert H et al. « Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-Year follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients With Atrial Fibrillation) trial » Circulation. 2013;127:720-729
- (en) Haissaguerre M, Jais P, Shah DC et als. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins, N Engl J Med, 1998;339:659-66
- (en) Pappone C, Augello G, Sala S et al. « A randomized trial of circumferential pulmonary vein ablation versus anti-arrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF study » J Am Coll Cardiol. 2006;48:2340-7
- (en) Cappato R, Calkins H, Chen SA et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation, Circulation, 2005;111:1100-5
- (en) Calkins H, Brugada J, Packer DL, Cappato R, Chen S, Crijns HJ, et al. HRS/EHRA/ECAS Expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation, Heart Rhythm, 2007;4:816-61
- (en) Calkins H, Further insight into the technique and outcomes of "curative" catheter ablation of atrial fibrillation, Circ Arrhythmia Electrophysiol, 2008;1:238-239
- (en) Natale A, Raviele A, Arentz T et al. Venice Chart international consensus document on atrial fibrillation ablation, J Cardiovasc Electrophysiol, 2007;18:560-80
- (en) Khan MN, Jaïs P, Cummings J et al. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure, New Eng J Med, 2008;359:1778-1785
- Portail de la médecine