Fièvre hémorragique virale
On désigne sous le terme de fièvres hémorragiques virales (FHV) un ensemble de maladies diverses, causées par des virus non apparentés.

| Spécialité | Infectiologie (en) |
|---|
| CIM-10 | A96-A99 |
|---|---|
| eMedicine | 830594 |
| MeSH | D006482 |
![]()
Elles sont la plupart du temps bénignes voire passent inaperçues, mais elles sont toutes potentiellement graves, avec pour certaines des taux de mortalité importants. Comme chez tous les virus, des variants différents (plus ou moins pathogènes ou virulents) peuvent coexister ou apparaître à la suite de la réponse immunitaire des hôtes infectés[1].
Certaines sont considérées comme maladies émergentes[2] ou émergentes potentielles, ou susceptibles d'être utilisées comme arme biologique[3] (avec risque qu'elles se retournent contre leurs utilisateurs).
Les « virus hémorragiques » les plus dangereux semblent compter parmi la famille des rhabdovirus, famille très variée encore incomplètement explorée[4] qui touche à la fois des animaux (dont poissons[5]) et des plantes[6].
Les virus impliqués sont tous des virus à ARN et appartiennent à diverses familles (Flaviviridae, Bunyaviridae, Filoviridae, Arenaviridae). Au plan épidémiologique, on distingue entre les virus transmis par les moustiques ou tiques (arboviroses), les virus à réservoir animal, les FHV à réservoir inconnu.
Distribution géographique
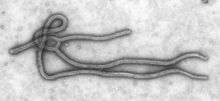
Elle est généralement bien délimitée, mais non circonscrites aux zones tropicales comme on le croit souvent. Les réservoirs des virus sont a priori toujours animaux, mais parfois ne sont pas identifiés.[réf. nécessaire] La transmission de l'animal-réservoir à l'homme se fait soit de façon indirecte, par un vecteur comme dans le moustique dans les arboviroses, soit directe par exposition aux produits biologiques de l'animal infectés par le virus, par exemple les déjections des rongeurs porteurs (Arenaviridae, Hantavirus, Filoviridae).[réf. nécessaire]
Détection
Elle se fait par les épidémiologistes, au vu des symptômes et des épidémies déclarées. La PCR a permis d'accélérer la reconnaissance et le suivi des souches connues ; dont pour le virus Ebola[7] ou de Durham[8].
Traitements
Sauf exception, il n'existe pas de traitement spécifique. La prévention repose sur les vaccins lorsqu'ils existent et sur des mesures d'hygiène et de sécurité. Les fièvres hémorragiques virales africaines les plus connues sont Ebola et Marburg.[réf. nécessaire]
Clinique
L'incubation est en moyenne de 3 à 7 jours, avec un extramum de 21 jours pour Ebola.La phase d'invasion est marquée par un syndrome pseudo-grippal. Une éruption maculeuse oriente vers une arbovirose (syndrome algo-éruptif). Une pharyngite, une hyperhémie conjonctivale, voire un œdème facial sont évocateurs.[réf. nécessaire]
À la phase d'état, le tableau peut se compliquer d'un syndrome hémorragique, pouvant mener à une défaillance multi-viscérale, rapidement mortelle. Ces hémorragies sont inconstantes : 1 % pour la fièvre de la vallée du Rift, 20 % à 80 % pour Ebola[réf. souhaitée].
Diagnostic
Même si le diagnostic de certitude est établi à partir d'un examen direct par culture ou indirect par examen sérologique, le diagnostic de présomption est une étape essentielle : séjour en zone d'endémie, exposition au risque, présentation clinique.[réf. nécessaire]
Classifications de l'OMS des virus à fièvres hémorragiques
| Famille | Genre | Virus | Maladie | Réservoir |
|---|---|---|---|---|
| Flaviviridae | Flavivirus | Amaril Dengue 1,2,3,4 | Fièvre jaune Dengue | |
| Bunyaviridae | Phlebovirus Nairovirus Hantavirus | Rift Congo-Crimée Hantaan Séoul Puumala Sin Nombre | Fièvre de la vallée du Rift Fièvre hémorragique Congo-Crimée Fièvre hémorragique à syndrome rénal Fièvre hémorragique à syndrome rénal Fièvre hémorragique à syndrome rénal Syndrome pulmonaire à Hantavirus | Apodemus Rattus rattus Clethrionomys Peromyscus |
| Arenaviridae | Arenavirus | Lassa Junin Machupo Guanarito Sabia | Fièvre hémorragique de Lassa Fièvre hémorragique d'Argentine Fièvre hémorragique de Bolivie Fièvre hémorragique vénézuélienne Fièvre hémorragique du Brésil | Mastomys Calomys Calomys Sigmodon alstoni et Zygodontomys brevicauda' |
| Filoviridae | Filovirus | Ebola Z,S,R,CI Marburg | maladie à virus Ebola Virus Marburg |
D'autres virus hémorragiques sont en cours d'étude, dont le virus Lujo[9].
Un nouveau virus de la famille des Rhabdoviridae dit virus du bassin du Congo (BASV) a été identifié à la suite de l'apparition en 2009 de trois cas humains de fièvre hémorragique particulièrement aigüe (village de Mangala, en RDC). Son origine est encore inconnue, mais son génome diffère fortement de celui des autres rhabdovirus connus et ses propriétés sont celles d'une source de maladie émergente potentielle. Le BASV évoque génétiquement plus le virus de la rage que le virus Ebola, le virus de Lassa et le virus Crimée-Congo.[réf. nécessaire]
Il pourrait être transmis d'un humain à l'autre via un arthropode vecteur et éventuellement, causer des épidémies en Afrique, car l'analyse des anticorps du seul patient survivant (sur 3 cas repérés) suggère une possible propagation interhumaine via un vecteur [10].
Notes et références
- Grard G, Biek R, Muyembe Tamfum JJ, Fair J, Wolfe N, et al. (2011) Emergence of divergent zaire ebola virus strains in democratic republic of the congo in 2007 and 2008. J Infect Dis 204 Suppl 3: S776–784. doi: 10.1093/infdis/jir364.
- Geisbert TW, Jahrling PB (2004) Exotic emerging viral diseases: progress and challenges. Nat Med 10: S110–121. doi: 10.1038/nm1142
- Borio L, Inglesby T, Peters CJ, Schmaljohn AL, Hughes JM, et al. (2002) Hemorrhagic fever viruses as biological weapons: medical and public health management. JAMA 287: 2391–2405. doi: 10.1001/jama.287.18.2391
- Kuzmin IV, Novella IS, Dietzgen RG, Padhi A, Rupprecht CE (2009) The rhabdoviruses: biodiversity, phylogenetics, and evolution. Infect Genet Evol 9: 541–553. doi: 10.1016/j.meegid.2009.02.005.
- Hoffmann B, Beer M, Schutze H, Mettenleiter TC (2005) Fish rhabdoviruses: molecular epidemiology and evolution. Curr Top Microbiol Immunol 292: 81–117.
- Fu ZF (2005) Genetic comparison of the rhabdoviruses from animals and plants. Curr Top Microbiol Immunol 292: 1–24.
- Towner JS, Rollin PE, Bausch DG, Sanchez A, Crary SM, et al. (2004) Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome. J Virol 78: 4330–4341. doi: 10.1128/JVI.78.8.4330-4341.2004
- Allison AB, Palacios G, Travassos da Rosa A, Popov VL, Lu L, et al. (2011) Characterization of Durham virus, a novel rhabdovirus that encodes both a C and SH protein. Virus Res 155: 112–122. doi: 10.1016/j.virusres.2010.09.007
- (en) Briese T, Paweska JT, McMullan LK, Hutchison SK, Street Cet al. « Genetic detection and characterization of Lujo virus, a new hemorrhagic fever-associated arenavirus from southern Africa » PLoS Pathog 2009;5:e1000455. DOI:10.1371/journal.ppat.1000455
- Grard G, Fair JN, Lee D, Slikas E, Steffen I, et al. (2012), A Novel Rhabdovirus Associated with Acute Hemorrhagic Fever in Central Africa ; PLoS Pathogens doi:10.1371/journal.ppat.1002924 September 27, 2012
Annexes
Articles connexes
- Peste porcine africaine (fièvre hémorragique virale animale)
- Virus
- Fièvre
- Épidémiologie, écoépidémiologie,
- Zoonoses
Bibliographie
- Bray M (2005) Pathogenesis of viral hemorrhagic fever. Curr Opin Immunol 17: 399–403. doi: 10.1016/j.coi.2005.05.001.
- Carrion R, Patterson JL (2011) Vaccines against viral hemorrhagic fevers: non-human primate models. Hum Vaccin 7: 667–673. doi: 10.4161/hv.7.6.14981.
- Warrell MJ, Warrell DA (2004) Rabies and other lyssavirus diseases. Lancet 363: 959–969
- Rodriguez LL (2002) Emergence and re-emergence of vesicular stomatitis in the United States. Virus Res 85: 211–219. doi: 10.1016/S0168-1702(02)00026-6
- Gubala AJ, Proll DF, Barnard RT, Cowled CJ, Crameri SG, et al. (2008) Genomic characterisation of Wongabel virus reveals novel genes within the Rhabdoviridae. Virology 376: 13–23. doi: 10.1016/j.virol.2008.03.004.
- Fu ZF (2005) The world of rhabdoviruses. Berlin; New York: Springer. vi, 208 p.
- Brooks JT, Shapiro RL, Kumar L, Wells JG, Phillips-Howard PA, et al. (2003) Epidemiology of sporadic bloody diarrhea in rural Western Kenya. Am J Trop Med Hyg 68: 671–677
Liens externes
- Rubrique sur les fièvres virales hémorragiques du site de l'Organisation Mondiale de la Santé (OMS).
- Sélections de sources francophones sur les fièvres hémorragiques virales validées par CISMef
- Fièvres virales transmises par des arthropodes et fièvres virales hémorragiques(A90-A99) de la Classification de l'OMS (CIM-10).
- Portail de la médecine
- Portail de la virologie