Fièvre boutonneuse méditerranéenne
La fièvre boutonneuse méditerranéenne (FBM) fait partie des maladies vectorielles à tiques. C'est l'infection par une bactérie de la famille des rickettsies : Rickettsia conorii et transmise par la tique du chien Rhipicephalus sanguineus.
| Spécialité | Infectiologie (en) |
|---|
| CIM-10 | A77.1 |
|---|---|
| CIM-9 | 082.1 |
| DiseasesDB | 31780 |
| MeSH | D001907 |
![]()
Connue sous d'autres noms (voir l'historique), elle est présente en France, sur le littoral méditerranéen, où elle sévit surtout en été. Mais le tourisme et les transports modernes font que des cas peuvent survenir ailleurs (retours de voyage). Elle serait en extension géographique, et de gravité croissante. Elle est considérée comme une maladie émergente ou plutôt reémergente[1].
Historique
En 1910, Conor et Brüch décrivent sous le nom de « fièvre boutonneuse » une maladie éruptive bénigne qu'ils observaient à Tunis depuis quelques années, et qu'ils tenaient comme une curiosité de la région. Dans les années qui suivent, les descriptions analogues se multiplient sur le littoral méditerranéen, chaque auteur croyant avoir affaire à une nouveauté locale. Les descriptions les plus complètes étant celle des auteurs Marseillais.
D'où des dizaines d'appellations telles que : fièvre arthro-myalgique, fièvre exanthématique d'été, fièvre escarro-nodulaire, fièvre de Marseille ou d'Olmer, typhus endémique d'été, typhus bénin, typhus des vendanges, fièvre typho-exanthématique, maladie de Carducci, etc.
En 1925, Pieri décrit la tâche noire ou escarre d'inoculation, caractéristique de la maladie. En 1927, Olmer montre les analogies entre cette maladie, la fièvre pourprée des Montagnes Rocheuses, et la fièvre fluviatile du Japon. Durand et Conseil (1930) démontrent la transmission par la tique du chien. Brumpt (1932) découvre l'agent causal : une rickettsie qu'il appellera en l'honneur de Connor : Rickettsia conorii.
En 1933, lors d'un congrès international tenu à Marseille, sous l'autorité de Charles Nicolle, il fut reconnu qu'il s'agissait bien d'une même maladie désormais appelée « fièvre boutonneuse méditerranéenne »[2].
Il a été convenu de supprimer toute référence géographique et patronymique locale, pour ne garder que le terme général « méditerranéen ». Il n'y pas eu d'accord pour caractériser l'éruption de nature polymorphe (fièvre exanthématique ? fièvre escarro-nodulaire ?). On a donc gardé la première description, celle de Conor en 1910 : « Ce ne sont ni des macules, ni des papules, ni des nodosités, encore moins des vésicules. Ce sont des boutons...».
Le terme « bouton » n'a aucun sens précis en dermatologie, ni en anatomie pathologique. La description de Conor était imprécise mais de valeur consensuelle[2].
Répartition géographique
Maladie présente sur le pourtour méditerranéen, en Afrique (fièvre à tiques du Kenya) et en Asie, de la Turquie à la Birmanie. On la suspecte, à partir de la Mer Noire, de s'établir vers l'Europe de l'Est.
C'est une maladie saisonnière surtout estivale (entre avril et octobre, la période d'activité des tiques dépendant de conditions climatiques). Dans une même région, elle se manifeste par petits foyers localisés regroupant quelques cas. Dans les régions endémiques, son incidence est d'environ 50 cas pour cent mille habitants et par an.
Sur une grande échelle de temps (décennies), elle présente des phases de disparition et de réapparition. Par exemple en Bulgarie (quasi-disparition dans les années 1970), en France (forte recrudescence dans les années 1980), en Algérie (ré-apparition à la fin des années 1990)[1].
Contamination
L'infection est transmise à l'homme par la tique brune du chien ou Rhipicephalus sanguineus. Cette tique a peu d'affinité pour l'homme, la probabilité d'être piqué est de moins de 10%, mais la tique est plus agressive quand la température augmente. Dans le sud de la France, ces tiques sont actives entre mai et octobre, et la plupart des cas humains sont diagnostiqués en juillet et août[3].
La piqure infectante n'est pas le fait de la forme adulte, mais des formes immatures (larve, nymphe). Leur piqûre est le plus souvent indolore, passant inaperçue, d'autant plus que les tiques immatures sont à la limite de la visibilité[4]. La tique doit rester de 10 à 20 h sur la peau pour être contaminante.
Le chien ne constitue pas un hôte-réservoir de la bactérie causale, celle-ci étant incapable de se multiplier chez le chien (donnant tout au plus une fièvre transitoire chez l'animal). Ce dernier n'est qu'un moyen de transport apportant la tique à l'homme. Les tiques constituent en elles-mêmes un réservoir par transmission ovarienne (les femelles transmettent l'infection à leurs œufs).
Le réservoir d'origine probable est celui des lapins sauvages. En France, le nombre de cas a chuté lors de l'élimination des lapins par la myxomatose (1952), puis repris en 1967 avec la réapparition du lapin sauvage. Toutefois d'autres réservoirs sont possibles comme le hérisson ou des petits rongeurs. La bactérie causale Rickettsia conorii étant absente du continent américain, le réservoir originel doit être probablement un petit mammifère strictement européen qui reste à déterminer[1].
En zone endémique, en période estivale, les activités à risques sont la proximité d'un chien, la promenade (bras ou jambes nus) dans des lieux herbacés ou embroussaillés. La FBM est une maladie professionnelle indemnisable pour les éleveurs, les employés de chenil, les travailleurs forestiers, etc.
Symptômes
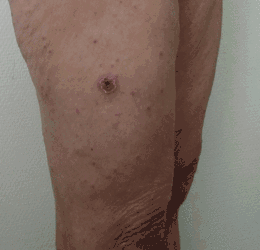
L'incubation dure en moyenne une semaine (3-16 jours). Le début est brutal avec un syndrome grippal associant fièvre à 39 °C, céphalées intenses et photophobie ainsi que des douleurs musculaires et articulaires. Dans plus de la moitié des cas, on retrouve le point de morsure de la tique : la tache noire (escarre d'inoculation).
C'est une lésion indolore, noirâtre et croûteuse, de 3 à 5 mm centrée sur un halo inflammatoire de 2 à 3 cm de diamètre, parfois accompagnée d’une adénopathie. Elle persiste une semaine, puis cicatrise. L'inoculation par voie oculaire s'accompagne de conjonctivites.
L'éruption débute par un exanthème qui apparaît entre deux et quatre jours au niveau du tronc et évolue par poussées vers les membres, d’abord maculeuse (plane) puis papuleuse (légèrement surélevée au toucher), finissant par donner l'aspect boutonneux. Elle épargne généralement le visage, mais atteint la paume des mains et la plante des pieds.
Elle peut s'accompagner de pétéchies (hémorragies cutanées punctiformes). Dans les cas graves, elles peuvent confluer jusqu'au purpura extensif.
L'évolution est bénigne dans la plupart des cas, mais des complications viscérales sont possibles : digestives, neurologiques, cardio-vasculaires et pulmonaires. Ces formes sévères représentent 5 à 6 % des cas. Elles sont associées à des facteurs de risques : alcoolisme, diabète, déficit en G6PD, âge avancé, retard de traitement ou antibiothérapie non adaptée[3].
Depuis les années 1980, il semble que les formes graves (multi-viscérales), ainsi que les formes à escarres multiples, soient en augmentation. Cela reflèterai un changement de comportement de la tique du chien, et/ou une plus grande virulence de sous-espèces de Rickettsia conori[1].
Diagnostic
Le diagnostic est évoqué devant une « grippe d'été » survenant en région endémique (ou en provenant par retour de séjour), la présence d'un chien dans l'entourage, l'éruption différée, et la tache noire caractéristique,
Le diagnostic est affirmé par des techniques sérologiques, soit le classique test de Weil-Felix (agglutination des protéines de bœuf), soit le test ELISA ou encore la méthode par immunofluorescence ; soit par visualisation direct des rickettsies sur biopsie d'escarre d'inoculation.
La détection moléculaire des rickettsies par PCR est possible, selon la disponibilité du plateau technique.
Traitement
Il repose sur un traitement antibiotique (tétracyclines, macrolides) pendant une semaine ou jusqu'à deux jours après la chute de la fièvre. La létalité des patients hospitalisés est de 2,5 %, mais elle est de 50 % dans les formes graves multiviscérales. Au début du XXIe siècle, on considère que la FBM a une fausse réputation de bénignité[3].
Notes et références
- (en) C. Rovery, P. Brouqui et D. Raoult, « Questions on Mediterranean Spotted Fever a century after its discovery », Emerging Infectious Diseases, vol. 14, no 9,
- G. Lemaire, « Fièvre boutonneuse et pseudotyphus », Encyclopédie Médico-Chirurgicale, no 8104, , p. 1-3.
- P. Parola, CMIT, Rickettsioses, Alinéa Plus, (ISBN 978-2-916641-66-9), p. 370.dans E. PILLY, 2018, 26e dition.
- P-E Fournier, « Rickettsioses éruptives », La revue du praticien-médecine générale, no 336, , p.23-28
Voir aussi
Bibliographie
- David Olmer, Jean Olmer, La fièvre exanthématique (Typhus endémique d'été), Maloine, 1928, 89 pages.
Articles connexes
- Fièvre pourprée des montagnes rocheuses Il s’agit d’une rickettsiose due à Rickettsia rickettsii transmise par les tiques et qui sévit sur le continent Américain.
- Rickettsia
- Maladies à tiques
- Tiques
Liens externes
- page consacrée à la FBM, sur le site Maladies à tiques
- Mediterranean Spotted Fever Clinical Resources
- Fièvre boutonneuse méditerranéenne en France (Bulletin épidémiologique de 1988)(fr)
- Portail de la médecine
- Portail des maladies infectieuses