Embryogenèse humaine
L'embryogenèse humaine (ou embryogénie) désigne le processus de développement de l'embryon humain depuis la fécondation jusqu'à la quatrième semaine de développement. Ensuite de la quatrième à la dixième semaine de développement on parle de l'organogénèse.

On parle d'embryon de la fécondation à la dixième semaine de développement, après on parlera de fœtus jusqu'à la naissance.
Étapes
Fécondation
Le zygote ou œuf naît de l'union d'un gamète femelle (un ovocyte), et d'un gamète mâle, (un spermatozoïde). Les gamètes sont produits par la méiose des cellules germinales. Le gamète mâle est donc haploïde : il ne contient qu'un des deux chromosomes de chaque paire de chromosomes homologues de la cellule germinale qui l'a généré ; le gamète femelle est lui aussi haploïde, cependant il termine sa méiose uniquement s'il y a fécondation : l'ovocyte devient seulement alors un ovule à proprement parler, apte à la réunion des génomes.
Le spermatozoïde se lie aux glycoprotéines de la zone pellucide entourant l'ovocyte. Il se lie d'abord à ZP3, ce qui déclenche la réaction acrosomique : la membrane plasmique du spermatozoïde fusionne avec la membrane externe de l'acrosome en commençant par la partie antérieure et en se poursuivant logiquement selon un gradient antéro-postérieur, en laissant une zone équatoriale au niveau de laquelle subsistent les trois feuillets (les membranes externe et interne de l'acrosome ainsi que la membrane plasmique). L'ouverture du sac acrosomique sur l'extérieur donne lieu à la libération d'enzymes, parmi lesquelles on pourra citer l'acrosine et la hyaluronidase. Ces deux enzymes permettent de séparer les glycoprotéines ZP1 de ZP2 et ZP3 et sont indispensables à la progression du spermatozoïde jusqu'à l'ovocyte. Tous les spermatozoïdes de la zone pellucide ont fait leur réaction acrosomique. ZP2 est la deuxième glycoprotéine à laquelle se lie le spermatozoïde et facilite également son trajet.
Le spermatozoïde aborde la zone microvillaire de l'ovocyte (la zone amicrovillaire étant réservée à l'expulsion du deuxième globule polaire, contenant le matériel génétique excédentaire), la fusion des deux cellules entraîne une onde calcique, qui a pour conséquence l'extrusion de granules corticaux, chargés de lysosomes, transformant les glycoprotéines ZP2 en ZP2F, incapables de se lier au spermatozoïde. Ce mécanisme permet le blocage à la polyspermie, c'est-à-dire l'assurance qu'un seul spermatozoïde fécondera l'ovule.
La fusion des gamètes haploïdes implique la réunion des deux pronuclei (noyaux haploïdes) mâle et femelle. La phase de rapprochement de ces deux pronuclei et leur fusion correspond respectivement à la syngamie et à l'amphimixie. Le terme « ovule » ne peut être employé à la place du terme « ovocyte » que lorsqu'il contient les deux pronuclei en voie de réunion.
Les chromatides homologues du mâle et de la femelle s'unissent dans le zygote[alpha 1]. Celui-ci et sa descendance contiennent donc des chromosomes « mixtes », ce qui assure la diversité et l'unicité de l'individu. Le zygote contient toutes les informations nécessaires pour se transformer en organisme vivant, par un processus complexe de segmentation et de différenciation cellulaire.
Segmentation : de l'œuf à la morula

L'œuf fécondé va subir une série de divisions cellulaires au cours de sa migration dans la trompe utérine et l'utérus. Ce processus porte le nom de segmentation, ou clivage. Cette segmentation est totale, asynchrone et asymétrique (les deux cellules-filles engendrées peuvent ne pas porter la même quantité de matériel cytoplasmique, à l'origine d'une différence de taille notable). Elle divise le zygote, par plusieurs mitoses classiques successives, d'abord en 2 cellules filles, puis en 4 (le plus gros blastomère se divise en premier), puis 8 et 16 et ainsi de suite pour rapidement aboutir à une masse cellulaire portant le nom de morula (à l'aspect de petite mûre, comme l'indique son nom). Le second terme "clivage" est parfaitement évocateur puisque l'œuf fécondé n'augmente pas de taille ou de volume au cours de ces premières divisions successives. Les premières divisions cellulaires, jusqu'au stade 4 à 8 cellules, ne s'accompagnent pas de différences morphologiques importantes entre les cellules filles.

La chronologie admise est en général la suivante : 2 blastomères apparaissent rapidement après la fécondation au premier jour du développement, 4 blastomères au deuxième jour du développement, 8 blastomères au troisième jour du développement, 16 blastomères (morula) au quatrième jour du développement. Au cinquième jour, l'embryon a généralement gagné la partie supérieure de l'utérus, où il devra s'apposer, puis s'implanter (phénomène de nidation ou ovoimplantation).
À partir du stade 8 à 16 cellules, le phénomène de compaction initie les premiers événements de la différenciation embryonnaire en générant une nouvelle répartition des cellules dans la morula :
- Les cellules périphériques vont subir un phénomène de polarisation et se répartissent en une couche nommée trophoblaste primitif qui entoure toute la surface de l'œuf fécondé.
- Les cellules plus internes et initialement non polarisées se regroupent pour constituer la masse de l'embryoblaste, ou masse cellulaire interne.
À la fin du quatrième jour après la fécondation, le phénomène de cavitation provoque le creusement de la morula par apparition d'une cavité à contenu liquidien : le futur blastocèle.
Blastulation
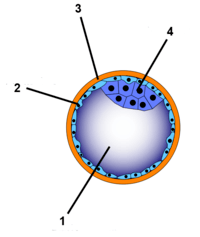
Dans l'espèce humaine, le zygote (ou œuf) est de type alécithe (ou métalecithe : le placenta remplace le vitellus) : le vitellus, en petite quantité, y est dispersé uniformément dans tout le cytoplasme (consultez l'article sur le zygote pour plus de détails).
Au premier stade de la blastulation, le zygote se divise en blastomères par mitose. Comme pour tous les zygotes alécithes, le processus est de type holoblastique et radiaire. La première division se fait selon un plan méridional passant par les pôles du zygote. Ensuite, un des deux blastomères résultants se divise également selon un plan méridional. L'autre blastomère, par contre, se divise selon un plan équatorial. Au fur et à mesure des divisions successives les cellules, restant agglutinées, forment la blastula. Les cellules externes de celle-ci forment le trophoblaste qui constituera la couche superficielle du placenta. Les cellules internes s'agglutinent à un pôle de la morula et forment la masse cellulaire interne ainsi qu'une cavité, le blastocèle.
À ce stade, la morula est devenue blastula ou blastocyste.
Nidation
L'implantation de l'œuf dans l'endomètre se fait par les cellules du trophoblaste (partie interne de la zone pellucide désormais éclose), en regard du bouton embryonnaire. L'œuf s'implante dans le fond utérin, durant une fenêtre d'implantation comprise entre le 6e et le 10e jour de développement (20e-24e jour d'aménorrhée).
Les cellules trophoblastiques sécrètent un fluide qui va pousser l'amas cellulaire dans un segment de la sphère. Le syncytiotrophoblaste est ainsi sécrété, il est chargé en lysosomes et s'étale de plus en plus dans l'endomètre grâce à sa fonction métalloprotéasique.
Le chorion est la structure composite entourant l'œuf et composé de trois couches : le mésenchyme extra embryonnaire, le cytotrophoblaste et enfin le syncytiotrophoblaste décrit au-dessus, de l'intérieur vers la périphérie. Provenant de la cavitation, il permet de recevoir l'oxygène de la mère à partir du douzième jour, avec l'apparition des chambres sanguines maternelles. La circulation sanguine (histotrophique jusqu'au 21e jour) se fait par l'intermédiaire des villosités choriales qui resteront primaires jusqu'au 14e jour. Le chorion sécrète des hormones qui ordonnent à l'utérus d'accueillir le fœtus. Certaines substances contrôlent la réponse immunitaire maternelle pour qu'il n'y ait pas de rejet de l'embryon (comme c'est le cas d'un organe greffé).
Gastrulation



Introduction
Le processus de gastrulation met en place les structures cellulaires qui génèrent l'embryon et en soutiennent le développement.
À cette fin, les cellules du blastocyste se différencient, se déplacent et se réarrangent pour former :
- les tissus embryonnaires (les feuillets germinaux) ;
- les tissus extraembryonnaires (les structures de soutien).
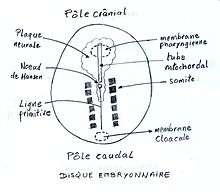
Dans l'espèce humaine, la gastrulation est du type «immigration». Un disque embryonnaire se forme au niveau du bouton embryonnaire. Les cellules individuelles migrent au travers du disque avec différenciation concomitante en ecto-, endo- et mésoderme. Ce processus est commun à tous les mammifères, ainsi qu'à leurs ancêtres les reptiles et aux oiseaux.
Embryon et fonctions nourricières
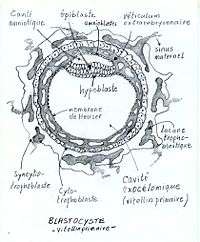
Au pôle apical du blastocyste se forme un amas de cellules internes que l'on appelle « embryoblaste », « bouton embryonnaire » ou « masse cellulaire interne » (MCI). C'est là que commence la genèse de l'embryon. La fonction nourricière des cellules périphériques du blastocyste se précise. Elles constituent le trophoblaste qui se scindera en syncytiotrophoblaste (cytoplasme multicellulaire) à l'extérieur, et en cytotrophoblaste à l'intérieur.
L'embryoblaste se scinde en endoblaste (hypoblaste) et en ectoblaste (épiblaste). Entre celui-ci et le cytotrophoblaste se creuse la cavité amniotique. [L'épiblaste et l'hypoblaste forment ensemble le disque embryonnaire didermique]. Des cellules de l'épiblaste se différencient en amnioblastes et recouvrent la paroi intérieure de la cavité amniotique. Dans le syncytiotrophoblaste s'ouvrent des vacuoles qui se raccordent entre elles pour former des capillaires qui s'étendent dans les tissus utérins pour constituer les sinus maternels. Les vacuoles forment des lacunes qui se remplissent de sang. Ces vaisseaux sont à la base de la circulation utéro-placentaire.
Première prolifération et migration (à J-8) de cellules en provenance de l'hypoblaste le long de la paroi interne du cytotrophoblaste pour y former une fine membrane (endoderme extraembryonnaire, appelé aussi « membrane de Heuser (en) ») qui transforme le blastocèle en lécithocèle primaire (à J-9).
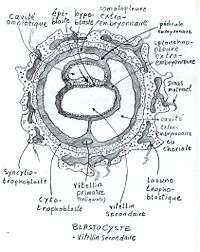
Apparition du mésoderme et croissance de l'amnios
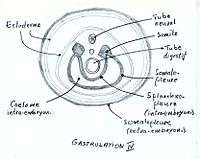
Le réticulum extraembryonnaire (un tissu acellulaire très lache, pouvant également être désigné sous le nom de "mésenchyme extra-embryonnaire") apparaît entre la membrane de Heuser et le cytotrophoblaste après la formation du sac vittelin primaire. Il s'y ouvre des vacuoles qui fusionnent en formant le cœlome extraembryonnaire qui se remplit de liquide. On suppose que le réticulum est généré par la membrane. Des cellules mésodermiques, qui seraient des cellules épiblastiques différenciées en provenance de la partie caudale du disque embryonnaire, migrent au travers du réticulum et en se fixant recouvrent les parois de la cavité extraembryonnaire. Ce mésoderme extraembryonnaire s'appelle somatopleure au niveau du cytotrophoblaste, de la cavité amniotique et du pédicule embryonnaire et splanchnopleure au niveau de l'endoderme extraembryonnaire des sacs vitellins primaires et secondaires.
Une nouvelle migration de cellules endodermiques extraembryonnaires repousse les cellules de la précédente en migrant le long de la paroi du sac vitellin primaire, puis en dedans. Le sac vitellin primaire, en se rétractant sous la poussée de la cavité extraembryonnaire, se clive en un sac vitellin primaire et un reliquat qui involuera rapidement: le kyste exocœlomique. Les deux vésicules nouvellement formées sont recouvertes en dehors par le splanchnopleure. La cavité extraembryonnaire se résorbe sous l'effet de la croissance de la cavité amniotique. Le liquide cœlomique se perd et les somatopleures extraembryonnaires de l'amnios et de la cavité extraembryonnaire fusionnent.
Embryon tridermique
Des cellules de l'épiblaste convergent vers l'axe longitudinal dorsal du disque embryonnaire et y forment un bourrelet appelé « ligne primitive ». À partir de celle-ci, les cellules épiblastiques s'enfoncent et se dispersent dans le disque, transformant le bourrelet en sillon. Les cellules épiblastiques connaissent un triple destin :
- Certaines vont s'insérer entre les cellules de l'hypoblaste en formant l'endoderme embryonnaire définitif.
- D'autres s'arrêtent entre l'épiblaste et l'hypoblaste et se différencient en mésoderme embryonnaire définitif.
- Celles qui sont restées dans l'épiblaste deviennent l'ectoderme embryonnaire définitif.
À ce stade-ci, l'embryon est tridermique. Il comprend un ectoderme, un endoderme et un mésoderme, tous trois formés à partir de l'épiblaste.
Structuration du disque embryonnaire
L'apparition de la ligne primitive définit non seulement la symétrie bilatérale du disque, mais également l'orientation caudo-crâniale de son axe. Le « nœud de Hensen », une dépression située vers le milieu de l'axe, termine la ligne primitive.
À l'extrémité caudale du disque embryonnaire, une zone de l'ectoderme est restée collée à l'endoderme: c'est la membrane cloacale, l'homologue du blastopore des gastrulas invaginées. De la même façon, une membrane appelée pharyngienne (ou bucco-pharyngienne) se forme vers l'extrémité crâniale : sa rupture mettra la bouche primitive en contact avec le pharynx, laissant un canal transitoire où s'engouffre le liquide amniotique : le stomodeum.
Neurulation
Au départ du processus de neurulation il y a la mise en place de la chorde. Celle-ci commence par une prolifération de cellules mésodermiques à hauteur du nœud de Hensen. Ensuite, les cellules migrent vers le pôle crânial et forment un tube, le processus (ou tube) notochordal, dans l'axe du disque, entre l'ectoderme et l'endoderme. Dans un premier temps, le tube notochordal fusionne avec l'endoderme formant ainsi la plaque chordale. Plus tard, il se sépare de l'endoderme et devient ainsi un rouleau plein : la chorde proprement dite. On notera également durant ce processus la présence durant quelques heures (entre les 18e et 19e jour) du canal neuro-entérique, seule communication (transitoire) entre la cavité amniotique et le sac vitellin secondaire. La formation de ce canal, nécessaire à la formation de la chorde, dans des temps autres que ceux indiqués ci-dessus aboutit à des pathologies graves, souvent létales.
La présence de la chorde induit la formation de la plaque neurale à partir de l'ectoderme sus-jacent. Celle-ci se développe en largeur au niveau du pôle crânial et y produira le cerveau. Vers le pôle caudal, elle prend la forme d'une gouttière dont les bords, en se refermant, sont à l'origine de la moelle épinière.
En résumé :
- formation du prosencéphale, du mésencéphale et du rhombencéphale ;
- invagination complète de la gouttière neurale et isolement du tube neural ;
- extension du tube neural en direction des pôles du disque ;
- apparition des crêtes neurales dont les cellules migratoires vont former de nombreux tissus de l'organisme.
Métamérisation
Entre-temps, le mésoderme intra-embryonnaire se différencie. Le mésoderme para-axial, situé de part et d'autre de la chorde, se compacte en formant 42 à 44 paires de somites, à commencer par le pôle crânial. Pendant le processus d'individualisation (la métamérisation), ceux-ci restent reliés au mésoderme par la lame intermédiaire. La lame latérale se sépare en deux feuillets : la somatopleure qui recouvre l'ectoderme et la splanchnopleure qui recouvre l'endoderme.
C'est à partir des somites que se constituent :
- le sclérotome qui est à l'origine de la formation des vertèbres et le mésenchyme formateur des disques intervertébraux ;
- les dermatomes qui vont constituer des zones cutanées innervées par la racine médullaire correspondant au somite d'origine ;
- les myotomes qui produisent les muscles.
Le système artério-veineux se met en place, permettant les premiers échanges entre l'embryon et la mère, avec :
- une circulation extra-embryonnaire au niveau des villosités trophoblastiques ;
- une circulation intra-embryonnaire primitive.
Délimitation de l'embryon
C'est l'isolement de l'embryon et de ses annexes. La délimitation et la forme du corps de l'embryon sont induites par une croissance différentielle entre l'amnios et le sac vitellin. Celui-ci ne se développant pratiquement plus, l'amnios le déborde de tous les côtés.
Latéralement, l'amnios recouvre le disque embryonnaire: le tube neural, la chorde, le mésoderme intraembryonnaire et une partie du vitellin qui deviendra l'intestin primitif. Les bords des différents feuillets se rejoignant à la base du disque (formant l'anneau ombilical), ceux-ci fusionnent et ferment le corps de l'embryon qui devient tridimensionnel. Toutefois, un canal subsiste provisoirement entre l'intestin primitif et le sac vitellin : le canal vitellin, qui deviendra le canal omphalo-mésentérique. Longitudinalement, l'embryon adopte une forme convexe. Les membranes subissent une rotation d'environ 180°. Le mésoblaste cardiogénique, initialement en avant de la membrane pharyngienne, passe en position ventrale.
La structure générale étant mise en place, les différents organes peuvent se développer : c'est le début de l'organogénèse.
Notes et références
Notes
- En outre, les gènes du mâle et de la femelle peuvent se croiser (ce qu'on appelle l'enjambement ou crossing-over) en passant d'une chromatide à l'autre pour assurer un brassage génétique optimal de la génération suivante.
Références
Voir aussi
Articles connexes
- Embryogenèse
- Embryologie
- Morphogenèse
- Physiologie
- Anatomie
- Neurogenèse
Liens externes
- Site du Pr. Ballas, professeur d'embryologie
- Cours d'embryologie en ligne développé par les Universités de Fribourg, Lausanne et Berne sous l'égide du Campus Virtuel Suisse
- Embryologie humaine en animation Campus d'embryologie médicale sous la responsabilité du Collège des Enseignants
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine
- Portail de la sociologie
- Portail de la psychologie