Embolie pulmonaire
On parle d’embolie pulmonaire lorsqu'un caillot, aussi appelé thrombus, circulant dans le sang va obstruer l'artère pulmonaire. C’est l'une des deux manifestations, avec la thrombose veineuse profonde, de la maladie thrombo-embolique.
| Spécialité | Cardiologie, hématologie et pneumologie |
|---|
| CISP-2 | K93 |
|---|---|
| CIM-10 | I26 |
| CIM-9 | 415.1 |
| DiseasesDB | 10956 |
| MedlinePlus | 000132 |
| eMedicine | 300901 et 361131 |
| eMedicine | med/1958 |
| MeSH | D011655 |
![]()
Historique
La première description en a été faite par Virchow en 1859[1].
Les premières angiographies pulmonaires, ainsi que les premières scintigraphies, datent des années 1960. L'échographie-Doppler veineuse se développe à partir des années 1990. La fin de ces mêmes années voit se diffuser l'utilisation du dosage sanguin des D-dimères. L'utilisation large du scanner thoracique entraîne l'abandon de l'angiographie pulmonaire durant les années 1990.
Épidémiologie
Aux États-Unis, son incidence annuelle est de l'ordre de 70 pour 100 000 personnes[2]. En France elle est d'environ 60/100 000 personnes-années[3].
Causes
L'embolie pulmonaire est essentiellement secondaire à la migration d'un caillot sanguin formé au niveau du réseau veineux des membres inférieurs (phlébite). La formation de ce caillot est favorisée par plusieurs facteurs :
- une stase prolongée telle qu'elle peut se voir en cas d'alitement de plusieurs jours, quelle que soit la cause : maladie, intervention chirurgicale… Un voyage assis pendant plusieurs heures peut être suffisant : « syndrome des longs courriers » ;
- un bas débit tel qu'une insuffisance cardiaque ;
- une maladie susceptible d'entraîner une « hypercoagulabilité » acquise telle qu'un cancer ou une maladie auto-immune[4] ;
- l'association « pilule-tabac » ;
- la présence d'une thrombophilie congénitale (anomalie de la coagulation entraînant un état d'« hypercoagulabilité ») ;
- après un accouchement, le risque est maximum durant les six premières semaines[5].
Malgré une recherche extensive, il est possible qu'aucune cause ne soit trouvée.
Diagnostic
Clinique
Le tableau classique de l'embolie pulmonaire comporte un essoufflement (dyspnée), une douleur thoracique, une tachycardie, parfois le patient peut cracher du sang (hémoptysie).
L'examen clinique montre une augmentation de la fréquence respiratoire (tachypnée), un pouls rapide (tachycardie). Il n’y a pas de signe d’insuffisance cardiaque gauche (auscultation pulmonaire normale). Si l’embolie pulmonaire est importante, on peut voir des signes d’insuffisance cardiaque droite (veine jugulaire dilatée = turgescence jugulaire, douleur au niveau du foie = hépatalgie, reflux hépato-jugulaire…).
- Scores de prédictions cliniques
| score de WellsEP [6] | |
| symptômes d'une thrombose veineuse profonde | 3 points |
| autres diagnostics envisagés[7] moins probables que celui d'embolie pulmonaire |
3 points |
| fréquence cardiaque >100/min |
1,5 point |
| immobilisation ou chirurgie dans les quatre dernières semaines |
1,5 point |
| antécédent thrombo-embolique | 1,5 point |
| hémoptysie | 1 point |
| Cancer (dans les six derniers mois) | 1 point |
En présence d'une dyspnée ou d'une douleur thoracique, le score de WellsEP (Score de Wells pour les embolies pulmonaires) permet d'évaluer la probabilité clinique d'une embolie pulmonaire[6] :
- score inférieur à 2 = probabilité faible < 5 %
- score intermédiaire (2 à 6) = probabilité de 20 à 30 %
- score supérieur à 6 = probabilité forte > 60 %
C'est Philip S. Wells qui a établi ces critères.
D'autres scores, basés sur le même principe, ont été développés. Le plus notable est celui de Genève[8] qui comprend huit variables : âge supérieur à 65 ans (1 point), antécédent de TVP ou EP (3 points), chirurgie ou fracture récente < 1 mois (2 points), cancer évolutif (2 points), douleur à une jambe (3 points), hémoptysie (2 points), rythme cardiaque de 75 à 94 battements/min (3 points) ou ≥ 95 battements/min (5 points), et douleur à la palpation des veines profondes et œdème unilatéral d'une jambe (4 points).
- score 0 à 3 = probabilité faible < 8 %
- score intermédiaire (4 à 10) = probabilité de 28 %
- score supérieur ou égal à 11 = probabilité forte de 74 %.
- Adage
En fait, une embolie pulmonaire peut se présenter sous des tableaux extrêmement divers : fièvre au long cours, douleurs atypiques, malaise ou syncope, état de choc, voire être totalement silencieux. Un adage classique en médecine dit « on ne comprend rien au tableau du patient : c’est une embolie pulmonaire jusqu’à la preuve du contraire ». De même, il y a souvent une mauvaise corrélation entre l’importance de l’embolie et le tableau clinique, mais une mauvaise tolérance (chute tensionnelle, signe d’insuffisance cardiaque droite, dyspnée importante) est fortement en faveur d'une embolie pulmonaire massive.
ECG
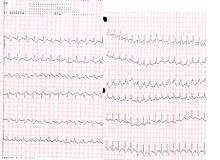
L'ECG n’est pas spécifique et les modifications sont très inconstantes. L'ECG d'un « cœur pulmonaire aigu », dont l'EP est l'étiologie principale, traduit une surcharge brutale du travail systolique du ventricule droit due à une augmentation souvent brutale de la postcharge du ventricule droit en rapport avec une occlusion artérielle pulmonaire[réf. nécessaire].
On peut retrouver certaines anomalies, de survenue précoce et réversibles. Cinq anomalies principales évoquent le diagnostic de cœur pulmonaire aigu[9] :
- apparition d'une fibrillation auriculaire rapide. Tachycardie sinusale, retrouvée dans environ 25 % des EP ;
- aspect S1Q3, retrouvé dans environ 50 % des cas et non spécifique. Défini par une grande onde S en DI et une grande onde Q en DIII ;
- bloc de branche droit incomplet, fréquent mais fugace. Défini par une durée du QRS > 0.08 s et < 0.12 s et par un retard à l'inscription de la déflexion intrinsécoïde en V1 > 0.04 s. Les QRS ont un aspect RSR' en V1 ;
- déplacement vers la gauche de la zone de transition des QRS, retrouvée dans environ 50 % des cas ;
- troubles de repolarisation, retrouvé dans environ 70 % des cas et persistant plusieurs jours, avec inversion des ondes T dans le territoire antérieur (V1 à V3) avec des ondes T pointues et symétriques, évocatrices d'ischémie.
- Signes électrocardiographiques évocateurs d'un cœur droit aigu[9]
- Fibrillation auriculaire rapide.
- Aspect S1Q3
- Bloc de branche droit incomplet
- Déplacement vers la gauche de la zone de transition
- Inversion des ondes T en antérieur
Biologie
Elle est identique à celle de la thrombose veineuse profonde (D-dimères, hémostase (bilan de la coagulation), recherche d'une anomalie constitutionnelle si besoin). En particulier, L'embolie pulmonaire se caractérise par un taux élevé de D-Dimère, un taux normal ou bas permet d'exclure le diagnostic la plupart du temps[10], sauf si le diagnostic d'embolie pulmonaire est considéré d'emblée comme hautement probable[11].
La gazométrie artérielle montre une diminution du contenu en oxygène du sang (hypoxémie) et une diminution du contenu en gaz carbonique du sang (hypocapnie). Si ces paramètres sont très perturbés, cela est en faveur d’une embolie pulmonaire importante.
Imagerie médicale
Elle a deux buts :
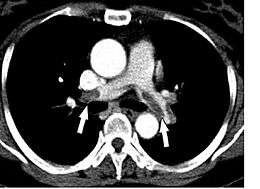
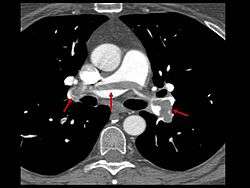
- faire le diagnostic positif : visualiser le thrombus
- faire le diagnostic de gravité : nombre et type d’artères pulmonaires atteintes.
Le choix de l'examen diagnostic dépend de la disponibilité de ceux-ci et de la probabilité du diagnostic positif. On dispose au choix de :
- La scintigraphie pulmonaire :
- de perfusion : on injecte par voie veineuse un marqueur radioactif et on place une caméra de détection de la radioactivité au niveau du thorax du patient. S'il existe une occlusion artérielle pulmonaire, le marqueur n'est alors pas détecté au niveau du lobe pulmonaire concerné. On constate alors une hypofixation qui fait porter le diagnostic d'embolie. C’est un examen simple, peu dangereux pour le patient même s'il emploie des radio isotopes. Il permet de faire un diagnostic positif et un diagnostic de gravité (taille de l'hypofixation). Par contre, il peut passer à côté de petites migrations. De même, n'importe quelle pathologie pulmonaire (et même le simple fait de fumer) altère les images en les rendant plus difficilement interprétables.
- de perfusion et de ventilation : on couple l’examen précédent avec une seconde scintigraphie, dite de ventilation. Le patient respire un gaz radioactif qui est détecté ensuite au niveau alvéolaire par une caméra. Typiquement une embolie pulmonaire se caractérise par une hypofixation sur la scintigraphie de perfusion avec une scintigraphie de ventilation normale au même endroit. Cela permet d’affiner le diagnostic en cas de pathologie pulmonaire préexistante. L’examen revient cependant sensiblement plus cher.
- Le scanner spiralé des artères pulmonaires[12] ou angioscanner des artères pulmonaires : un produit de contraste iodé est injecté en intraveineux. Le mouvement rotatif et longitudinal (caractère spiralé) de la tête du scanner permet de bien visualiser les artères pulmonaires proximales et moyennes et un peu moins bien leur distalité. C’est un excellent examen de diagnostic positif et de gravité, même si les risques liés à l’emploi de produits iodés et la radiation persistent. Il est moins invasif que l'angiographie conventionnelle. Il permet aussi l'évaluation de plusieurs autres structures intrathoraciques (aorte et médiastin, poumon, plèvre), en plus de l'évaluation des artères pulmonaires. Il est considéré souvent comme le nouvel examen de référence.
La réalisation dans les 48 heures d'une échographie Doppler à la recherche d'une phlébite profonde des membres inférieurs ou des veines du réseau veineux profond abdominal doit être systématique.
À part : l'échographie cardiaque : elle ne permet qu'exceptionnellement de visualiser un thrombus, mais apporte un certain nombre d'arguments si l'embolie est massive : dilatation des cavités droites avec augmentation des pressions droites.
La radiographie pulmonaire ne montre aucune image spécifique. Elle permet essentiellement d’éliminer une autre cause à l'essoufflement. L'IRM est de réalisation délicate pour le diagnostic d'embolie pulmonaire avec une sensibilité non optimale[13].
L'angiographie pulmonaire autrefois examen de référence, n'est plus guère utilisé : un cathéter (long et fin tuyau) est introduit par voie haute (humérale) ou par voie basse (fémorale) jusque dans le tronc de l’artère pulmonaire et un produit de contraste iodé est alors injecté. Plusieurs clichés radiologiques sont alors pris selon différentes incidences. Il permet un diagnostic positif et de gravité.
Évolution
Sous un traitement bien conduit, l'embolie pulmonaire peut guérir sans séquelle, mais il peut parfois subsister un essoufflement plus ou moins invalidant.
La plupart des embolies pulmonaires (60 % à 80 %) n'ont aucune manifestation clinique puisque le thrombus est de petite taille.
Une embolie pulmonaire massive peut conduire à un état de choc, voire à un arrêt cardio-circulatoire. Sa mortalité atteint un peu plus de 15 % dans les trois premiers mois[14].
Dans 1 % des cas, l'évolution se fait vers l'installation d'une hypertension artérielle pulmonaire caractérisée par une pression systolique de l'artère pulmonaire supérieure à 40 mmHg[15]. Cette hypertension peut être silencieuse ou se manifester par un essoufflement, une fatigabilité. Le traitement repose sur l'ablation chirurgicale des embols (thrombectomie) lorsqu'elle est possible[16] et l'anticoagulation. Si la thrombectomie n'est pas possible, un traitement médicamenteux (bosentan, sildénafil…) peut être tenté.
Traitement
Plusieurs recommandations sur la prise en charge de l'embolie pulmonaire ont été publiées par des instances internationales. Les plus récentes l'ont été en 2007 par l'American college of physicians[17] et en 2008 par l'European Society of Cardiology[18].
L'hospitalisation est théoriquement indispensable. S'il s'agit d’une embolie pulmonaire grave, l'admission en soins intensifs de cardiologie ou de pneumologie est préférable. Dans les formes non graves, elle peut être discutée[19].
Une oxygénothérapie est mise en route dans un premier temps de façon non invasive (à réévaluer avec la tolérance de l'embolie)[réf. nécessaire].
Une anticoagulation en intraveineuse ou en sous-cutanée par héparine non fractionnée ou HBPM est débutée avec un relais dans les sept jours par AVK per os qui seront continués au moins pendant 6 mois suivant le contexte. Le choix entre héparine non fractionnée (en seringue électrique) et HBPM repose essentiellement sur les habitudes du prescripteur, les deux options ayant une efficacité équivalente[20]. On s'adaptera également à la fonction rénale. Les anticoagulants oraux directs sont une alternative aux AVK, que cela soit avec le dabigatran[21], le rivaroxaban[22], l'apixaban[23] ou l'édoxaban[24]. La durée totale de l'anticoagulation reste sujet à discussion : en cas de maladie thrombo-embolique récidivante, une anticoagulation prolongée (à vie en pratique) est préconisée. Dans le cas d'un épisode isolé, la durée recommandée est de 3 à 6 mois. Cependant un traitement plus prolongé diminue le risque de récidive tout en augmentant le risque d'un accident hémorragique[25].
Le lever est fait après 24 à 48 h d'anticoagulation bien conduite en présence d'un infirmier(référence souhaitée), et avec des contentions élastiques de type bande à varices au niveau des membres inférieurs.
Si l'embolie pulmonaire est grave (hémodynamique instable) et menace le pronostic vital, on peut proposer un traitement fibrinolytique[18] (ou thrombolyse).
- La fibrinolyse a pour but de dissoudre rapidement le caillot (quelques heures au lieu de quelques jours). Elle est injectée en une perfusion de courte durée (en général bolus initial suivi d'une perfusion sur deux heures).
- Attention : le risque hémorragique est majoré de façon importante : saignement intra-crânien, hémorragie digestive potentiellement fatale, hémorragie musculaire profonde ; il est donc capital de respecter les contre-indications (chirurgie récente, trouble de l'hémostase, ponction artérielle, HTA non maîtrisée, AVC récent…) et de ne réaliser la thrombolyse qu'en cas d'urgence vitale.
En cas de contre-indication ou d'échec de la thrombolyse, en dernier recours, une thrombectomie chirurgicale de sauvetage peut être envisagée par sternotomie médiane sous circulation extra-corporelle. Ce traitement est cependant d'indication rare. Des traitements alternatifs par fragmentation ou aspiration des caillots par un cathéter sont en cours de test[26].
La prise en charge des petites embolies pulmonaires (dite « sous-segmentaire » lorsque le diagnostic est scannographique) n'est pas univoque. Le pronostic est globalement bon et il peut être proposé une simple surveillance dans certains cas[27].
Notes et références
- (en) Virchow RLK, Cellular Pathology, 1859
- (en) Silverstein MD, Heit JA, Mohr DN, Petterson TM, O'Fallon WM, Melton LJ III, « Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study » Arch Intern Med, 1998;158:585-593
- Cardiologie, Collège national des enseignants de Cardiologie et Société Française de Cardiologie (R. Isnard, D. Lacroix et coll.), 2e édition, Elsevier Masson, 2015
- (en) Zöller B, Xinjun Li, Sundquist J, Sundquist K, « Risk of pulmonary embolism in patients with autoimmune disorders: a nationwide follow-up study from Sweden » Lancet, 2012;379:244-249
- Kamel H, Navi BB, Sriram N, Hovsepian DA, Devereux RB, Elkind MS, « Risk of a thrombotic event after the 6-week postpartum period » N Engl J Med, 2014
- (en) Wells PS, Anderson DR, Rodger M et al. « Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and D-dimer », Ann Intern Med, 2001;135:98-107
- infarctus du myocarde, angor instable, insuffisance cardiaque, péricardite, asthme, pneumothorax, pneumonie, épanchement pleural, cancer du poumon, douleurs musculosquelettiques de la paroi thoracique
- (en) Le Gal G, Righini M, Roy PM et al. « Prediction of pulmonary embolism in the emergency department: the revised Geneva score » Ann Intern Med, 2006;144:165-171
- Frédéric Adnet, Frédéric Lapostolle, Tomislav Petrovic, ECG en urgence : Cas clinique, analyse ECG, stratégie thérapeutique, Arnette Blackwell, , 271 p., broché (ISBN 2718410701, présentation en ligne), « Le syndrome de la passerelle », p. 256-260.
- (en) Kruip MJ, Slob MJ, Schijen JH, van der Heul C, Büller HR, « Use of a clinical decision rule in combination with D-dimer concentration in diagnostic workup of patients with suspected pulmonary embolism: a prospective management study » Arch Intern Med, 2002;162:1631-1635
- (en) Righini M, Aujesky D, Roy PM et al. « Clinical usefulness of D-dimer depending on clinical probability and cutoff value in outpatients with suspected pulmonary embolism » Arch Intern Med, 2004;164:2483-2487
- Cette appellation témoigne de l'époque où les scanners ne pouvaient acquérir que des coupes planes, le sujet étant immobilisé entre chaque image. L'acquisition “spiralée” constitue la règle des scanners actuels
- (en) Stein PD, Chenevert TL, Fowler SE et al. « Gadolinium-enhanced magnetic resonance angiography for pulmonary embolism: A multicenter prospective study (PIOPED III) » Ann Intern Med, 2010;152:434-443
- (en) Goldhaber SZ, Visani L, De Rosa M, « Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER) » Lancet, 1999;353:1386-1389
- (en) Becattini C, Agnelli G, Pesavento R et al. « Incidence of chronic thromboembolic pulmonary hypertension after a first episode of pulmonary embolism » Chest, 2006;130:172-175
- (en) Piazza G, Goldhaber SZ, « Chronic thromboembolic pulmonary hypertension » N Engl J Med, 2011;364:351-360
- (en) Snow V, Qaseem A, Barry P et al. « Management of venous thromboembolism: a clinical practice guideline from the american college of physicians and the american academy of family physicians » Ann Intern Med, 2007;146;204-210
- (en) Torbicki A, Perrier A, Konstantinides S et al. « guidelines on the management of acute pulmonary embolism » Eur Heart J, 2008;29:2276-2315
- (en) Aujesky D, Roy P-M, Verschuren F et al. « Outpatient versus inpatient treatment for patients with acute pulmonary embolism: an international, open-label, randomised, non-inferiority trial » Lancet, 2011;378:41-48
- (en) Quinlan DJ, McQuillan A, Eikelboom JW, « Low-molecular-weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism: a meta-analysis of randomized, controlled trials » Ann Intern Med, 2004;140:175-183
- (en) Schulman S, Kakkar AK, Goldhaber SZ et al. « Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis » Circulation, 2014;129:764-772
- (en) Buller HR, Prins MH, Lensin AW et al. « Oral rivaroxaban for the treatment of symptomatic pulmonary embolism » N Engl J Med, 2012;366:1287-1297
- (en) Agnelli G, Buller HR, Cohen A et al. « Oral apixaban for the treatment of acute venous thromboembolism » N Engl J Med, 2013;369:799-808
- (en) Buller HR, Decousus H, Grosso MA et al. « Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism » N Engl J Med, 2013;369:1406-1415
- Couturaud F, Sanchez O, Pernod G et al. Six months vs extended oral anticoagulation after a first episode of pulmonary embolism: The PADIS-PE randomized clinical trial, JAMA, 2015;314:31-40
- (en) Engelberger RP, Kucher N, « Catheter-based reperfusion treatment of pulmonary embolism » Circulation, 2011;124:2139-2144
- (en) Stein PD, Goodman LR, Hull RD, Dalen JE, Matta F, « Diagnosis and management of isolated subsegmental pulmonary embolism: review and assessment of the options » Clin Appl Thromb Hemost, 2012;18:20-26