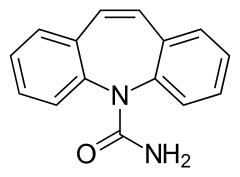
Carbamazépine
La carbamazépine est un médicament anticonvulsivant et thymorégulateur.
| Carbamazépine | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 5-carbamoyl-5H-dibenzo(b,f)azépine | |
| No CAS | (dihydrate) |
|
| No ECHA | 100.005.512 | |
| Code ATC | N03 | |
| DrugBank | APRD00337 | |
| PubChem | 2554 | |
| Propriétés chimiques | ||
| Formule brute | C15H12N2O [Isomères] |
|
| Masse molaire[1] | 236,2686 ± 0,0135 g/mol C 76,25 %, H 5,12 %, N 11,86 %, O 6,77 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | 80 % | |
| Liaison protéique | 76 % | |
| Métabolisme | Hépatique par le CYP3A4 (en 10,11-époxycarbamazépine) | |
| Demi-vie d’élim. | 25–65 heures | |
| Excrétion |
2–3 % excrété inchangé dans les urines |
|
| Considérations thérapeutiques | ||
| Voie d’administration | orale | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| Carbamazépine | |
| Noms commerciaux | Tégrétol (France, Belgique, Suisse) Carsol Timonil |
|---|---|
| Classe | antiépileptique |
Histoire
La carbamazépine a été découverte par Walter Schindler en Suisse, en 1953[2].
La carbamazépine a été commercialisée en 1962 comme traitement de la névralgie du trijumeau avant d'être employée comme un anticonvulsivant au Royaume-Uni en 1965 et aux États-Unis à partir de 1974.
En 1971, Takezaki et Hanaoka utilisèrent la carbamazépine pour soigner les états maniaques chez des patients réfractaires aux antipsychotiques (le lithium n'était pas disponible au Japon à cette époque). La carbamazépine sera alors étudiée pour les affections bipolaires dans les années 1970[3].
Métabolisme
Après ingestion, la biodisponibilité de la carbamazépine est très élevée. Après son absorption intestinale, elle est métabolisée au niveau hépatique par les isoenzymes CYP3A4 (principalement), CYP2D et CYP2C8. Ces isoenzymes forment le système du cytochrome p450 qui transforme la carbamazépine en son métabolite : la 10,11-époxycarbamazépine puis en 10,11-dihydroxycarbamazépine, inactive. La 10,11-époxycarbamazépine a des propriétés anticonvulsivantes chez l'animal mais son intérêt thérapeutique chez l'être humain n'est pas clair[4].
La carbamazépine est un inducteur enzymatique influençant l'effet de nombreux médicaments et même sa propre métabolisation.
Il est utile de contrôler les concentrations plasmatiques du médicament dont la zone thérapeutique d'efficacité est estimée entre 4 et 12 μg/ml de sang en fonction des autres thérapies employées. La concentration résiduelle (Cmin) se détermine par méthode immunologique ou chromatographique (la chromatographie dose le métabolite époxyde actif). Les effets secondaires apparaissent pour des Cmin de plus de 12 μg/ml en monothérapie et des Cmin de plus de 8 μg/ml en polythérapie[5]. Le rapport époxycarbamazépine/carbamazépine est de 17 % chez les patients en monothérapie et de 30 % lors de l'association avec l'acide valproïque[6].
La détection immunologique des tricycliques est perturbée par des réactions croisées avec la structure de la carbamazépine[7].
Interactions médicamenteuses
Les antibiotiques tels que l'érythromycine, l'isoniazide, la clarithromycine et la troléandromycine augmentent les concentrations plasmatiques de la carbamazépine.
Indications
Les épilepsies partielles répondent bien à ce traitement, ainsi que les névralgies faciales. On utilise aussi ce médicament en psychiatrie comme régulateur de l'humeur.
La neuromyotonie compliquant une radiothérapie est traitée efficacement par carbamazépine[8].
La carbamazépine est également indiquée dans la névralgie du trijumeau.
Effets indésirables
Les effets indésirables sont nombreux notamment sur la sphère neuro-psychique : agitation, confusion, vertige, diplopie, maux de tête… mais la carbamazépine occasionne aussi des troubles digestifs comme des nausées, des troubles cardiaques comme des troubles du rythme, des troubles cutanés tels que des photosensibilisations. Des allergies sévères par mécanisme d'hypersensibilité peut conduire à des atteintes graves (DRESS syndrome[9], syndrome de Lyell, syndrome de Stevens-Johnson, agranulocytose, aplasie médullaire, etc.).
Il est rapporté des effets cutanés graves (syndrome de Lyell) plus fréquents dans la population asiatique[10] ayant le marqueur allélique HLA-B*1502[11] et chez les patients européens porteurs du HLA-A*3101[12].
Carbamazépine et grossesse
La carbamazépine traverse la barrière placentaire. Elle augmente la fréquence des anomalies de fermeture du tube neural (comme le spina bifida) mais moins que les autres anti-épileptiques[13]. De même, elle semble moins provoquer d'autres malformations graves que l'acide valproïque[14]. Les recommandations de l'American Society of Neurology semblent en faire le médicament anti-épileptique le moins risqué chez la femme enceinte[15].
La carbamazépine se retrouve dans le sang des enfants allaités par une mère traitée et pourrait être à l'origine d'hépatite médicamenteuse chez ces enfants[16].
Surdosage en carbamazépine
Le surdosage en carbamazépine peut-être aigu ou chronique. La prise volontaire ou non d'une surdose brutale de carbamazépine conduit à des troubles du rythme cardiaque et tensionnels, des troubles neurologiques (léthargie, coma…) alors qu'un surdosage chronique (erreur de dosage, prise concomitante de médicaments allongeant la demi-vie de la carbamazépine…) conduit plus volontiers à des désordres hydroélectrolytiques, cutanés et hématologiques. La prise en charge de ces surdoses consiste à un traitement symptomatique, il n'y a pas d'antidote connu[7]. La prévention d'un surdosage chronique fait appel à la surveillance des taux plasmatiques du médicament.
Divers
La carbamazépine fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[17].

Liens externes
- (en) TA warning
- (en) Carbamazepine overview from PsychEducation.org
- Compendium suisse des médicaments : spécialités contenant Carbamazépine
Sources
- La revue Prescrire décembre 2008, T28 no 302 suppl. interactions médicamenteuses.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Schindler W, Häfliger F, « Über Derivate des Iminodibenzyls », Helvetica Chimica Acta, vol. 37, , p. 472–83. (DOI 10.1002/hlca.19540370211).
- (en) Okuma T, Kishimoto A, « A history of investigation on the mood stabilizing effect of carbamazepine in Japan », Psychiatry Clin. Neurosci., vol. 52, , p. 3–12 (PMID 9682927)
- Carbamazépine sur drugs.com
- Marie-José Royer-Morrot, Elisabeth Rey, Jean-Claude Alvarez Suivi thérapeutique pharmacologique de la carbamazépine Elsevier Masson : lire le résumé
- Lancelin, Cattelotte, Boyer, Mouchet, Biset, Kraoul, Piketty, Influence de la carbamazépine-10,11-époxyde dans le dosage de la carbamazépine « Dimension Flex Carbamazepine », Immunoanalyse & Biologie Spécialisée, vol. 18, no 6, p. 354-359 (décembre 2003) lire le résumé en ligne
- Intoxications aux urgences EMC référence, Paul Zetlaoui, Martine Lenoble & coll éditions Masson lire en ligne sur books.google
- Lefèvre-Houillier, Willer, Delattre, Martin-Duverneuil Neuromyotonie post-radique du masséter Revue Neurologique, vol. 160, no 11, novembre 2004, p. 1075-1077 lire le résumé en ligne
- Elsevier Masson lire le résumé en ligne
- (en) FDA News Carbamazepine Prescribing Information to Include Recommendation of Genetic Test for Patients with Asian Ancestry FDA News
- (en) CW Yang, SI Hung et Juo, « HLA-B*1502-bound peptides: implications for the pathogenesis of carbamazepine-induced Stevens-Johnson syndrome », J Allergy Clin Immunol., vol. 120, no 4, , p. 870-877 (PMID 17697703)
- (en) M McCormack, A Alfirevic et S Bourgeois, « HLA-A*3101 and carbamazepine-induced hypersensitivity reactions in europeans », N Eng J Med., no 364, , p. 1134-1143 (lire en ligne)
- Jentink J, Dolk HD, Loane MA et al., Intrauterine exposure to carbamazepine and specific congenital malformations: systematic review and case-control study, BMJ, 2010, 341:c6581
- Wide K, Winbladh B, Kallen B, Major malformations in infants exposed to antiepileptic drugs in utero, with emphasis on carbamazepine and valproic acid: a nation-wide, population-based register study, Acta Paediatr, 2004;93:174-6.
- Harden CL, Meador KJ, Pennell PB et al., Practice parameter update: management issues for women with epilepsy—focus on pregnancy (an evidence-based review): teratogenesis and perinatal outcomes, Neurology, 2009, 73:133-41
- CRAT, Centre de Référence sur les Agents Tératogènes Hôpital Armand-Trousseau, 26 avenue du Docteur Arnold Netter, 75012 Paris.
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie