Acide urique
L’acide urique est un composé chimique de formule brute C5H4O3N4. C'est une molécule quasiment insoluble dans l’eau résultant de la dégradation et de l'excrétion des purines (principalement la guanine et l'adénine) chez l'être humain et les primates supérieurs, qui ne possèdent plus l'enzyme (uricase) conduisant à l'allantoïne présente chez la plupart des autres mammifères.
Ne doit pas être confondu avec Urée.
| Acide urique | |
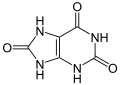 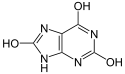 Tautomère céto (à gauche) et énol (à droite) de l'acide urique  Modélisation tridimensionnelle |
|
| Identification | |
|---|---|
| Nom UICPA | 7,9-dihydro-1H-purine-2,6,8(3H)-trione |
| Synonymes |
2,6,8-trioxypurine |
| No CAS | |
| No ECHA | 100.000.655 |
| No CE | 200-720-7 |
| DrugBank | DB01696 |
| PubChem | 1175 |
| No E | Cette |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs |
| Propriétés chimiques | |
| Formule | C5H4N4O3 [Isomères] |
| Masse molaire[1] | 168,1103 ± 0,006 g/mol C 35,72 %, H 2,4 %, N 33,33 %, O 28,55 %, |
| pKa | 5.4 |
| Propriétés physiques | |
| T° fusion | 300 °C |
| Solubilité | faible dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
Chez les oiseaux et les reptiles, l'acide urique est aussi le produit d'élimination des purines, mais son excrétion se fait dans les selles et non dans les urines comme chez l'homme (uricotélie)[2].
L’acide urique est présent en faible quantité dans le sang (uricémie) des mammifères (36 à 69 mg·L-1 chez l’être humain).
Urate
Pathologie humaine
Une augmentation de sa concentration dans le sérum sanguin, appelée hyperuricémie, entraîne la goutte, responsable d’arthropathies (arthrite goutteuse) et de lithiase rénale par formation de cristaux dans les reins, appelés calculs rénaux. Cela peut également être dû à une augmentation de la fraction protonée de l'acide urique, par une diminution du pH urinaire par exemple.
Une augmentation du taux d'acide urique est la cause de certaines pathologies répandues dans le monde. Il a été montré qu'une hyperuricémie joue un rôle dans l'hypertension. Plusieurs études récentes suggèrent que l'acide urique est une des causes du diabète de type 2, le taux d'acide urique étant d'ailleurs un bon prédicteur de l'apparition d'un diabète. Il prédit aussi le développement de l'obésité. Différentes études ont montré que la baisse du taux d'acide urique permet de faire baisser la tension, de faire perdre du poids ou de réduire les risques de maladies cardiovasculaires. Cependant de telles baisses restent à être confirmées par des études cliniques de grande ampleur[3].
Le taux d'acide urique peut augmenter par la consommation d'aliments riches en purine ou en fructose[3].
Dans le cas de la femme enceinte, un taux élevé d’acide urique, combiné à une hypertension artérielle et une perte anormale d'albumine dans les urines doivent entraîner une surveillance à cause des risques de toxémies.
Le syndrome de lyse tumorale s'accompagne d'une hyperuricémie pouvant menacer le pronostic vital ; les traitements alors utilisés sont la rasburicase si hyperleucocytose ou forme tumorale, allopurinol sinon, et rarement l'hémodialyse (épuration extra-rénale).
Microscopiquement, les dépôts d'urates se présentent comme une substance d'aspect peigné, peu colorable, entourée d'une réaction macrophagique, histiocytaire, très peu gigantocellulaire. Cette substance peut disparaître partiellement lors de la fixation formolée.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Biologie - Tout le cours en fiches - 2e éd., Daniel Richard, Patrick Chevalet, Sylvie Fournel, Nathalie Giraud, Frédéric Gros, Patrick Laurenti, Fabienne Pradere, Thierry Soubaya, p. 359
- (en) Mehmet Kanbay, Thomas Jensen, Yalcin Solak, Myphuong Le, Carlos Roncal-Jimenez, Chris Rivard, Miguel A. Lanaspa, Takahiko Nakagawa et Richard J. Johnson, « Uric acid in metabolic syndrome: From an innocent bystander to a central player », European journal of internal medicine, vol. 29, , p. 3–8 (ISSN 0953-6205, PMCID PMC4826346, DOI 10.1016/j.ejim.2015.11.026, lire en ligne)