Thermus aquaticus
Thermus aquaticus est une espèce de bactérie pouvant tolérer de fortes températures. À Gram négatif et aérobie, elle fait partie des bactéries thermophiles appartenant au phylum des Deinococcus-Thermus. On a extrait de cette bactérie la Taq ADN polymérase, une des enzymes thermostables les plus utilisées en biologie moléculaire, notamment dans la technique de la PCR. Elle peut survivre à des températures allant jusqu'à 85 °C et dans des milieux très acides, ce qui en fait un des premiers extrêmophiles découverts[1].
| Règne | Bacteria |
|---|---|
| Embranchement | Deinococcus-Thermus |
| Classe | Deinococci |
| Ordre | Thermales |
| Genre | Thermus |
Histoire

Dans les années 1960, lorsque commencèrent les premières études biologiques des organismes vivant dans les sources chaudes, les scientifiques pensaient que les bactéries thermophiles ne pouvaient pas survivre à des températures supérieures à environ 55 °C[2]. Cependant, ils découvrirent rapidement que de nombreuses bactéries issues de sources chaudes diverses pouvaient non seulement survivre, mais également prospérer à des températures supérieures à 55 °C. En 1969, Thomas Brock et Hudson Freeze, de l'Université de l'Indiana, ont recensé une nouvelle espèce de bactérie thermophile qu'ils ont appelée Thermus aquaticus[3]. Elle fut d'abord isolée de la source Mushroom Spring du bassin Lower Geyser Basin du Parc National du Yellowstone, source qui se situe près des geysers Great Fountain et White Dome[4], et a depuis été retrouvée dans des environnements chauds similaires à travers le monde.
Biologie
Sa température idéale de développement est de 70 °C mais elle peut tolérer une gamme de températures allant de 50 à 80 °C[2]. Cette bactérie est chimiotrophe, c'est-à-dire qu'elle utilise la chimiosynthèse pour opérer son métabolisme. Cependant, du fait que sa gamme de températures tolérées se chevauche un peu avec celle des cyanobactéries photosynthétiques qui partagent son environnement idéal, on la trouve parfois vivant étroitement avec ses cyanobactéries voisines, utilisant ainsi l'énergie issue de leur photosynthèse pour leur propre croissance.
Morphologie
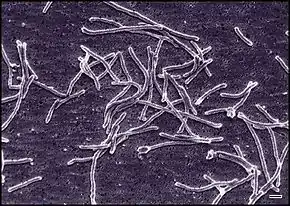
Thermus aquaticus est en général de forme cylindrique (bâtonnet) avec un diamètre de 0,5 à 0,8 µm. Les bâtonnets les plus courts ont une longueur comprise entre 5 et 10 µm. Les filaments les plus longs ont une large gamme de tailles et peuvent parfois excéder 200 µm. Les bactéries en forme de bâtonnets ont tendance à former des agrégats, et dans le cas de T. aquaticus ces agrégats peuvent former des corps sphériques de diamètre 10 à 20 µm, qu'on appelle également corps rotondis (rotound bodies en anglais)[3],[5].
Enzymes
Thermus aquaticus est devenue célèbre de par sa capacité de production d'enzymes thermostables, notamment la Taq polymérase décrite plus bas.
Aldolase
Une fois que cette bactérie a été cultivée avec succès en laboratoire, les premières études tentaient de comprendre comment les enzymes des thermophiles (qui sont normalement dénaturées à haute température) pouvaient fonctionner à de telles températures. En 1970, Freeze et Brock ont publié un article décrivant une aldolase thermostable issue de T. aquaticus[6].
ARN polymérase
La première polymérase isolée de T. aquaticus en 1974 était une ARN polymérase ADN-dépendante[7], utilisée dans le processus de transcription.
Enzyme de restriction Taq I
La plupart des biologistes moléculaires ont probablement entendu parler de cette bactérie plutôt à la fin des années 1970 ou au début des années 1980 grâce à l'isolation d'enzymes de restriction chez cet organisme[8] pouvant être utiles dans leur discipline. L'utilisation du terme Taq (première lettre du nom de genre et deux premières lettres du nom d'espèce) a été proposée à cette époque, en même temps que la convention de donner des noms raccourcis aux enzymes de restriction à partir du nom de genre et d'espèce des organismes producteurs (comme Sal et Hin issues respectivement de Streptomyces albus[9] et Haemophilus influenzae[10]) est entrée en vigueur.
ADN polymérase ("Taq pol")
L'ADN polymérase de Thermus aquaticus a été isolée pour la première fois en 1976. Le premier avantage de cette enzyme thermostable (optimum de température à 72 °C) était qu'elle pouvait être isolée sous une forme plus pure (sans autres contaminants enzymatiques) que les polymérases issues d'autres organismes. Plus tard, Kary Mullis et d'autres chercheurs à la Cetus Corporation ont découvert que cette enzyme pouvait être utilisée dans la PCR[11], éliminant ainsi le besoin d'ajouter une enzyme après chaque cycle de dénaturation thermique de l'ADN. L'enzyme a également été clonée, séquencée, modifiée (pour produire un fragment plus court, le "Stoffel", ayant perdu l'activité 5'-3' exonucléase[12]) et produite en grandes quantités à des fins commerciales. En 1989 la revue Science a élu la Taq polymérase comme sa toute première "Molécule de l'année"[13]. En 1993, Kary Mullis a obtenu le Prix Nobel de Chimie pour ses travaux sur la PCR[14].
Autres enzymes
L'optimum important de température pour Thermus aquaticus permet aux chercheurs d'étudier des réactions biochimiques dans des conditions où d'autres enzymes perdraient leur activité. On a isolé d'autres enzymes de cet organisme, dont la ligase, la phosphatase alcaline, la NADH oxydase, l'isocitrate déshydrogénase, l'amylomaltase et la lactate déshydrogénase dépendante du fructose 1,6-bisphosphate.
Controverse
L'utilisation commerciale des enzymes issues de Thermus aquaticus a suscité plusieurs controverses. À la suite des travaux de Brock, des échantillons de cet organisme ont été déposés à la American Type Culture Collection (Collection Américaine des Cultures-Type), qui est un dépôt public. D'autres scientifiques, dont ceux de la Cetus, y ont ainsi eu accès. Alors que le potentiel commercial de la Taq polymérase a commencé à émerger dans les années 1990[15], le National Park Service (Service des Parcs Nationaux) a dénommé son utilisation sous le nom de "Grande Escroquerie de la Taq" (Great Taq Rip-off en anglais)[16]. Les chercheurs travaillant dans les parcs nationaux américains sont dorénavant tenus de signer une charte de "partage des profits" qui reverse une part d'éventuels bénéfices futurs au Park Service[17].
Voir aussi
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thermus aquaticus » (voir la liste des auteurs).
Références
- Lopez-Garcia Purification. « Les microbes de l'extrême », in La science des sixties (dir. Néron de Surgy Olivier et Tirard Stéphane), Paris : Belin, 2014. p. 134-135
- (en) Thomas Brock, « Life at High Temperatures », sur instruction.bact.wisc.edu, (consulté le ), p. 27
- T. D. Brock et H. Freeze, « Thermus aquaticus gen. n. and sp. n., a nonsporulating extreme thermophile », Journal of Bacteriology, vol. 98, no 1, , p. 289–297 (ISSN 0021-9193, PMID 5781580, lire en ligne, consulté le )
- (en) Bryan Scott, The Geysers of Yellowstone, Boulder, University Press of Colorado, , 4e éd., 462 p. (ISBN 978-0-87081-924-7)
- T. D. Brock et M. R. Edwards, « Fine structure of Thermus aquaticus, an extreme thermophile », Journal of Bacteriology, vol. 104, no 1, , p. 509–517 (ISSN 0021-9193, PMID 5473907, lire en ligne, consulté le )
- H. Freeze et T. D. Brock, « Thermostable aldolase from Thermus aquaticus », Journal of Bacteriology, vol. 101, no 2, , p. 541–550 (ISSN 0021-9193, PMID 4984076, lire en ligne, consulté le )
- G. M. Air et J. I. Harris, « DNA-dependent RNA polymerase from the thermophilic bacterium Thermus aquaticus », FEBS letters, vol. 38, no 3, , p. 277–281 (ISSN 0014-5793, PMID 4604362, DOI 10.1016/0014-5793(74)80072-4, lire en ligne, consulté le )
- S. Sato, « A single cleavage of Simian virus 40 (SV40) DNA by a site specific endonuclease from Thermus aquaticus, Taq I », Journal of Biochemistry, vol. 83, no 2, , p. 633–635 (ISSN 0021-924X, PMID 204628, DOI 10.1093/oxfordjournals.jbchem.a131952, lire en ligne, consulté le )
- (en) M. R. Rodicio et Keith F. Chater, « Cloning and expression of the SalI restriction-modification genes of Streptomyces albus G », Molecular and General Genetics MGG, vol. 213, no 2, , p. 346–353 (ISSN 1432-1874, DOI 10.1007/BF00339601, lire en ligne, consulté le )
- S. X. Shen, Q. L. Li, P. F. Yan et B. Zhou, « Restriction endonucleases from three strains of Haemophilus influenzae. », Scientia Sinica, vol. 23, no 11, , p. 1435–1442 (ISSN 0250-7870, PMID 6262907, lire en ligne, consulté le )
- R. K. Saiki, D. H. Gelfand, S. Stoffel et S. J. Scharf, « Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase », Science (New York, N.Y.), vol. 239, no 4839, , p. 487–491 (ISSN 0036-8075, PMID 2448875, DOI 10.1126/science.2448875, lire en ligne, consulté le )
- F. C. Lawyer, S. Stoffel, R. K. Saiki et S. Y. Chang, « High-level expression, purification, and enzymatic characterization of full-length Thermus aquaticus DNA polymerase and a truncated form deficient in 5' to 3' exonuclease activity », PCR methods and applications, vol. 2, no 4, , p. 275–287 (ISSN 1054-9803, PMID 8324500, lire en ligne, consulté le )
- R. L. Guyer et D. E. Koshland, « The Molecule of the Year », Science (New York, N.Y.), vol. 246, no 4937, , p. 1543–1546 (ISSN 0036-8075, PMID 2688087, DOI 10.1126/science.2688087, lire en ligne, consulté le )
- (en-US) Kary B. Mullis, « The Nobel Prize in Chemistry 1993 », sur NobelPrize.org (consulté le )
- Joe Fore, Ilse R. Wiechers et Robert Cook-Deegan, « The effects of business practices, licensing, and intellectual property on development and dissemination of the polymerase chain reaction: case study », Journal of Biomedical Discovery and Collaboration, vol. 1, , p. 7 (ISSN 1747-5333, PMID 16817955, PMCID 1523369, DOI 10.1186/1747-5333-1-7, lire en ligne, consulté le )
- (en-US) Jim Robbins, « The Search for Private Profit in the Nation’s Public Parks », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- (en) « Benefits Sharing in the National Parks (U.S. National Park Service) », sur www.nps.gov (consulté le )
Articles connexes
Liens externes
- Portail de la microbiologie