Sortie des eaux
Dans l'histoire évolutive du vivant, la sortie des eaux, appelée aussi conquête des continents, conquête des terres ou terrestrialisation (terme préférable[2]), correspond à l'adaptation progressive, au cours de l'Archéen par les bactéries et au cours du paléozoïque, par la flore puis la faune jusque-là essentiellement marines, à un mode de vie terrestre. L'extinction de l'Ordovicien-Silurien et du Dévonien sont notamment marquées par d'importantes crises biologiques qui appauvrissent la vie marine et favorisent la conquête des terres émergées par les plantes chlorophylliennes et plusieurs grands groupes animaux, essentiellement les mollusques, les arthropodes et les vertébrés. Cette conquête par les premières formes végétales aurait eu lieu au Cambrien il y a environ entre 500 Ma, par les premiers végétaux vasculaires à la limite Ordovicien-Silurien (445 Ma)[3], et par les formes animales terrestres — arthropodes, vertébrés entre autres — vers 430 Ma[4]. De très nombreuses adaptations sont développées, autant par les végétaux que par les animaux, le passage de la vie aquatique à la vie terrestre et à la respiration aérienne représentant un saut macroévolutif majeur dans l'histoire du vivant[5].
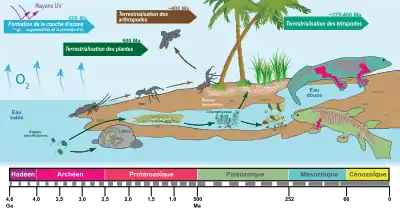

En fait, ce processus se répète et se produit indépendamment au cours de l'histoire des êtres vivants, que ce soit pour les organismes unicellulaires, les champignons, les plantes, les invertébrés ou les vertébrés. Aussi devrait-on parler non pas d'une mais de plusieurs sorties des eaux[6].
Enfin, ce mythe de la sortie unique de l'eau a tendance à masquer le fait qu'il y a eu de nombreux « retours à l'eau ». Parmi les vertébrés tétrapodes qui sont retournés à l’eau secondairement, on peut citer les tortues, les ichtyosaures, les plésiosaures, les mosasaures, les crocodiles, certains squamates (serpents marins, plusieurs iguanes) et quatre lignées de mammifères (Cétacés, Siréniens, Pinnipèdes et Lutrinae)[7].
Histoire évolutive
Sortie des eaux des bactéries
Les principaux groupes de phototrophes pour le carbone, procaryotes ou eucaryotes, sont apparus en milieu marin. Une étude en 2017 suggère cependant que des bactéries auraient barboté dans des sources chaudes d'eau douce terrestre il y a 3,5 milliards d'années[8].
Toujours est-il qu'il existe des arguments géochimiques indirects et traces fossiles directes de biofilms bactériens en faveur de l'apparition de bactéries sur terre à plusieurs reprises au cours de l'Archéen et celle des Cyanobacteria il y a un milliard d'années[9]. Des microchampignons aquatiques apparaissent aussi probablement au fond des océans dans des sources hydrothermales, l'hydromycoflore ayant depuis gardé un mode de vie benthique (tel le genre Tappania (en) apparu il y a 1,6 milliard d'années)[10].
L'établissement de symbioses en milieu aqueux a permis d'apporter des solutions et d'effectuer un saut macroévolutif pour la conquête du milieu terrestre plus hostile par les plantes : diverses associations mutualistiques (lichens, mycophycobioses comme Stigmidium ascophylli (sv) au Cambrien, mycorhization par des gloméromycètes au Silurien[11]) avec des phototrophes ont été simultanément ou successivement utilisées[12],[13]. Les chercheurs supposent que les premières communautés terrestres formaient des croûtes sur les sols, parcourus progressivement par des arthropodes[14].
Sortie des eaux de la flore puis de la faune
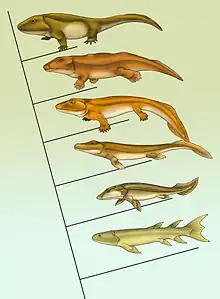
Fossiles de transition de bas en haut : Eusthenopteron, Panderichthys, Tiktaalik, Acanthostega, Ichthyostega, Pederpes.
Depuis l'apparition des algues dans les océans, le manque d'eau et les fortes radiations ultraviolettes sur terre ont confiné ces algues ancestrales dans les milieux aquatiques. L'évolution d'innovations relatives à la reproduction (cycle de vie dominé par la phase sporophytique), à l'architecture (plans d'organisation) et à la protection à l'égard des pertes d'eau a ouvert la voie à l'adaptation des plantes à la terre ferme[18].
L'Ordovicien voit une explosion de la biodiversité connue sous le nom de grande biodiversification ordovicienne. La vie à cette époque est essentiellement confinée aux mers et aux océans, plus particulièrement dans les mers épicontinentales peu profondes qui bordent les nombreux continents, la faible profondeur de l'eau y permettant la photosynthèse. Les fortes productivités phytoplanctoniques journalières et annuelles se trouvent alors dans ces écosystèmes côtiers et correspondent au maximum de biodiversité des milieux marins, l'abondance du phytoplancton se répercutant sur le reste de la chaîne alimentaire jusqu'aux poissons à mâchoires[19].
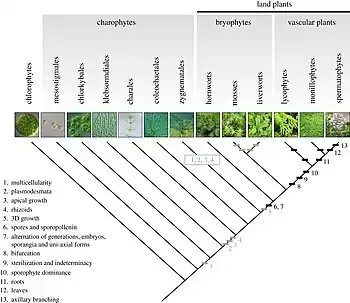
Les embryophytes (i.e. les plantes terrestres) apparues il y a environ 450 millions d’années sont probablement issues d'algues vertes du groupe des charophytes, qui évoluent en eau douce et sont capables de supporter des émersions temporaires grâce à ces associations symbiotiques[20]. La conquête terrestre nécessitant plusieurs adaptations simultanées, ces algues ont probablement adopté une stratégie symbiotique (mycophycobioses, lichens[21]) pour réaliser la première sortie des eaux des végétaux avant celle des plantes vasculaires (du type Polysporangiophytes associées à des mycorhizes)[22]. La conquête terrestre nécessite en effet plusieurs adaptations simultanées pour répondre aux stress engendrés par ce milieu[23] :
- faible disponibilité en eau qui présente des variations très importantes, avec des phases d'absence, d'où une alimentation minérale irrégulière ; ressources nutritives régionalisées (eau et sels minéraux dans le substrat, gaz et lumière dans l'air). La forme filamenteuse et la production d'exoenzymes des champignons exploitent au mieux ces ressources édaphiques tandis que la ramification du thalle chlorophyllien assure l'exploitation des ressources dans l'air ;
- lumière atmosphérique plus riche en rayonnements, notamment en ultraviolets, que la lumière filtrée par l'eau, ce qui nécessite le développement de mécanismes photoprotecteurs (pigments fongiques puis cuticule) ;
- milieu beaucoup moins tamponné thermiquement que la mer (écarts de température rapides et de grande amplitude), d'où le développement de thalles plus importants puis de parenchymes qui assurent une meilleure thermorégulation et l'homéohydrie ;
- poussée d'Archimède réduite en milieu aérien, posant des problèmes de soutien, ce qui impose des formes végétales simples puis complexes grâce au développement d'un métabolisme phénolique permettant la synthèse de biopolymères essentiels, la cutine, la cellulose et la lignine assurant une imperméabilisation de la plante, une protection contre les radiations et la rigidification de ses parties érigées[24].
Le développement de ces embryophytes est favorisé par les champignons qui, en secrétant des enzymes exocellulaires, ont la capacité de dissoudre les substrats minéraux du sol[14].
Le registre fossile des premiers végétaux terrestres consiste largement en micro-fossiles (cryptospores puis spores trilètes[25]) qui datent d'environ 460 Ma, et en débris macroscopiques[26]. Les premières plantes dont on dispose les restes presque complets appartiennent au taxon des Rhyniopsida qui vivent dans des zones (marge de mares, de zones inondables) où elles subissent des émersions occasionnelles. L'absence de racines et de feuilles limite leur taille, leurs « tiges[27] » sont des axes ramifiés avec des branches dichotomiques sur lesquelles s'insèrent les sporanges. Le développement de tissus conducteurs, de tiges puis de systèmes racinaires favorisent progressivement l'augmentation de la taille des plantes vasculaires dans le milieu aérien[28].
Deux extinctions massives se produisent à la fin de cette période entre 450 Ma et 440 Ma. L'extinction de l'Ordovicien-Silurien est marquée par une importante glaciation et une baisse du niveau de la mer. Cette régression marine voit un retrait de la mer sur des centaines de kilomètres, ce qui appauvrit la vie marine des plateaux continentaux. Une autre conséquence de cette régression est une expansion des environnements d'eau douce, puisque l'écoulement continental a de plus longues distances à parcourir avant d'atteindre les océans. Cette extinction est suivie par un événement anoxique océanique lié à une transgression marine globale majeure qui entraîne lui aussi des désordres écologiques rendant difficile l'adaptation des espèces à leurs écosystèmes marins. Cela entraîne au Silurien le développement des Eutrachéophytes (vraies plantes vasculaires) et d'arthropodes (myriapodes de type Pneumodesmus newmani, araignées, acariens, collemboles, alors que des annélides ont probablement conquis les terres émergées dès l'Ordovicien) dans des écosystèmes terrestres marginaux (marais côtiers, lagunes sableuses, rives fluviales et lacustres).
Encore inféodés aux milieux humides, les plantes terrestres (dont les trachéophytes), mollusques (dont les gastéropodes), arthropodes (dont les insectes) et vertébrés vont progressivement sortir des eaux pour devenir réellement terrestres[6]. Au cours du Dévonien, cette colonisation progressive de la terre[29], en plusieurs étapes[30], est favorisée par :
- l'accroissement du taux d'oxygène marin et atmosphérique, qui était jusque-là un facteur limitant : alors que l'atmosphère s'enrichit en oxygène grâce au développement de la photosynthèse, O2 subit l'action des rayonnements ultraviolet et se transforme en partie en ozone. Ainsi se forme peu à peu une couche d'ozone qui joue son rôle d'écran au Silurien, filtrant une grande partie des radiations létales du soleil[31] ;
- l'étendue des estrans lors des périodes chaudes au niveau général des mers élevé, lorsque sur les plateaux continentaux se développent des formations végétales de type « mangrove » (mais constituées d'espèces à spores), favorisant les espèces animales possédant des appendices ou des nageoires solides et des cavités ou tubes respiratoires ou encore des vessies natatoires richement vascularisées et plissées, à même d'extraire l'oxygène de l'air O2 en période de marée basse[32].
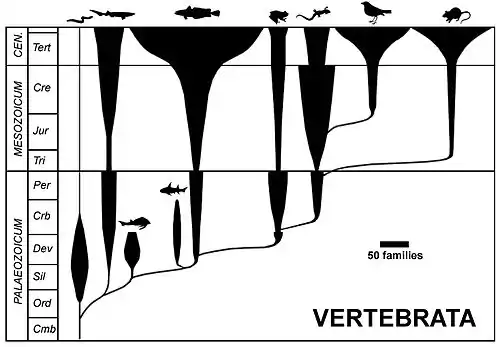
L'extinction du Dévonien entre 408 et 360 Ma (eustatisme, événement anoxique, changements climatiques) affecte essentiellement les invertébrés (ammonites et trilobites) et vertébrés (Placodermes, Sarcoptérygiens) de mer et d'eau douce. Cela favorise le développement des vertébrés modernes, principalement constitués des actinoptérygiens, chondrichtyens et tétrapodes dont les premières sorties de l'eau connues dateraient du Dévonien supérieur, vers -365 Ma, avec Ichthyostega, le plus ancien des vertébrés connus adapté à la fois à la nage et à une forme de locomotion terrestre. L'adaptation des tétrapodes au milieu terrestre devient très affirmée au cours du Carbonifère (-359 à 299 Ma), conduisant aux tétrapodes actuels que sont les amphibiens, les reptiles, les oiseaux et les mammifères[33]. La réduction de la perte d'eau dans le milieu aérien est favorisée par la perméabilité drastiquement plus faible de leur tégument en comparaison des espèces aquatiques, l'internalisation de leurs surfaces respiratoires, une urine peu abondante et des fèces peu hydratées, une alimentation solide et liquide permettant des gains en eau et en sel, et chez les vertébrés par l'apparition de l'œuf amniotique. Enfin, bon nombre d'adaptations comportementales complètent les adaptations morpho-anatomiques et physiologiques, comme l'activité nocturne[34].
Sur les 31 phyla d'animaux actuels identifiés, tous apparus dans le milieu marin, 12 sont endémiques à ce milieu, 19 ayant conquis les terres[35].
Une autre histoire ?
L'extinction à la fin du Dévonien a touché 70 % des espèces vivantes et plus particulièrement les espèces marines, mais a relativement épargné les arthropodes alors déjà très diversifiés et les premiers vertébrés tétrapodes. Selon le professeur de paléobiologie George R. McGhee, si cette extinction massive avait été plus sévère, l'histoire de la vie sur Terre aurait été complètement bouleversée. La longue marche des tétrapodomorphes qui ont évolué à partir des poissons sarcoptérygiens aurait été enrayée et la conquête des terres aurait été assurée essentiellement par les trois principaux groupes d'arthropodes actuels (les hexapodes — insectes et collemboles —, les myriapodes — mille-pattes — et les arachnides — araignées, acariens et scorpions)[36]. Une extinction encore plus massive aurait conduit à une planète microbienne. Du reste, la biodiversité microbienne représente encore aujourd'hui 80 % de la biomasse totale de la planète[37] et, selon le professeur de microbiologie Jean-Louis Fauchère, les hommes ne sont « que des avatars du monde bactérien »[38]. Il n'est d'ailleurs pas surprenant que la terrestrialisation des trois principaux groupes, les végétaux, les arthropodes et les vertébrés se soit accompagnée de l'utilisation des activités des micro-organismes qui sont déjà la forme dominante du monde vivant en termes d'abondance et de biodiversité depuis l'apparition de la vie sur Terre. Les espèces de ces trois groupes sont des communautés symbiotiques par leur origine et ont adopté la même stratégie commune de se servir de mutualistes microbiens (bactéries, protistes et microchampignons), à la fois internes et externes afin de développer des associations mutualistes pour les plantes terrestres (notion de phytobiome et de microbiote des plantes, avec notamment les mycorhizes), de désintoxiquer partiellement la matière végétale et d'en augmenter considérablement la valeur calorifique et nutritive disponible pour les animaux (notion de microbiote intestinal) ou de les protéger (microbiote buccal, cutané, vaginal…)[39],[40].
Notes et références
- Ces os appelés radiaux, sont disposés en trois rangées transversales et se segmentent, processus qui pourrait être à l'origine des métacarpiens et des phalanges. D'après (en) N. H. Shubin & P. Alberch, « A morphogenetic approach to the origin and basic organization of the tetrapod limb », Evolutionary Biology, vol. 20, no 1, , p. 319–387.
- Terrestrialisation est un terme moins anthropomorphisant, celui de conquête sous-entendant un affranchissement par rapport au milieu aqueux originel et un certain échec des organismes restés dans l'eau. Cette expression correspond de plus à une vision finaliste, comme si les êtres vivants avaient la volonté de sortir de l'eau, alors que c'est l’eau qui se retire pour des raisons climatiques ou géologiques. (Cf. Sébastien Steyer, La Terre avant les dinosaures, Belin, 2009, p. 7). D'ailleurs, la plupart des vertébrés sont aquatiques : avec 25 000 espèces connues — 100 décrite chaque année — et environ le même nombre encore inconnues, les poissons constituent le groupe le plus important des vertébrés ((en) Cf. Quentin Bone, Richard Moore, Biology of Fishes, Taylor & Francis, 2008, p. 1). Enfin, en termes de physiologie, cet affranchissement est très incomplet, les animaux et plantes terrestres n'étant pas complètement « sortis des eaux » avec un corps composé majoritairement d'eau. Toutefois l'emploi d'expressions anthropomorphisantes par les scientifiques peut être utile selon le botaniste Lucien Baillaud qui écrit : « Ne méprisons pas l'anthropomorphisme s'il nous aide à nous exprimer ». cf. Lucien Baillaud, « La végétalité : un réseau de déterminismes reliant structure, biologie et milieu de vie dans le deuxième royaume de la nature », Acta Botanica Gallica, vol. 154, no 2, , p. 153-201 (lire en ligne).
- (en) Jennifer L. Morris, Mark N. Puttick, James W. Clark, Dianne Edwards, Paul Kenrick, Silvia Pressel, Charles H. Wellman, Ziheng Yang, Harald Schneider & Philip C. J. Donoghue, « The timescale of early land plant evolution », PNAS, (DOI 10.1073/pnas.1719588115).
- La découverte en 2004 d'un mille-pattes, Pneumodesmus newmani, daté de 428 Ma, correspond à un des plus vieux arthropodes terrestres connus. Cf (en) Heather M. Wilson & Lyall I. Anderson, « Morphology and taxonomy of Paleozoic millipedes (Diplopoda: Chilognatha: Archipolypoda) from Scotland », Journal of Paleontology, vol. 78, no 1, , p. 169–184 (DOI 10.1666/0022-3360(2004)078<0169:MATOPM>2.0.CO;2)
- (en) Gilles Bœuf, « Marine biodiversity characteristics », Comptes Rendus Biologies, vol. 334, nos 5-6, , p. 435-440 (DOI 10.1371/journal.pone.0066906).
- Du Silurien au Dévonien : les sorties des eaux, dossier CNRS
- Guillaume Lecointre, L'évolution, question d'actualité ?, éditions Quae, (lire en ligne), p. 79
- (en) Tara Djokic, Martin J. Van Kranendonk, Kathleen A. Campbell, Malcolm R. Walter & Colin R. Ward, « Earliest signs of life on land preserved in ca. 3.5 Ga hot spring deposits », Nature Communications, vol. 8, no 15263, (DOI 10.1038/ncomms15263).
- (en) Fabia U. Battistuzzi S. Blair Hedges, « A Major Clade of Prokaryotes with Ancient Adaptations to Life on Land », Molecular Biology and Evolution, vol. 26, no 2, , p. 335–343 (DOI 10.1093/molbev/msn247).
- Jean-Christophe Guéguen et David Garon, Biodiversité et évolution du monde fongique, EDP Sciences, , p. 92.
- À la même période ont été découverts les fossiles de Prototaxites dont la nature fongique est discutée.
- Marc-André Selosse, François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », Année Biol., vol. 40, , p. 16-17 (lire en ligne)
- Jean-Christophe Guéguen et David Garon, Biodiversité et évolution du monde fongique, EDP Sciences, , p. 89.
- Francis Martin, Sous la forêt. Pour survivre il faut des alliés, Humensis, , p. 121.
- (en) Grzegorz Niedźwiedzki et al, « Tetrapod trackways from the early Middle Devonian period of Poland », Nature, no 463, , p. 43–48 (DOI 10.1038/nature08623).
- Avec plusieurs clades : Agnathes (lamproies), Chondrichthyens (requins, raies), Placodermes (fossiles), Acanthodiens (fossiles), Osteichthyens (poissons osseux).
- « Systématique : ordonner la diversité du vivant »,' Rapport sur la Science et la technologie N°11, Académie des sciences, Lavoisier, 2010, p. 65
- Peter H Raven, Kenneth A Mason, Georges B Johnson, Jonathan B Losos, Susan R Singer, Biologie, De Boeck Superieur, (lire en ligne), p. 588
- (en) B. D. Webby, Florentin Paris, Mary L. Droser, The Great Ordovician Biodiversification Event, Columbia University Press, , 496 p. (lire en ligne)
- (en) Douglas E. Soltis, Pamela Soltis, J.J. Doyle, Molecular Systematics of Plants II : DNA Sequencing, Springer, , p. 530
- « Par provocation, il est tentant d'écrire que la majorité des Archégoniates terrestres sont des sortes de lichens, dont l'algue est pluricellulaire et occupe la partie aérienne et visible de l'association ». cf. Marc-André Selosse, p. 16
- Jean-Christophe Guéguen et David Garon, Biodiversité et évolution du monde fongique, EDP Sciences, , p. 95
- Marc-André Selosse, François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », Année Biol., vol. 40, , p. 4
- (en) Hugues Renault, Annette Alber, Nelly A. Horst, Alexandra Basilio Lopes, Eric A. Fich, Lucie Kriegshauser, Gertrud Wiedemann, Pascaline Ullmann, Laurence Herrgott, Mathieu Erhardt, Emmanuelle Pineau, Jürgen Ehlting, Martine Schmitt, Jocelyn K. C. Rose, Ralf Reski & Danièle Werck-Reichhart, « A phenol-enriched cuticle is ancestral to lignin evolution in land plants », Nature Communications, vol. 8, no 14713, (DOI 10.1038/ncomms14713).
- À trois fentes de déhiscence.
- Registre fossile des types de fragments et des groupes taxonomiques de plantes terrestres de l'Ordovicien moyen au Dévonien moyen
- On ne peut encore utiliser ce terme car elles n'ont pas leurs structures différentiées actuelles.
- (en) P. G Gensel, « The Earliest Land Plants », Annual Review of Ecology, Evolution, and Systematics, vol. 39, no 1, , p. 459–477
- Répartitions potentielles de la végétation à trois périodes du Dévonien, calculées par le modèle de G. Le Hir et al., tiré de (en) Le Hir, G., Y. Donnadieu, Y. Goddéris, B. Meyer-Berthaud, G. Ramstein, R. C. Blakey, 2011. The climate change caused by the land plant invasion in the Devonian . Earth and Planetary Science Letters , 310(3–4) :203–212
- Sébastien Steyer, La Terre avant les dinosaures, Paris, Belin ("Pour la Science"), , 205 p. (ISBN 978-2-7011-4206-7), p. 76-80
- Jean-Claude Roland, Hayat El Maarouf Bouteau, François Bouteau, Atlas de biologie végétale, Dunod, , p. 122
- Patrick De Wever, Bruno David, Didier Néraudeau, Jean Broutin, Philippe Janvier et al., Paléobiosphère : regards croisés des sciences de la vie et de la terre, Paris/Paris, Vuibert, MNHN, SGF, , 796 p. (ISBN 978-2-7117-2503-8), p. 269-275
- (en) Lauren Cole Sallan et Michael I. Coates, « End-Devonian extinction and a bottleneck in the early evolution of modern jawed vertebrates », Proceedings of the National Academy of Sciences, vol. 107, no 22, (DOI 10.1073/pnas.0914000107)
- Denis Poinsot, Maxime Hervé, Bernard Le Garff, Mael Ceillier, Diversité animale. Histoire, évolution et biologie des Métazoaires, De Boeck Superieur, (lire en ligne), p. 173.
- (en) Gilles Bœuf, « Marine biodiversity characteristics », Comptes Rendus Biologies, vol. 334, nos 5-6, , p. 435 (DOI 10.1016/j.crvi.2011.02.009).
- (en) George R. McGhee, When the invasion of land failed. The legacy of the devonian extinctions, Columbia University Press, , p. 61-67.
- (en) William B. Whitman, David C. Coleman & William J. Wiebe, « Prokaryotes: The unseen majority », PNAS, vol. 95, no 12, , p. 6578-6583 (DOI 10.1073/pnas.95.12.6578, lire en ligne).
- Jean-Louis Fauchère, Les Bactéries et l’Homme : Une cohabitation tumultueuse, Editions Edilivre, , p. 137.
- (en) P. Engel, NA. Moran, « The gut microbiota of insects - diversity in structure and function », FEMS Microbiol Rev., vol. 37, no 5, , p. 699-735 (DOI 10.1111/1574-6976.12025).
- (en) R.E. Ley, M. Hamady, C. Lozupone, P.J.Turnbaugh, R.R. Ramey, J.S. Bircher et al., « Evolution of mammals and their gut microbes », Science, vol. 320, no 5883, , p. 1647–1651 (DOI 10.1126/science.1155725).
Voir aussi
Bibliographie
- Pierre Corvol, Jean-Luc Elghozi, Sortir de l’eau. De la vie aquatique à la vie, Odile Jacob, , 240 p. (lire en ligne)
- (en) George R. McGhee Jr., When the invasion of land failed. The legacy of the Devonian extinctions, Columbia University Press, , 336 p. (lire en ligne)
Articles connexes
Liens externes
- "De l'eau à la terre, une histoire d'évolution", Le Temps d'un Bivouac, France Inter, 21 août 2019
- Cyril Langlois, « Le développement de la végétation continentale de l'Ordovicien au Dévonien et ses conséquences géologiques », sur planet-terre.ens-lyon.fr,
- Portail origine et évolution du vivant