Protéine transmembranaire
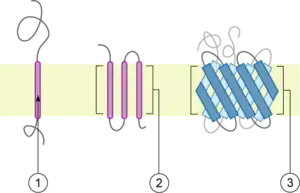
Une protéine est dite transmembranaire lorsqu’elle traverse au moins une fois entièrement la membrane cellulaire. Il existe donc trois environnements de composition différente en contact avec la protéine : le milieu extracellulaire, les lipides de la membrane, le cytosol. Chacun de ces trois environnements a une influence sur la structure de la protéine. Les acides aminés qui composent la partie transmembranaire sont hydrophobes tandis que les acides aminés qui composent les parties extracellulaire et intracytosolique sont hydrophiles.
Ces protéines ont des fonctions variées, mais la principale est de convoyer une information depuis le milieu extérieur vers le milieu intérieur, la transduction du signal biologique. Il existe un cas où la cellule communique avec d’autres cellules par le biais de telles protéines. Il s’agit de la cellule immunitaire qui, ayant phagocyté un élément extérieur (virus, bactérie…), expose sur sa surface membranaire plusieurs peptides issus des protéines de l’élément phagocyté. Cela constitue la phase d’exposition des antigènes, qui met en jeu une protéine dite présentatrice d’antigène.
Structure
Les protéines transmembranaires ou intrinsèques sont composées de 20 à 30 acides aminés hydrophobes et présentent le plus souvent une structure en hélice alpha. Ces protéines transmembranaires présentent de nombreuses interactions avec les phospholipides dues à des liaisons ioniques entre têtes polaires et liaisons hydrophobes.
Plusieurs contraintes structurales sont imposées aux protéines de cette classe, principalement à cause du contact avec trois milieux de composition physico-chimique différente. Si les milieux extracellulaire et intracellulaire sont deux solutions ioniques aqueuses de force ionique comparable, ils diffèrent sur quelques points. En particulier, le pouvoir réducteur du milieu intracellulaire est tel que les ponts disulfures ne peuvent exister dans la portion cytoplasmique de la protéine. Le pouvoir réducteur du milieu intracellulaire est conféré par la présence de glutathion, absent du milieu extracellulaire, qui brise les ponts disulfures qui pourraient se former entre deux cystéines. Le milieu extracellulaire est plutôt oxydant du fait de l’absence de cette molécule et les ponts disulfures sont possibles.
La partie extracellulaire possède souvent des molécules de sucre complexes, ajoutées de façon post-traductionnelle au sein de l’appareil de Golgi. Il n’existe jamais de sucre attaché à la protéine du côté cytosolique.
Mais la contrainte la plus importante apportée aux protéines transmembranaires demeure la membrane cellulaire, milieu fortement apolaire et hydrophobe.
Voir aussi
- Portail de la biologie cellulaire et moléculaire