Primates
Les primates (Primates Linnaeus, 1758) – du latin primas, -atis, signifiant « celui qui occupe la première place » – constituent un ordre se situant au sein des mammifères placentaires. Ce clade regroupe les petits singes et les grands anthropoïdes, ainsi que les espèces de strepsirrhiniens comme les lémuriens. Selon la classification phylogénétique actuelle, ils sont regroupés dans le clade intermédiaire des Euarchontoglires avec les lapins, Tupaiidae ou Dermoptera.
« Primate » redirige ici. Pour le film, voir Primate (film).

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Super-classe | Tetrapoda |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Placentalia |
| Super-ordre | Euarchontoglires |
Sous-ordres de rang inférieur
On divise aujourd'hui les primates en deux clades : celui des strepsirrhiniens, auquel appartiennent les lémurs, et celui des haplorrhiniens, auquel appartiennent les tarsiiformes et les simiiformes, qui comprennent, entre autres, les hominidés[1],[2] dont fait partie l'être humain.
Les premiers primates vivaient dans les arbres des forêts tropicales, et ils possèdent encore de nombreuses adaptations à la vie dans cet environnement tridimensionnel. Presque tous sont au moins encore en partie arboricoles.
À l'exception des humains modernes, qui habitent tous les continents, la plupart des primates vivent dans des régions tropicales ou subtropicales d'Amérique, d'Afrique et d'Asie[3]. Leur poids varie de 30 g pour le Microcèbe de Mme Berthe à 200 kg pour le gorille des montagnes. Selon les découvertes de fossiles, les ancêtres primitifs des primates peuvent être apparus à la fin du Crétacé il y a environ 66 millions d'années, le plus ancien primate connu étant Teilhardina à la fin du Paléocène, vers 55 à 58 millions d'années[4]. Les études d'horloge moléculaire suggèrent que les primates sont peut-être encore plus anciens, étant apparus au milieu du Crétacé supérieur il y a environ 85 millions d'années[4].
Considérés comme des mammifères généralistes, les primates présentent un large éventail de caractéristiques. Certains primates (notamment certains grands singes et les babouins) sont plus terrestres qu'arboricoles, mais toutes les espèces possèdent des adaptations pour grimper aux arbres. Les techniques de déplacement utilisées comprennent le saut d'arbre en arbre, la marche sur deux ou quatre membres, la locomotion sur les articulations et le balancement entre les branches des arbres (connu sous le nom de brachiation). Les primates sont caractérisés par un grand cerveau par rapport à d'autres mammifères, ainsi qu'un recours accru à la vision stéréoscopique, au détriment de l'odorat, le système sensoriel dominant chez la plupart des mammifères. Ces caractéristiques sont plus développées chez les vrais singes et nettement moins chez les loris et les lémuriens. La vision trichromatique s'est développée chez certains primates. La plupart ont aussi des pouces opposables et certains ont des queues préhensiles. De nombreuses espèces présentent un dimorphisme sexuel, ce qui signifie que mâles et femelles diffèrent par des traits physiques, comme la masse corporelle, la taille des canines et la coloration. Les primates ont une vitesse de croissance plus lente que les autres mammifères de taille similaire et atteignent la maturité plus tard mais ont une durée de vie plus longue. Selon les espèces, les adultes peuvent vivre seuls, en couples ou dans des groupes allant jusqu'à des centaines de membres.
Les primates non-humains accusent un déclin très important au cours du XXIe siècle en raison des activités humaines et notamment du réchauffement climatique. Selon une vaste étude de 2017, 60 % des espèces de primates non-humains sont en danger d’extinction d'ici 2040 à 2070[5].
Dans leur livre Classification phylogénétique du vivant (tome 2) de 2017, Lecointre et Le Guyader dénombrent 414 espèces[6].
Étymologie et adoption du terme
Le nom primate (du latin primas, atis, « premier » car c'est le nom donné par Linné à son premier ordre de la classe des mammifère qui intègre les humains considérés à son époque comme le sommet de l'échelle des êtres selon l'ordre divin) apparaît en 1758 dans la dixième édition (en) du Systema Naturae de Linné, vaste ouvrage qui s'efforce de classer l'ensemble des espèces vivantes selon leurs proximités anatomiques. Dans les éditions précédentes de son œuvre, Linné nommait ce nouvel ordre « Anthropomorpha », pour souligner qu'il s'agissait d'animaux dont le comportement et la morphologie ressemblaient à ceux de l'humain (anthropomorphisme). Linné divise le groupe des primates en quatre genres : Homo (les humains), Simia (les singes), Lemur, et Vespertilio (les chauves-souris)[7].
En 1779, l'anthropologue allemand Johann Friedrich Blumenbach, dans sa première édition Handbuch der Naturgeschichte (« Manuel d'histoire naturelle »), est le premier à faire des chauve-souris un ordre distinct, les chiroptères. De plus, il y fait des humains un ordre à part, les bimanes qu'il oppose à celui des quadrumanes (singes et lémuriens). Cet ostracisme anthropocentrique permet ainsi de distinguer l'humain, singularité biologique culturellement essentielle pour les philosophes Rousseau et Diderot ou les naturalistes Cuvier ou Daubenton[8].
Cette division de Blumenbach est acceptée par la majorité des zoologistes jusqu'aux travaux de Thomas Henry Huxley et Charles Darwin des années 1860 qui proposent de replacer l'humain dans le groupe des primates. La classification linnéenne des primates est ainsi adoptée et complétée à la fin du XIXe siècle, à la différence près que les chauves-souris n'en font plus partie[9].
Caractéristiques
| Formule dentaire | |||||||
|---|---|---|---|---|---|---|---|
| mâchoire supérieure | |||||||
| 3 | 4 | 1 | 2 | 2 | 1 | 4 | 3 |
| 3 | 4 | 1 | 2 | 2 | 1 | 4 | 3 |
| mâchoire inférieure | |||||||
| Total : 40 | |||||||
| Denture des premiers primates[note 1] (diversifiée depuis). | |||||||


Les primates sont généralement caractérisés par :
- une vie arboricole ;
- le museau réduit et la formation d'une face réduite mais prognathe. La tendance évolutive vers la disparition du museau et la régression du prognathisme facial est liée à la réduction de l'appareil olfactif au profit du système tactile et visuel (adaptation à la vie arboricole diurne grâce à des mains et pieds préhensiles et le développement d'aires visuelles assurant une vision binoculaire stéréoscopique et une meilleure coordination dans l'obscurité de la forêt[10]), à l'évolution de l'appareil masticatoire (régression des canines et épaississement de l'émail avec un régime alimentaire non plus exclusivement insectivore mais de plus en plus omnivore : fruits, jeunes pousses, noix, insectes présentant une taille et une consistance très variées, etc.)[11]. Cette convergence oculaire a pour conséquence une perte en ampleur du champ visuel complet, les primates ayant plus de peine à détecter un prédateur qui arrive par derrière. Ce risque de prédation, associé à d'autres facteurs écologiques (régime alimentaire, dispersion des sources de nourriture) semblent être des pressions sélectives déterminantes à l'origine de la formation de groupes sociaux chez les primates (comportement de vigilance et défense active avec des cris d'alarme)[12] ;
- une seule paire de mamelles se développant à une seule extrémité de la crête mammaire, dans la région pectorale. La réduction du nombre de paires chez les mammifères correspond à un nombre plus faible de petits de la portée[13]. Dans les espèces à mamelles nombreuses, on trouve les glandes mammaires réparties dans trois régions (pectorale, abdominale et inguinale)[14] ;
- le remplacement des griffes par des ongles plats (onguiculés chez la plupart des espèces, à l'exception des Callitrichinae), l'aptitude à la préhension par l'utilisation de la queue (sa réduction affecte un certain nombre de genres) ou des mains/pattes (grâce au pouce opposable : pouce de la main, dit pollex, toujours opposable ; pouce du pied, dit hallux, à pseudo-opposabilité à l'exception des humains) : chez certains, les os du radius et du cubitus sont très mobiles l'un par rapport à l'autre, permettant des mouvements sophistiqués (supination et pronation) de la main ;
- un pénis pendulaire et des testicules protégés par un scrotum ;
- des membres antérieurs et postérieurs pentadactyles qui ont gardé le schéma tétrapode des membres chiridiens et qui ont des coussinets tactiles ridés sous les doigts (dermatoglyphes). Le membre antérieur est mobile grâce à la clavicule ;
- la colonne vertébrale qui comprend de 26 à 33 éléments ;
- une denture de type diphyodonte et hétérodonte, avec des molaires multituberculées, issue de la perte d'une incisive et d'une prémolaire par rapport à la denture mammalienne primitive ;
- une vulve dissociant l'urètre et le vagin, complètement séparés, ainsi qu'un utérus ne possédant qu'une corne, qu'un corps et un col mais toujours avec deux trompes : utérus simplex ;
- une prédominance de la vision sur l'olfaction : les orbites oculaires orientées vers l'avant (frontalisation des orbites avec barre[note 2] et cloison post-orbitaire) caractérisent une vision binoculaire stéréoscopique, et le développement du lobe occipital du cerveau montre la prédominance de la vue sur les autres sens ;
- un appareil auditif avec une cavité tympanique qui s'enfouit dans l'os pétreux (ou rocher) à partir duquel se forme la bulle tympanique[note 3] ;
- un allongement des différentes phases de vie, notamment la période de gestation et de vie postnatale, ce qui entraîne un investissement parental plus important et un apprentissage par les structures sociales ;
- une maturité sexuelle tardive.
La présence d'un cerveau plus développé que chez la plupart des autres mammifères est souvent avancée comme caractéristique de ce groupe mais elle n'est vérifiée que pour la super-famille des hominoïdés. Elle est en outre partagée par d'autres taxons. À ces traits s'ajoute la locomotion bipède, permanente chez l'humain, partielle et à des degrés divers chez les autres hominidés.
Le primatologue Frans de Waal a démontré que de nombreuses émotions, allant du deuil à la joie, sont identiques chez les primates et chez les humains[15].
Structures et organisations sociales
La diversité des systèmes sociaux (structures et organisations sociales) chez les primates découle de différents facteurs de sélection sexuelle, de coercition sexuelle (en)[16] et de conditions écologiques (ressources alimentaires, prédateurs, parasites et congénères) : quelques espèces sont solitaires à territoires chevauchants[17] et quelques autres forment des couples (monogamie sexuelle à la carte, séquentielle ou sociale)[18], ces modes de vie étant favorisés par la dispersion des ressources alimentaires. Les zones à forte concentration en ressources alimentaire favorisent le regroupement de la majorité des primates en : harems (en) polygynes[19] (groupes uni-mâle multi-femelles)[20], harems polyandres[21] (groupes uni-femelle multi-mâles)[22], des bandes de mâles célibataires (groupes multimâles), des bandes de femelles célibataires (groupes multifemelles constitués que des femelles et leurs enfants)[23], et des groupes multisexués[24] (sociétés multifemelles/multimâles polygynandres centrées sur les mâles ou les femelles)[25].
Chez certaines espèces (chimpanzés, atèles), les groupes ont une dynamique de fission-fusion[25].
Taille et poids
| Espèce | Femelle | Mâle |
|---|---|---|
| Gorille | 105 kg | 205 kg |
| Orang-outan | 100 kg | 180 kg |
| Humain | 62,5 kg | 78,4 kg |
| Patas | 5,5 kg | 10 kg |
| Nasique | 9 kg | 19 kg |
| Ouistiti pygmée | 120 g | 140 g |
Leur taille varie entre 13 cm (chirogale mignon, Microcebus murinus) et 175 cm, pour une masse allant de 100 g jusqu'à 275 kg (gorille, Gorilla gorilla).
En , une étude parue au Journal of Human Evolution indique la découverte d'une nouvelle espèce de primate Simiolus de l'époque du Miocène. Selon les chercheurs ayant participé à cette étude, cette espèce de primate serait, en l'état actuel des recherches, le plus petit primate découvert à ce jour[26].
Régime alimentaire
Les primates ont des spécialisations anatomiques, notamment au niveau des dents, qui déterminent des régimes alimentaires variés : les insectivores et folivores (généralement consommant des feuilles tendres) qui privilégient des sources alimentaires qui leur apportent des acides aminés, des vitamines et des minéraux, ont des crêtes dentaires plus développées que les frugivores dont l'alimentation à base de fruits leur fournit une source de glucides et de lipides facilement digestibles et riches en énergie[27].
La population ancestrale des Hominidae vivait probablement en forêt dense (de type tropical humide voire tropical) dans la canopée leur fournissant des feuilles tendres et des fruits disponibles toutes l'année, les humains modernes s'étant spécialisés vers une nourriture plus coriace caractéristique des mauvaises saisons[28].
Physiologie
Il n'existe des hormones de grossesse gonadotropines chorioniques que chez les équidés et les primates (chez l'espèce humaine, il s'agit de la hCG pour human Chorionic Gonadotropin).
Distribution géographique
À l'exception de l'être humain anatomiquement moderne, présent sous tous les climats, et de certains macaques, les primates actuels se trouvent essentiellement dans les régions équatoriales, tropicales ou subtropicales. En Amérique, on trouve des primates du nord du Mexique jusqu'au sud de l'Argentine. En Afrique, on les trouve essentiellement au sud du Sahara. À Madagascar se sont développées des espèces endémiques de strepsirrhiniens (telles que les lémurs). En Asie, on trouve des primates en Arabie, dans le Sous-continent indien, en Chine, au Japon et en Asie du Sud-Est. La limite est de leur expansion est Sulawesi et le Timor.
Dans les autres régions, il se trouve peu de primates en liberté (hormis les Homo sapiens). Les quelques espèces présentes, comme les rhésus en Floride et les magots à Gibraltar ont été introduites par les humains.
Structures sociales
Les sociétés de primates sont extrêmement variées : ces animaux peuvent vivre isolés, en groupes permanents ou en groupes temporaires.
Les êtres humains et les autres grands singes semblent partager une dimension sociale unique : la culture. Différents auteurs ont montré que certains grands singes tels que les chimpanzés pouvaient partager des particularités culturelles, des pratiques apprises et non pas innées, transmises à l'intérieur d'un groupe mais inconnues en dehors de celui-ci[29],[30]. Cela ouvre la porte à une évaluation intéressante des structures sociales des primates en rapprochant l'humain des autres grands singes.
Origine
Les animaux les plus proches des primates sont les dermoptères, qui appartiennent comme eux au clade des euarchonta. Les euarchonta dans leur ensemble sont assez proches des glires (lapin, lièvres, rongeurs, etc.) avec lesquels ils forment le clade des euarchontoglires.
└─o Euarchontoglires ├─o Anagalida dont les glires └─o Euarchonta ├─o Scandentia └─o ├─o Dermoptera └─o Primatomorpha : Plesiadapiformes†* puis Primates * paraphylétiques
On peut supposer que les primates se sont constitués en groupe distinct voici environ, selon l'approche retenue, 85 millions d'années - datation selon la méthode de l'« horloge moléculaire »[31], ou 65 millions d'années - analyse classique des paléontologues. Précisons que la recherche du dernier ancêtre commun est discutée : le Purgatorius, qui date d'environ 70 millions, n'est peut-être pas un primate, et les plus anciens fossiles relevant indiscutablement du clade des primates sont des adapidés[32] vieux de 55 millions d'années (Donrusselia et Cantius).
Subdivisions
Les primates constituent le groupe de mammifères le plus riche en espèces après les rongeurs et les chauves-souris[33].
Phylogénie
La phylogénie du groupe, autrement dit la formation et le développement des espèces, est bien établie et sa structure est relativement bien connue.
Primates ├───Strepsirrhini │ ├──Lemuriformes │ │ ├──Daubentoniidae │ │ │ │ │ └──Lemuroidea │ │ ├──Cheirogaleidae │ │ ├──Lepilemuridae │ │ └──N.N. │ │ ├──Indriidae │ │ └──Lemuridae │ │ │ └──Lorisiformes │ ├──Lorisidae │ └──Galagonidae │ └──Haplorrhini │ ├──Tarsiiformes │ └──Simiiformes ├──Platyrrhini │ ├──Pitheciidae │ └──N.N. │ ├──Atelidae │ └──N.N. │ ├──Callitrichidae │ └──N.N. │ ├──Aotidae │ └──Cebidae │ └──Catarrhini ├──Cercopithecoidea │ └──Cercopithecidae │ └──Hominoidea ├──Hylobatidae └──Hominidae
Classification
Selon BioLib (4 décembre 2018)[34] :
- sous-ordre Haplorrhini Pocock, 1918
- infra-ordre Simiiformes
- infra-ordre Tarsiiformes
- sous-ordre Micromomyiformes †
- sous-ordre Plesiadapiformes Simons & Tattersall, 1972 †
- sous-ordre Strepsirrhini E. Geoffroy, 1812
- infra-ordre Adapiformes Hoffstetter, 1977 †
- infra-ordre Chiromyiformes
- infra-ordre Lemuriformes
- infra-ordre Lorisiformes
 Différents singes (Simiiformes)
Différents singes (Simiiformes) Un tarsier (Tarsiiformes)
Un tarsier (Tarsiiformes).jpg.webp) Un Aye-aye, l'unique Chiromyiformes
Un Aye-aye, l'unique Chiromyiformes_(7620904288).jpg.webp) Un lémurien Indri indri (Lemuriformes)
Un lémurien Indri indri (Lemuriformes) Un loris (Lorisiformes)
Un loris (Lorisiformes)
Le sous-ordre des strepsirrhiniens
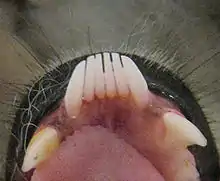
Le sous ordre des strepsirrhiniens correspond aux lorisiformes (comme les loris) et aux lémuriformes (comme les lémurs). Ils sont arboricoles, souvent nocturnes et insectivores (caractères primitifs ancestraux).
D'une manière générale, ce sont des vertébrés munis d'une queue recouverte de fourrure, d'un museau et d'yeux ronds. Ils ont 5 doigts aux mains et aux pieds. La caractéristique principale qui les distingue des autres primates est la présence d'un « peigne dentaire » à l'avant de leur denture : c'est un ensemble de 6 dents constitué des 4 incisives et des 2 canines, toutes allongées et orientées vers l'avant ; il sert à récupérer la gomme des arbres dont ils se nourrissent, mais également à l'épouillage.
Les lorisiformes
Les lorisiformes constituent l'un des deux infra-ordres des strespisrrhiniens : de petite taille, rencontrés en Afrique et en Asie, ils regroupent les familles suivantes :
- Cheirogaleidae, vivant à Madagascar et ressemblant plus à des écureuils qu'à des singes. La position de cette famille varie suivant les auteurs, tantôt parmi les lorisiformes, tantôt parmi les lémuriformes comme dans la révision taxonomique proposée par J. G. Fleagle en 1999[35].
- Galagidae, vivant en Afrique, comportant le genre Galago.
- Loridae, vivant en Afrique et en Asie (genres Loris, Nycticebus, Perodicticus et Arctocebus).
Les lémuriformes

Les lémuriformes constituent l'autre infra-ordre : ils vivent tous à Madagascar, qu'ils ont colonisée en l'absence d'autres primates plus compétitifs. On les classe en diverses familles :
- Lemuridae (Lémuridés), comportant notamment le maki.
- Indriidae, aux membres postérieurs plus développés que les antérieurs (indri, avahi, sifaka).
- Megaladapidae, famille représentée par le genre Lepilemur.
- Daubentoniidae : un seul genre et une seule espèce, l'aye-aye.
Les haplorrhiniens
Les haplorrhiniens regroupent les singes (ou simiiformes) et les tarsiers.
Les singes
.jpg.webp)
Parmi les singes, on distingue :
- les platyrhiniens ou singes du Nouveau Monde, originaires d'Amérique centrale et du Sud : ils ont les narines écartées, une queue longue et préhensile. Ils possèdent presque tous 36 dents. Ils se divisent eux-mêmes en trois familles :
- les cébidés, famille à laquelle appartiennent le sapajou, l'atèle (ou singe-araignée), le singe-laineux et le singe-hurleur.
- les callithrichidés, avec notamment les tamarins et les ouistitis.
- les pithéciidé (Mivart, 1865) - famille récemment individualisée avec deux sous-familles les Callicebinae et les Pitheciinae, auparavant genres des cébidés.
Comme pour les lémuriens, l'origine des singes du Nouveau Monde n'est pas claire. Les études moléculaires de séquences nucléaires concaténées ont donné une période de divergence entre platyrrhiniens et catarrhiniens très variable, allant de 33 à 70 millions d'années, tandis que les études basées sur des séquences mitochondriales donnent une période plus étroite de 35 à 43 millions d'années[4],[36]. Il est possible que les platyrhiniens aient traversé l'océan Atlantique d'Afrique en Amérique du Sud à l’Éocène en passant d'île en île, passage facilité par des dorsales de l'océan Atlantique et une baisse du niveau des mers[37]. Une autre hypothèse, une seule traversée en rafting pourrait aussi expliquer cette colonisation transocéanique. En raison de la tectonique des plaques, l'océan Atlantique n'était pas aussi large qu'aujourd'hui à l'époque[37]. Les études suggèrent qu'un petit primate d'environ 1 kg aurait pu avoir survécu 13 jours sur un radeau de végétation[38]. Compte tenu des vitesses estimées des courants et des vents, cela aurait suffi pour faire le voyage entre les continents.
- les catarhiniens ou singes de l'Ancien Monde : ils ont les narines rapprochées, jamais de queue préhénsile, voire pas de queue visible mais seulement des vertèbres caudales vestigiales soudées (coccyx). Ils possèdent 32 dents. Ils se divisent eux-mêmes en deux super-familles :
- celle des cercopithécoidés qui comprend les cercopithécinés (cercopithèques, macaques, babouins) et les colobinés (notamment le nasique).
- celle des hominoïdes qui comprend les hylobatidés (gibbons) et les hominidés, qui correspondent à ce qu'on appelle souvent les grands singes (le chimpanzé commun, le gorille, l'orang-outan et l'humain).
Les tarsiers
Les tarsiers, considérés autrefois comme des prosimiens[39], appartiennent au clade des haplorrhiniens : ils ne possèdent pas de rhinarium mais leurs facultés olfactives sont meilleures que celles des catarhiniens.
Enjeux éthiques et politiques

Le fait que l'humain fasse partie de l'ordre des primates donne à ce groupe d'animaux un caractère particulier. Cette idée est défendue par exemple par Peter Singer, l'auteur du Projet grands singes visant à reconnaître un statut spécial pour les singes anthropomorphes[40]. Peter Singer voudrait en effet accorder certains droits aux grands singes (les plus proches de l'humain génétiquement) et ainsi créer, comme pour l'humain avec sa charte des Droits de l'homme, une charte définissant les droits des primates. Ce point de vue est lié au mouvement de « libération animale » ; dans le même ordre d'idées, on peut citer le documentaire Koko, le gorille qui parle (1978) de Barbet Schroeder, mettant en scène un gorille à qui l'on apprend la langue des signes, et qui se met à inventer des mots en accolant des mots déjà appris. Ce débat est l'un des plus houleux du moment, car certains gradistes voient cela comme un "rabaissement" de l'humain au niveau des autres primates, ce qui pose certaines questions quant à la nature profonde de l'humain et notamment dans les questions abordées : finalement qu'est-ce qu'un humain ? L'humain peut-il lui-même définir l'humain ? Ce sont des questions plus philosophiques, et qui entraînent divers problèmes éthiques.
Déclin et protection
Déclin lié aux activités humaines

Si l’ordre des primates n’a connu aucune extinction au cours du XXe siècle, quatre espèces de grands singes sur six sont proches de la disparition selon la mise à jour de l'Union internationale pour la conservation de la nature de 2016[33]. Selon une étude publiée dans Science Advances en , la plus vaste jamais conduite, dressée par 31 primatologues internationaux, 60 % des espèces de primates sont en danger d’extinction d'ici 25 à 50 ans en raison d’activités humaines, et 75 % des populations accusent déjà un déclin[33].
Les habitats des primates disparaissent sous la pression de l’agriculture (qui affecte 76 % des espèces), de l’exploitation forestière (60 %), de l’élevage (31 %), de la construction routière et ferroviaire, des forages pétroliers et gaziers et de l’exploitation minière (de 2 % à 13 %)[33]. La chasse et le braconnage touchent directement 60 % des espèces[33].
Les changements climatiques causés par les humains entraînent des changements dans l’ampleur et l’intensité des phénomènes météorologiques extrêmes. Les ouragans et les sécheresses sont des exemples de tels événements. Ces événements ont un impact considérable sur la population mondiale de primates. Une étude de 2019 montre que 16% des taxons de primates sont vulnérables aux cyclones, en particulier à Madagascar, et 22% à la sécheresse, en particulier aux taxons de la péninsule malaisienne, du nord de Bornéo, de Sumatra et des forêts tropicales humides de l'Afrique de l'Ouest[41].
Protection
Toutes les espèces de primates, hormis l'humain, sont inscrites à l'annexe II ou pour les plus menacées à l'annexe I de la CITES.
Pour remédier à leur déclin, les auteurs de l'étude de Sciences Advances appellent à associer les populations locales à la gestion des forêts, à lutter contre leur pauvreté, à limiter la croissance démographique, à agir pour la reforestation et pour l’expansion des zones protégées[33].
Notes et références
Notes
- Attestée chez les Adapiformes et les Omomyiformes primitifs.
- Jonction des os frontal et zygomatique.
- L'ectotympanique (en) est également un caractère discriminant : soudé à la bulle tympanique chez les lorisiformes, suspendu à la bulle tympanique chez les lémuriformes, allongé en conduit externe chez les tarsiiformes.
Références
- « Phylogénie des primates », sur http://www.whozoo.org/ (consulté le )(en)
- Note : voir aussi l'arbre complet dans l'article Primates (classification phylogénétique)
- (en) Primate : Encyclopædia Britannica Online, Encyclopædia Britannica, Inc., (lire en ligne)
- Helen J. Chatterjee, Simon Y.W. Ho, Ian Barnes et Colin Groves, « Estimating the phylogeny and divergence times of primates using a supermatrix approach », BMC Evolutionary Biology, vol. 9, , p. 259 (PMID 19860891, PMCID 2774700, DOI 10.1186/1471-2148-9-259)
- (en) Alejandro Estrada, Paul A. Garber, Anthony B. Rylands et Christian Roos, « Impending extinction crisis of the world’s primates: Why primates matter », Science Advances, vol. 3, no 1, , e1600946 (ISSN 2375-2548, PMID 28116351, PMCID PMC5242557, DOI 10.1126/sciadv.1600946, lire en ligne, consulté le )
- « La classification phylogénétique du vivant – Tome 2 – 4e édition », sur Belin Editeur (page 527), (consulté le )
- Carl von Linné, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonimis locis, tome I, Impensis L. Salvii, , p. 20-32
- Claude Blanckaert, Michel Porret et Fabrice Brandli, L'encyclopédie méthodique (1782-1832). Des lumières au positivisme, Librairie Droz, , p. 76
- (en) J. David. Archibald, Aristotle's Ladder, Darwin's Tree. The Evolution of Visual Metaphors for Biological Order, Columbia University Press, (lire en ligne), p. 105
- La migration des orbites vers l'avant assure en outre une meilleure vision binoculaire stéréoscopique. Il existe cependant au sein des primates une grande variabilité sur le degré de convergence orbitale et la taille du champ binoculaire mais il semble que cette convergence et la vision binoculaire correspondent aux ancêtres des primates. Ces derniers étaient des insectivores avec cette vision adaptée pour mieux discerner le camouflage de leurs proies habitant un environnement nocturne. D'après (en) Callum F.Ross, « Allometric and functional influences on primate orbit orientation and the origins of the anthropoidea. J Hum Evol 29: », Journal of Human Evolution, vol. 29, no 3, , p. 201–227 (DOI 10.1006/jhev.1995.1057).
- Robert Boyd, Joan Silk, L'aventure humaine. Des molécules à la culture, De Boeck Supérieur, , p. 264.
- (en) Lynne A. Isbell, « Predation on primates: Ecological patterns and evolutionary consequences », Evolutionary Anthropology, vol. 3, no 2, , p. 61-71 (DOI 10.1002/evan.1360030207).
- Chez la chienne et la souris, il existe deux chaînes mammaires comportant chacune cinq mamelles, deux paires chez la vache et la chamelle, trois paires chez la musaraigne et l'ourse, quatre paires chez la chatte, cinq à huit chez la truie, mais une seule paire chez la plupart des grands mammifères (éléphant, rhinocéros, jument, hippopotame, cétacés), chez la chèvre, la brebis et les siréniens. D'après Alain Froment, Anatomie impertinente. Le corps humain et l’évolution, Odile Jacob, , p. 178.
- Robert Barone, Anatomie comparée des mammifères domestiques, Vigot, , p. 423.
- « Ce que révèle le grand tabou des émotions animales », sur Les Inrocks,
- « La coercition sexuelle se définit comme l'usage de la menace ou de la force par un mâle dans le but d'accroître ses chances de copuler avec une femelle lorsqu’elle devient fertile et de réduire ses chances qu'elle copule avec d'autres mâles, au risque pour la femelle d’en subir un coût ». L'intensité de la coercition masculine chez les primates n'est pas liée au type d'habitat ou au degré de dimorphisme sexuel, mais à l'asymétrie dans l'investissement reproductif, qui incombe de plus en plus aux femelles du fait de l'anisogamie. Cf (en) B. B. Smuts & R. W. Smuts, « Male aggression and sexual coercion of females in nonhuman primates and other mammals: Evidence and theoretical implications », Advances in the Study of Behavior, vol. 22, no 1, , p. 2-3 (DOI 10.1016/S0065-3454(08)60404-0).
- Galagos, orangs-outans
- Indris, gibbons.
- Il peut s'agir « de harems avec des femmes apparentées (harem sororal), de harems sous surveillance active ou de harems très coercitifs avec isolement et séquestration (gynécée). »
- Semnopithèque entelle, gorilles.
- Le harem fraternel est une « structure polyandre composée d'une femme et de plusieurs hommes qui sont frères ou liés par de fortes affinités de parenté ».
- Tamarin empereur, ouistitiss.
- Plusieurs espèces de microcèbes (le plus petits primates vivants) mais les femelles fourragent en solitaire.
- Sociétés pouvant être caractérisées par une philopatrie et une hiérarchie de dominance : Chimpanzés, Bonobos, Babouins hamadryas et Géladas.
- Pascal Picq, Et l'évolution créa la femme, Odile Jacob, (lire en ligne), n.p.
- (en) James B. Rosie et Andrew Hill, « A new species of Simiolus from the middle Miocene of the Tugen Hills, Kenya » (consulté le ).
- (en) Richard F Kay, William L Hylander, « The dental structure of mammalian folivores with special reference to Primates and Phalangeroidea (Marsupialia) », The ecology of arboreal folivores, , p. 173-191
- (en) K. Milton, « Diet and Primate Evolution », Scientific American, vol. 269, no 2, , p. 86–93 (DOI 10.1038/scientificamerican0893-86)
- A. Whiten, J. Goodall, W.C. McGrew, T. Nishida, V. Reynods, Y. Sugiyama, C.E.G. Tutin, R.W. Wrangham et C. Boesch (1999) - « Cultures in chimpanzees », Nature, 399, p. 682-685.
- A. Whiten et Ch. Boesch, « La culture des chimpanzés », in Sur les traces de nos ancêtres, dossier Pour la Science, pages 43 à 49, octobre-décembre 2007
- S. Tavaré, C.R. Marshall, O. Will, C. Soligo et R.D. Martin « Using the fossil record to estimate the age of the last common ancestor of extant primates », Nature, 416, p. 726-729, 18 avril 2002. (résumé en anglais)
- Voir pour le moment l'article en anglais Adapid(en)
- Audrey Garric, « Les singes pourraient disparaître d’ici vingt-cinq ans à cinquante ans », sur lemonde.fr, (consulté le ).
- BioLib, consulté le 4 décembre 2018
- J.G. Fleagle, Primate Adaptation and Evolution, Academic Press: New York, 1999.
- (en) Carlos G. Schrago and Claudia A. M. Russo, « Timing the Origin of New World Monkeys », Molecular Biology and Evolution, vol. 20, no 10, , p. 1620–1625 (PMID 12832653, DOI 10.1093/molbev/msg172, lire en ligne [PDF])
- Bill Sellers, « Primate Evolution » [PDF], University of Edinburgh, (consulté le ), p. 13–17
- (en) Houle, A., « The origin of platyrrhines: An evaluation of the Antarctic scenario and the floating island model », American Journal of Physical Anthropology, vol. 109, no 4, , p. 541–559 (PMID 10423268, DOI 10.1002/(SICI)1096-8644(199908)109:4<541::AID-AJPA9>3.0.CO;2-N)
- Malgré les analyses rapprochant ceux-ci des simiens, certains travaux récents classent encore le tarsier parmi les prosimiens. Voir Schwartz JH. 1986, Primate systematics and a classification of the order, in: Swindler DR. Erwin J. editors, Comparative Primate Biology I. Systematics, Evolution, and Anatomy, New York, Alan R. Liss, p. 1-42.
- Peter Singer et Paola Cavalieri, The Great Ape Project: Equality Beyond Humanity, Fourth Estate, London, 1993.
- Zhang, L., Ameca, E. I., Cowlishaw, G., Pettorelli, N., Foden, W., & Mace, G. M. (2019). Global assessment of primate vulnerability to extreme climatic events. Nature Climate Change, 9, 554–561. https://doi.org/10.1038/s41558-019-0508-7
Annexes
Articles connexes
- Histoire évolutive des primates
- Primates (classification phylogénétique)
- Liste détaillée des familles et genres de primates
- Liste des genres de primates par ordre alphabétique
- Liste alphabétique des noms vernaculaires de primates
- Liste des primates décrits par Carl von Linné
- Polygynandrie, Polygamie, Polyandrie, Polygynie, Polygamie, Polyamour, Monogamie
Romans liés au sujet
- Les Animaux dénaturés de Vercors
- Les Grands Singes de Will Self
- La Planète des singes de Pierre Boulle
- Évolution de Stephen Baxter
Bibliographie
- (en) Sharon Lisa Gursky, K. A. Kimberly Anne-Isola Nekaris, Primate Anti-Predator Strategies ; Springer, - 420 pages, (ISBN 978-0387348070).
Liens externes
- (en) Référence Fauna Europaea : Primates
- (fr+en) Référence ITIS : Primates Linnaeus, 1758
- (en) Référence Animal Diversity Web : Primates
- (en) Référence NCBI : Primates (taxons inclus)
- (en) Référence BioLib : Primates Linnaeus, 1758
- (en) Référence Catalogue of Life : Primates Linnaeus, 1758
- (en) Référence Mammal Species of the World (3e éd., 2005) : PRIMATES Linnaeus, 1758
- (en) Référence Tree of Life Web Project : Primates
- (en) Référence Paleobiology Database : Primates Linnaeus 1758
- (en) Référence uBio : Primates
- (en) Phylogénie des primates
- (en) Historique de la taxonomie des primates
- (en) EUPRIM-Net: European Primate Network
- Portail des primates
- Portail des mammifères
- Portail origine et évolution du vivant
- Portail de la zoologie