Posidonia oceanica
Posidonie de Méditerranée
.jpg.webp)
| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Liliopsida |
| Sous-classe | Alismatidae |
| Ordre | Najadales |
| Famille | Posidoniaceae |
| Genre | Posidonia |
| Clade | Angiospermes |
|---|---|
| Clade | Monocotylédones |
| Ordre | Alismatales |
| Famille | Posidoniaceae |

LC : Préoccupation mineure
La Posidonie de Méditerranée (Posidonia oceanica) est une espèce de plantes à fleurs aquatique de la famille des Posidoniaceae et endémique de la Mer Méditerranée[N 1]. Ce n'est pas une algue, bien qu'elle vive sous l'eau ; il s'agit d'une herbe marine, plante angiosperme monocotylédone sous-marine. Comme toutes les plantes à fleurs, elle a des racines, une tige qui est ici rhizomateuse, et des feuilles rubanées[N 2] mesurant jusqu'à un mètre de long et disposées en touffes de 6 à 7. Elle fleurit en automne et produit au printemps des fruits flottants communément appelés olive di mare (« olives de mer ») en Italie.
Elle forme de vastes herbiers entre la surface et 40 m de profondeur. Ces herbiers constituent l'écosystème majeur de Méditerranée et jouent un rôle important dans la protection des côtes contre l'érosion. C'est dans ces herbiers que beaucoup d'organismes, animaux et végétaux, trouvent protection et alimentation.
Morphologie


P. oceanica présente des racines qui servent principalement à ancrer la plante au substrat, des rhizomes et des feuilles rubanées.
Les rhizomes, dont le diamètre peut atteindre un centimètre, poussent soit horizontalement (rhizomes « plagiotropes »), soit verticalement (rhizomes « orthotropes »). Les premiers ancrent la plante au substrat grâce à la présence, à la face inférieure, de racines lignifiées longues de 15 cm au maximum. Les seconds, augmentant la hauteur, freinent l'ensablement dû à une sédimentation continue[1]. Ces deux types de développement de la plante forment les « mattes », formations à terrasse constituées de l'enchevêtrement de couches de rhizomes, racines et sédiments. De cette manière les posidonies colonisent un terrain difficilement occupé par les algues qui, n'ayant pas de racines, ne peuvent se fixer sur des substrats meubles.
Les feuilles naissent des rhizomes orthotropes et sont rubanées, de couleur vert brillant devenant brun avec le passage du temps. Elles peuvent atteindre une longueur d'un mètre et demi, sont larges d'un centimètre en moyenne, et présentent de 13 à 17 nervures parallèles. Les extrémités sont arrondies et épaisses en réponse à l'action des mouvements des vagues et courants.
Elles sont organisées en touffes de 6 ou 7 feuilles, avec les plus anciennes à l'extérieur protégeant les plus jeunes au centre. Ces feuilles peuvent se diviser en trois catégories[2] :
- feuilles adultes : présentent des feuilles laminées photosynthétiques et dans une base séparée du bord des feuilles, une ligule concave,
- feuilles intermédiaires : n'ont pas de base,
- feuilles jeunes : sont pour la plupart de moins de 50 mm.
En automne la plante perd ses feuilles adultes les plus à l'extérieur, qui deviennent brunes et photosynthétiquement inactives ; pendant l'hiver naissent les nouvelles feuilles au centre.
Reproduction
P. oceanica se multiplie selon deux modes : par reproduction sexuée ou par multiplication asexuée ou végétative.
Reproduction sexuée
La reproduction sexuée a lieu lors de la production des fleurs et des fruits. Les fleurs sont hermaphrodites, regroupées dans une inflorescence verte en forme d'épi appelée spadice et renfermées dans des bractées florales appelées spathes. Le pédoncule est attaché au rhizome au centre de la plante.
Le gynécée ou pistil est formé d'un ovaire uniloculaire continué d'un style terminé par un stigmate.
L'androcée est constitué de trois étamines à anthères courtes. Le pollen, contenu dans les anthères, est sphérique mais devient filamenteux aussitôt relâché dans l'eau[3]. Il n'existe pas de mécanisme de reconnaissance entre le pollen et le stigmate pouvant éviter l'autofécondation[4]. La pollinisation est hydrophile et peut aboutir à la croissance des fruits, quoique certains d'entre eux n'aboutiront pas à maturation, qui a lieu dans les six mois. Une fois mûrs, les fruits se détachent et flottent à la surface de l'eau.
Le fruit, peu charnu et communément appelé « oliva di mare » (« olive de mer ») en Italie, est similaire à une drupe, présentant un péricarpe poreux et riche d'une substance huileuse permettant la flottaison. En se décomposant, le fruit libère une unique graine (recouverte d'une fine membrane mais sans un véritable tégument[4]), qui, en coulant, germera si les conditions de profondeur et de fond le permettent. Pour qu'elle pousse, la plante doit avoir trouvé un substrat d'humus. La germination commence avec l'émission d'une petite racine blanche du côté supérieur et d'une petite feuille du côté inférieur. Ce type de reproduction permet à la plante de coloniser de nouvelles régions, et garantit la diversité génétique.
La floraison dépend de facteurs environnementaux (lumière et température) et endogènes (âge et taille de la plante). Elle a lieu à l'automne, en septembre et octobre dans les herbiers les plus proches de la surface de l'eau ; dans les herbiers les plus profonds elle est repoussée de deux mois environ.
La floraison ne se produit pas tous les ans, surtout dans les eaux plus fraiches du bassin occidental de la Méditerranée. Elle semble corrélée à des températures estivales élevées et une température de 20 °C en octobre. Certaines années ont ainsi été marquées par une floraison d'une intensité exceptionnelle, notamment les années 1971, 1982, 1993, 1997 et 2003[5].

Inflorescence de Posidonia oceanica
Automne 2009
Posidonia oceanica.
Floraison automne 2009.
Des fruits âgés de 1 mois sont déjà visibles
Fruits et graines de Posidonia oceanica 
Jeune plantule de Posidonia oceanica.
Fructification printemps 2009.
Des écailles de feuilles sont visibles, entre la graine et les jeunes feuilles vertes
Pour Charles-François Boudouresque, les rares floraisons massives de certaines années pourraient être une adaptation stratégique dite de « saturation du prédateur »[6].
Multiplication asexuée ou végétative

La multiplication asexuée s'effectue au moyen de stolons[7]. Pour Posidonia, il s'agit à plus proprement parler de rhizomes.
La multiplication asexuée qui permet l'expansion horizontale de l'herbier, se fait avec les rhizomes « plagiotropes », qui poussent d'environ 7 cm par an, colonisant ainsi de nouvelles zones. Une accumulation de sédiments et la diminution de l'espace permettant la pousse horizontale stimule la croissance verticale par pousse de rhizomes « orthotropes », formant ainsi des « mattes ».
Une autre forme de reproduction végétative par pseudo-viviparité a été observée en aux Iles Baléares[8] :
« Des plantules végétatives se forment directement sur les inflorescences et remplacent les organes de reproduction sexuée. Cette stratégie contribue à une dispersion à courte distance. On ignore, pour le moment, s'il s'agit d'un mode de reproduction très local, ou s'il concerne d'autres régions de Méditerranée. »
Matte
La croissance verticale des rhizomes mène à la formation d'une structure appelée « matte », constituée d'un enchevêtrement de rhizomes morts et de racines entre lesquelles est resté du sédiment. Seule la partie supérieure de cette structure est formée de plantes vivantes[7].
La formation des mattes dépend en grande partie des rythmes de sédimentation ; une haute vitesse de sédimentation peut mener à l'étouffement des rhizomes en les couvrant de sable ; au contraire, une sédimentation trop lente peut mener au détachement des rhizomes et donc à la régression de l'herbier[9]. Les rhizomes peuvent rester à l'intérieur des mattes pendant des milliers d'années parce que leur décomposition est très lente[1]. Les mattes elles-mêmes poussent très lentement ; leur croissance est estimée être d'un mètre par siècle[1].
Adaptation à la vie marine
Les Posidonies ont, comme toutes les Spermatophytes, évolué morphologiquement et physiologiquement pour leur permettre de vivre dans l'eau.
On voit dans beaucoup des organes des parenchymes facilitant l'échange de gaz partout dans la plante, et formant un fin « treillis » entre les feuilles, rhizomes et racines.
Les feuilles n'ont pas de stomates et ont une cuticule légère pour faciliter la diffusion d'ions et de dioxyde de carbone. Les Posidonies peuvent également absorber les nutriments par leurs feuilles.
Parfois les plantes vivent dans un substrat anoxique (manquant d'oxygène). C'est pour cette raison que les racines, en plus d'aider à l'ancrage de la plante et à sa nutrition, ont le rôle de réserve d'oxygène produit par photosynthèse des feuilles.
Évolution
Comme toutes les spermatophytes marines, P. oceanica a évolué à partir des Angiospermes qui poussaient dans des zones intermédiaires entre la terre et la mer et qui pouvaient donc mieux résister aux brèves périodes d'immersion dans l'eau. Quand la pollinisation anémogamique est devenue hydrophile, les plantes ont complètement abandonné la terre ferme.
Les premiers fossiles de posidonies, plus exactement de l'espèce appelée Posidonia cretacea, remontent au Crétacé (comme l'indique son nom), il y a 120 Ma, tandis que dans l'Éocène, il y a 30 Ma, apparaît la Posidonia parisiensis. La crise de salinité du Messinien, survenue il y a 6 Ma en Méditerranée, vit une baisse de la diversité génétique des Posidonia ; seules les espèces pouvant supporter la haute salinité y survécurent. Dans la réserve naturelle régionale des îles de Stagnone di Marsala on peut trouver des herbiers dans des zones de salinité allant jusqu'à 46-48 g/L[10].
Taxonomie
En 1735 Linné décrit l'espèce dans son Systema Naturae, l'appelant Zostera oceanica. En 1813 Delile la renomme en Posidonia oceanica. D'où le nom scientifique complet de Posidonia oceanica (Linnaeus) Delile selon la nomenclature binomiale.
Le genre Posidonia appartient, selon la plupart des botanistes, à la famille des Posidoniaceae, mais certains auteurs le rangent avec les Potamogetonaceae[11], ou avec les Najadaceae[12], ou encore avec les Zosteraceae[13]. La classification phylogénétique APG IV (2016) suggère l'inclusion de la famille des Posidoniaceae dans les Juncaginaceae [14]. L'ordre varie selon les classifications. Selon la classification classique, ce sont des Najadales et selon la classification APG II, les Posidoniaceae sont placées parmi l'ordre des Alismatales (cette classification considère également les deux ordres précédents synonymes)[15]. APG IV la maintient dans les Alismatales[14].
Elle tire son nom du dieu de la mer grec, Poséidon (Ποσειδών), tandis que « oceanica », épithète peu justifié, vient du fait que Linné ne connaissait cette plante qu'indirectement[16].
Une étude comparative des inflorescences de la plante, menée en 1998 sur deux régions de la Méditerranée, a conduit l'Institut d'Anatomie Comparée de l'Université de Gênes (Italie), à se questionner sur la taxonomie du genre Posidonia en Méditerranée[17]. L'étude est résumée comme suit :
« Le phénomène de la floraison de Posidonia oceanica n'a pas été souvent mentionné en Mer Ligure entre 1880 et 1990, alors que, récemment, des floraisons et des fructifications ont été observées chaque année. Des faisceaux portant des fleurs prélevés en 1994 dans l'herbier de Noli (Savona) pendant une importante floraison, ont permis de décrire la morphologie et d'analyser la morphométrie des inflorescences prélevées dans un site peu profond et dans un récif-frangeant. La comparaison avec des données morphométriques des inflorescences prélevées en Mer Égée a mis en évidence certaines différences morphologiques importantes du point de vue de la révision taxonomique du genre Posidonia en Mer Méditerranée. »
Distribution géographique
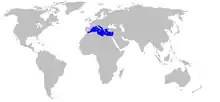
Cette espèce ne se trouve qu'en Méditerranée, occupant environ 3 % du bassin (correspondant à une superficie d'environ 38 000 km2), et étant une espèce clé de l'écosystème marin.
Un signe sans équivoque de la présence d'un herbier de Posidonia oceanica est la présence de feuilles en décomposition, dites « banquettes », sur la plage. Celles-ci jouent également un rôle dans la protection des plages contre l'érosion.

Selon la partie IV du Testo Unico Ambientale de l'Italie[18], les feuilles de Posidonie sur les plages sont considérées comme déchets solides et doivent donc être éliminées. Selon certains ces feuilles peuvent être utilisées comme compost, mais c'est interdit par la loi italienne 748/84[19], qui interdit l'usage d' « algues et plantes aquatiques » en compost[20].
On trouve également sur les plages, surtout en hiver, des « balles » marron composées de fibres de Posidonie formées par les vagues ; elles sont appelées egagropili en Italie, aegagropile sur les côtes méditerranéennes françaises.
Écologie

Posidonia oceanica vit entre 1 et 30 mètres de profondeur, et exceptionnellement jusqu'à 40 m dans des eaux très limpides. Elle peut supporter des températures allant de 10 à 28 °C. C'est une plante nécessitant une salinité relativement constante, ce qui la rend rare près des embouchures de cours d'eau ou des lagunes. Elle nécessite également une forte luminosité. Elle colonise les fonds sablonneux ou vaseux, et se fixe grâce à ses rhizomes qui courent sous le sable. Elle forme lentement de vastes herbiers à densité élevée (environ 700 plantes par mètre carré). La productivité primaire des feuilles des herbiers va de 68 à 147 g C.m−2.année−1, tandis que celle des rhizomes va de 8,2 à 18 g C.m−2.année−1. Une petite partie de cette productivité (de 3 à 10 %), est utilisée par les herbivores, un pourcentage plus élevé par les organismes décomposeurs et un autre pourcentage à l'intérieur des mattes, dans les feuilles et rhizomes[21].
Les herbiers présentent une limite supérieure et une limite inférieure. La première, là où commence l'herbier en partant de la côte, est plutôt nette, tandis que la seconde, où finit l'herbier, peut être de quatre types :
- Limite progressive et climatique : avec l'augmentation de la profondeur on voit une diminution de la densité des plantes parce que la lumière y est plus rare. Elle est caractérisée par la présence de rhizomes plagiotropes qui finissent de manière improvisée.
- Limite nette : le type de substrat ne permettant pas la progression des rhizomes (par exemple avec un passage de substrat sablonneux à rocheux). Elle est caractérisée par une absence de mattes et la présence d'une haute densité de touffes de feuilles.
- Limite érosive : elle est liée à l'hydrodynamisme élevé ne permettant pas l'avancée des herbiers. Elle est caractérisée par une haute densité et la présence de mattes.
- Limite régressive : les eaux turbides limitent la pénétration de la lumière. On n'y trouve que des mattes mortes.
Dans les régions à bas hydrodynamisme, provoquant plus de sédimentation, les mattes peuvent monter de manière que les feuilles n'arrivent pas à la surface de l'eau. Se crée de cette manière une barrière appelée « récif barrière ». Entre la barrière et le littoral peut se former une lagune, empêchant l'herbier d'avancer vers la côte. Les récifs barrière jouent un rôle primordial dans la protection des côtes contre l'érosion.
Dans les régions à fort hydrodynamisme, en revanche, les rhizomes peuvent être arrachés, créant des formations dites « intermattes » constituées de canaux d'érosion.
Biocénoses associées à Posidonia oceanica
Les caractéristiques propres à la Posidonie, sa croissance et sa biomasse, sont toutes des facteurs régissant les biocénoses animales et végétales associées à Posidonia oceanica. On peut distinguer les biocénoses épiphytes (bactéries, algues et Ectoproctes colonisant les feuilles et rhizomes de la plante), animaux sessiles et vagiles et des organismes saprophages.
 Une limace de mer Elysia gordanae sur une feuille de posidonie.
Une limace de mer Elysia gordanae sur une feuille de posidonie. Deux saupes, poissons herbivores.
Deux saupes, poissons herbivores. un labre merle inspectant un herbier.
un labre merle inspectant un herbier. Un poulpe dans un herbier.
Un poulpe dans un herbier.
Biocénoses épiphytes
À proximité de la base des feuilles et sur les feuilles jeunes on trouve des bactéries et des Diatomées, sur la partie centrale des algues rouges et brunes, et sur ces algues ainsi que sur les extrémités des feuilles des algues filamenteuses.
Les biocénoses épiphytes sont mangées par des mollusques gastéropodes, des crustacés amphipodes et des annélides polychètes et jouent un rôle très important dans la chaîne alimentaire des herbiers de Posidonies, en prenant en compte le fait que peu d'organismes se nourrissent directement des tissus végétaux de la plante à cause du ratio C/N élevé, du fort taux de cellulose et de la présence de phénols. Les épiphytes peuvent également endommager les Posidonies ; en augmentant le poids, ils peuvent faire tomber prématurément les feuilles, diminuer la lumière et bloquer l'échange de gaz et l'absorption des nutriments à travers les feuilles.
Biocénoses animales et saprophages

La faune associée aux herbiers de Posidonies est constituée d'animaux sessiles qui vivent sur le substrat de feuilles et rhizomes, et d'animaux vagiles capables de bouger à l'intérieur de l'herbier. Il y a également des organismes vivant à l'intérieur des mattes, principalement saprophages. Des études menées par Gambi et al en 1992[22] ont démontré qu'environ 70 % de la population animale des herbiers est herbivore. Les plus abondants sont les échinodermes, particulièrement Paracentrotus lividus, l'un des organismes peu nombreux pouvant se nourrir des feuilles de la plante. Les carnivores sont à leur tour représentés par des poissons, mollusques, annélides polychètes et crustacés décapodes.
Parmi les mollusques on trouve Pinna nobilis, bivalve le plus grand de Méditerranée, vivant presque exclusivement dans les herbiers ; elle est menacée d'extinction causée par la pollution et le grand intérêt porté sur cette espèce par les collectionneurs[23].
Les poissons sont, quant à eux, représentés par les Labridés et Sparidés, presque tous carnivores. On trouve peu de grands poissons, et pendant l'année on assiste à des variations dans l'abondance de ceux-ci dû aux migrations et l'ajout d'individus d'autres régions. Dans les herbiers superficiels on trouve beaucoup d'exemples de Sarpa salpa, un herbivore représentant de 40 à 70 % des poissons présents dans les herbiers en été[24].
Les feuilles mortes sont colonisées par des microorganismes et des champignons. Un groupe de saprophages en particulier, annélides polychètes (Lysidice ninetta, Lysidice collaris et Nematonereis unicornis), et crustacés isopodes (Idotea hectica, Limnoria mazzellae), dites « borers », creusent, pour se nourrir et répandre leur habitat, des galeries à l'intérieur des bases des feuilles encore attachées aux rhizomes pendant des années[25],[26].
Les feuilles, une fois dégradées par les vagues et courants et les microorganismes et échouées sur les plages, servent de refuge à des insectes et des crustacés amphipodes et isopodes.
Endophyte fongique racinaire
En 2014 une équipe de chercheurs italiens a mis en évidence la présence d'un endophyte fongique dans les racines de P. oceanica poussant sur différents substrats (roche, sable et mattes) de deux prairies marines de Sicile.
Le pourcentage de colonisation fongique (FC) dans les tissus a montré une moyenne plus élevée dans les racines ancrées directement sur la roche que dans celles situées au sein la matte et dans le sable. Les colonies fongiques ont été identifiées comme appartenant au genre Lulwoana (en) (Lulworthiaceae (en)).
Il s'agit du premier signalement de Lulwoana sp. comme Endophyte cloisonné sombre (en) (ECS) dans les racines de P. oceanica. La plus forte colonisation fongique, détectée dans les racines des plans poussant sur la roche, suggère que la présence d'ECS peut aider l'hôte dans la capture des nutriments minéraux par l'activité lytique[27].
Phytosociologie

Du point de vue phytosociologique, P. oceanica représente l'espèce caractéristique de l'association Posidonietum oceanicae (Molinier, 1958). Cette association est caractéristique des fonds sablonneux et boueux des plaines infralittorales, à l'intérieur de laquelle on distingue divers groupes dépendants : sur les rhizomes, des biocénoses de l'association Flabellio-Peyssonnelietum squamariae (Molinier 1958), tandis que sur les feuilles on distingue l'association épiphyte Myrionemo-Giraudietum sphacelariodis (Van der Ben, 1971). Ces groupes ne sont pas exclusifs aux Posidonies mais se trouvent également sur les feuilles d'autres Angiospermes aquatiques et sur les Cystoseires.
Importance de l'écosystème
L'herbier de Posidonies constitue l'écosystème majeur de la Méditerranée, c'est-à-dire le plus développé et complexe. L'herbier de Posidonies est donc l'écosystème le plus important de la Méditerranée et est déclaré « site d'importance communautaire » par une directive de l'Union européenne[28].
Dans l'écosystème côtier la Posidonie tient un rôle fondamental pour diverses raisons :
- Elle libère environ 20 litres d'oxygène par jour pour chaque m² d'herbier[9].
- Elle produit et exporte de la biomasse soit dans les écosystèmes limitrophes, soit en profondeur.
- Elle abrite de nombreuses espèces de poissons, céphalopodes, bivalves, gastéropodes, échinodermes et Tuniciers.
- Elle consolide les fonds des côtes, contribuant à freiner le transport de sédiments dû aux courants.
- Elle agit en tant que barrière, limitant l'érosion des côtes en limitant la force des courants.
- Elle protège les plages de l'érosion avec les feuilles échouant sur les côtes, particulièrement en hiver.
Les herbiers de Posidonies rétrécissent chaque année dans toute la Méditerranée[29], phénomène grandissant d'année en année dû à la pression démographique humaine sur le littoral.
La perte des herbiers a des effets négatifs non seulement sur les Posidonies mais également sur d'autres écosystèmes ; la perte d'un seul mètre linéaire d'herbier peut entraîner la perte de plusieurs mètres de plage dû à l'érosion[7]. De plus, le rétrécissement des herbiers amène une biodiversité moindre et une détérioration de la qualité de l'eau.
Les causes du rétrécissement sont :
- la pollution
- la pêche au chalut[30]
- la pratique de sports nautiques (endommagements dus aux ancres, hydrocarbures, détergents, peintures, déchets solides, etc.)[31]
- la construction d'habitations sur le littoral, entraînant l'installation d'égouts menant les décharges à l'eau, augmentant la turbidité de l'eau et diminuant ainsi la photosynthèse[32]
- la construction de digues et autres barrières modifiant la sédimentation[33]
- l'eutrophisation des eaux côtières, provoquant une croissance anormale des algues épiphytes, qui bloquent la lumière et diminuent ainsi la photosythèse[34].
De nos jours, les herbiers de Posidonies sont menacés par la compétition avec deux algues tropicales accidentellement introduites dans la Méditerranée, Caulerpa taxifolia[35] et Caulerpa racemosa[36]. Les deux présentent une croissance rapide qui suffoque les Posidonies.
Posidonia oceanica comme bioindicateur

On utilise Posidonia oceanica comme bioindicateur depuis environ vingt années[37]. La plante présente toutes les caractéristiques nécessaires à un bon bioindicateur :
- elle est une espèce benthique
- elle a un long cycle vital.
- elle est présente dans toute la Méditerranée.
- elle a une grande capacité de concentration de pollution dans ses tissus.
- elle est très sensible aux changements dans l'écosystème.
Il est possible de connaître l'état d'une région côtière en étudiant les herbiers de Posidonies qui y sont présents.
On peut les étudier des manières suivantes :
- analyse et suivi des limites inférieures.
- analyse de la densité de l'herbier.
- analyse phénologique.
- analyse lépidochronologique.
Analyse des limites inférieures
Il existe une corrélation entre les limites inférieures et la transparence de l'eau. Sur cette base est proposé un tableau qui met en relation les deux variables (tableau 1), qui peut s'appliquer à tout genre de limite inférieure sauf érodée parce que conditionnée par l'hydrodynamisme du fond[37].
| Profondeur de limite inférieure (m) | Transparence de l'eau |
|---|---|
| de 0 à -15 | Basse transparence |
| de -15 à -25 | Peu de transparence |
| de -25 à -35 | Transparence |
| inférieure à -35 | Transparence élevée |
Densité des touffes de feuilles
Pour ce qui est de la densité, elle dépend de la profondeur à laquelle est situé l'herbier, de la luminosité et du type de substrat. Les touffes sont calculées par m², les herbiers étant divisés en cinq types[38].
| Classe | Densité des touffes | Estimation de densité |
|---|---|---|
| I | au-delà de 700 touffes/m² | Herbier très dense |
| II | de 400 à 700 touffes/m² | Herbier dense |
| III | de 300 à 400 touffes/m² | Herbier peu dense |
| IV | de 150 à 300 touffes/m² | Herbier très peu dense |
| V | de 50 à 150 touffes/m² | Semi-herbier |
Pergent en 1995[37] et Pergent-Martini en 1996[40] ont proposé une autre classification qui met en relation la densité des touffes avec la profondeur, trouvant ainsi quatre types de densité. On peut trouver trois types d'herbier :
- herbier en équilibre : la densité y est normale ou exceptionnelle.
- herbier dérangé : la densité y est basse.
- herbier très dérangé : la densité y est anormale.
On a également fait un tableau pour indiquer cela.
| Profondeur (m) | Herbier très dérangé | Herbier dérangé | Herbier en équilibre | |
|---|---|---|---|---|
| Densité anormale (touffes/m2) | Densité basse (touffes/m2) | Densité normale (touffes/m2) | Densité exceptionnelle (touffes/m2) | |
| 20 | Moins de 61 | Entre 61 et 173 | Entre 173 et 397 | Plus de 397 |
| 21 | Moins de 48 | Entre 48 et 160 | Entre 160 et 384 | Plus de 384 |
| 22 | Moins de 37 | Entre 37 et 149 | Entre 149 et 373 | Plus de 373 |
| 23 | Moins de 25 | Entre 25 et 137 | Entre 137 et 361 | Plus de 361 |
| 24 | Moins de 14 | Entre 14 et 126 | Entre 126 et 350 | Plus de 350 |
| 25 | Moins de 4 | Entre 4 et 116 | Entre 116 et 340 | Plus de 340 |
| 26 | Moins de 106 | Entre 106 et 330 | Plus de 330 | |
| 27 | Moins de 96 | Entre 96 et 320 | Plus de 320 | |
| 28 | Moins de 87 | Entre 87 et 311 | Plus de 311 | |
| 29 | Moins de 78 | Entre 78 et 302 | Plus de 302 | |
| 30 | Moins de 70 | Entre 70 et 294 | Plus de 294 | |
Analyses phénologiques
Les analyses phénologiques étudient divers paramètres utiles pour décrire l'état des plantes :
- moyenne du nombre de feuilles par âge (adulte, moyenne, jeune), par touffe de feuilles
- longueur et épaisseur des feuilles par âge et touffe
- pourcentage de tissu brun (feuilles non photosynthétiques)
- Leaf Area Index (index de superficie foliaire), superficie de feuilles par m²
- coefficient « A » : pourcentage de feuilles sans apex (extrémité supérieure).
Analyses lépidochronologiques
L'analyse lépidochronologique consiste en l'étude des cycles de vie des feuilles de P. oceanica. Une fois morte, la feuille se détache du rhizome à sa base ; ces feuilles s'accumulant ont des variables qui changent selon des cycles annuels, utiles pour l'étude des changements ambientaux[41]. On peut :
- estimer la biomasse produite par année, soit en termes de l'allongement des rhizomes, soit en production de feuilles.
- estimer la production des fleurs et le nombre de reproductions.
- mésurer la concentration de métaux lourds dans les tissus de la plante.
Usage
Par le passé on utilisait les feuilles comme isolant dans la construction des toits, comme lit pour les animaux ou pour emballer des objets fragiles (en Italie on l'appelait « alga dei vetrai » (« algue des vitraux »). En pharmacologie on utilisait les feuilles pour soigner des inflammations et des irritations. En certaines régions méditerranéennes elles sont encore utilisées dans l'alimentation des animaux. On étudie actuellement la possibilité d'utiliser Posidonia oceanica pour la production de biogaz[42].
Records
Un plan géant aux Baléares ?
En 2006, une équipe scientifique internationale affirme avoir trouvé, dans les Baléares, un plant de Posidonia oceanica long d'environ 8 km. Le plant se trouve dans un herbier de 700 km2 allant de la région d'Es Freus (Formentera) à la plage de Las Salinas (Ibiza). La délimitation du plant fut réalisée par marqueurs génétiques. Sa découverte fut le fait du hasard, cet herbier abritant, selon le professeur Carlos Duarte, cent millions d'exemplaires du même individu. L'équipe qui a découvert ce plan estime qu'il constitue l'un des organismes vivants le plus grand et le plus vieux référencé au monde[43]. L'âge estimé de cette plante se situe en effet entre 80 000 et 200 000 ans[44].
Durée de vie
Une étude de 2011 a estimé l'âge d'une colonie de Posidonia oceanica en Méditerranée entre 12 000 et 200 000 ans en se basant sur la découverte de clones séparé de 15 km et une vitesse d'extension par multiplication végétative de 4 cm an−1. L'âge maximum étant théorique puisque la région qu'elle occupe était émergée il y a 10 000 à 80 000 ans[45].
Réimplantation de Posidonia oceanica
La reconstitution d'herbiers de Posidonia oceanica par réimplantation de boutures est une pratique maintenant très connue sur les côtes françaises de Méditerranée. Pionnier en la matière, Georges Cooper (1918-1986), marin-pêcheur autodidacte, émet dès 1967 l'idée de récupérer les boutures arrachées aux herbiers vivants lors des tempêtes et échouées sur les fonds marins. C'est au début des années 1970 que la technique est mise au point[46]. Les boutures, immobilisées dans un dispositif dit « contrainte Cooper », composé d'un grillage fixé dans un cadre en béton, sont ensuite immergées dans les zones ciblées. Dans les zones les plus soumises aux vagues et aux courants de tempête, les cadres sont protégés dans des récifs artificiels dit « récifs alvéolés ».
Des herbiers ont ainsi été implantés notamment au large des côtes situées entre Hyères et Giens.
L'Association Fondation G. Cooper créée en décembre 1972 sous le nom de « Fondation pour la reconquête des milieux naturels détruits », continue à promouvoir cette technique sous son nom d'usage « Les Jardiniers de la Mer »[47].
L'association citée effectue également des implantations à partir de plantules issues des graines récoltées sur les plages. Cette pratique est plus aléatoire car soumise aux aléas des années fructifères.
Annexes
Bibliographie
- (en) Boudouresque (dir. et éditeur), Jeudy de Grissac (éditeur) et Olivier (éditeur), International Workshop on Posidonia oceanica beds, Marseille, GIS Posidonie, , 454 p. (ISBN 2-905540-00-1, lire en ligne)
- (fr) Boudouresque, C. F. et A. Meinesz (1982), Découverte de l’herbier de Posidonie, GIS Posidonie, 1982. page 80 (OCLC 33452266)
- (en) Mayot N., Boudouresque C.F., Leriche A.(2005), Unexpected response of the seagrass Posidonia oceanicato a warm-water episode in the North Western Mediterranean Sea ; C. R.Biologies, 328, 291–296
- (it)[PDF] Carpentieri, P (2005), Introduzione alla ecologia marina, parte 1, Università di Roma "La Sapienza", Laurea Triennale in Scienze Naturali e Scienze Biologiche, 21-10-2005
- (it)[PDF] Carpentieri, P (2005), Introduzione alla ecologia marina, parte 2, Università di Roma "La Sapienza", Laurea Triennale in Scienze Naturali e Scienze Biologiche, 21-10-2005
- (fr) Caye, C. et A. Meinesz (2005), Analyse des modalités de la multiplication végétative et de la reproduction sexsuée de Posidonia oceanica et de ses conséquences sur la constitution génétique des herbiers, Rapp. Comm. Int. Mer Medit, 1992, 33: 32
- (it) Cinelli, F., Pardi G., Papi I. (dicembre 2005). « Biologia della pianta. La Posidonia oceanica », dans Rivista Marittima Italiana, , pages 17–20
- (en) Den Hartog, C (1970). The seagrasses of the world, Amsterdam, North Holland publishing company, 1970, page 273, (OCLC 113494)
- (fr)[PDF] Gobert, S. (2002), Variations spatiale et temporelle de l’herbier à Posidonia oceanica (L.) Delile. Dissertation présentée en vue de l’obtention du grade de Docteur en Océanologie, Université de Liège : 207 p. Thèse Gobert 2002
- (en) Edmund Peter Green et Frederick T. Short, World Atlas of Seagrasses, University of California Press, 2003, pages 48–57, (ISBN 0520240472)
- (it) Mazzella, L. et al. « Laboratorio di ecologia del benthos della Stazione zoologica Anton Dohrn di Napoli - Ischia », dans Le praterie sommerse del Mediterraneo, Ercolano, La Buona Stampa S.p.a, 1987, page 59, (OCLC 38639215)
- (it) Mazzella, L. et al. (2005), « Organizzazione trofica nell'ecosistema a Posidonia. La Posidonia oceanica », dans Rivista Marittima Italiana, , pages 31–39
- (it)[PDF] Melley, A. et al. (2004), Allegato 3:Posidonia oceanica dans Melley Antonio (éd.) Indicatori biologici per le acque marine costiere, Agenzia per la Protezione dell’Ambiente e per i Servizi Tecnici - Centro Tematico Nazionale “Acque Interne e Marino Costiere”, , pages 42–52
- (it) Mojetta A. et Ghisotti, A (2004), Flora e fauna del Mediterraneo, 8e éd, Milan, Mondadori [], , pages 31–32, (ISBN 880438574X)
- (fr) Moliner, R. et Picard, J. (1952), Recherches sur les herbiers de Phanérogames marines du littoral méditerranéen français, Ann. Inst. Océanogr., 27 n. 3, 1952, pages 157-234, (ISSN 0078-9682)
- (fr) Pergent G. et al. (1995), « Utilisation de l’herbier à Posidonia oceanica comme indicateur biologique de la qualité du milieu littoral en Méditerranée: état des connaissances », Mésogée 54: 3-27, (ISSN 0398-2106)
Radiographie
Articles connexes
Références taxinomiques
- (en) Référence Catalogue of Life : Posidonia oceanica (L.) Delile (consulté le )
- (fr) Référence DORIS : espèce Posidonia oceanica
- (en) Référence UICN : espèce Posidonia oceanica (L.) Delile, 1813 (consulté le )
- (fr) Référence Tela Botanica (France métro) : Posidonia oceanica (L.) Delile, 1813
- (en) Référence AlgaeBase : espèce Posidonia oceanica (Linnaeus) Delile 1813
- (en) Référence NCBI : Posidonia oceanica (taxons inclus)
- (fr+en) Référence ITIS : Posidonia oceania (L.) Delile (Répertoriée avec une coquille dans le nom scientifique)
Liens externes
- (en) « Mediterranean Posidonia Network », sur medposidonianetwork.com.
Notes et références
Notes
- Sur les 9 espèces de Posidonia], 8 se trouvent sur les côtes australiennes. Posidonia oceanica est pour sa part endémique en Méditerranée.
- Les feuilles rubanées sont de forme étroite et allongée, en ruban.
Références
- Boudouresque 1984
- Gérard Giraud, « Sur une méthode de mesure et de comptage des mesures foliaires de Posidonia oceanica (Linnaeus) Delile », Bull. Mus. Hist. Nat. Marseille, vol. 39, , p. 33-39
- (en) H.T. Clifford et al., The Families of the Monocotyledons: Structure, Evolution, and Taxonomy, Springer, 1985, page 316, (ISBN 3540430393)
- (en) Klaus Kubitzki (éd.), Flowering Plants. Monocotyledons, volume 4, Springer, 1990, page 405, (ISBN 3540640614)
- (fr) Collectif. Préservation et conservation des herbiers à Posidonia oceanica. Accord RAMOGE, 2006, (ISBN 2-905540-30-3) RapportRAMOGE2006
- Boudouresque, « La posidonie, un miracle en Méditerranée », sur Futura-Sciences,
- Mazzella et al, op. cit.
- Ballesteros in Collectif, op. cit.
- Boudouresque et Meinesz, 1982, op. cit.
- (en)[PDF] S. Calvo et al., Stagnone di Marsala, Sicily - Italy
- Posidonia K.D. Koenig
- (en) A. B. Rendle, « The Classifition of Flowering Plants », Cambridge Univ. Press, (consulté le ), p. 198
- (it) G. Cognetti, M. Sarà et G. Magazzù, Gli organismi del benthos in Biologia marina, 2e réédition de la 1re édition, Bologne, Il Sole 24 Ore Edagricole [2002], 2004, pages 254-255, (ISBN 8850627203)
- (en) The Angiosperm Phylogeny Group, « An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV », Botanical Journal of the Linnean Society, vol. 181, no 1, (DOI 10.1111/boj.12385, lire en ligne)
- (en) Angiosperm Phylogeny Website
- Paul Fournier. Les quatre flores de France. Paris, Lechevalier, 1990, page 135 note 1
- (en) Bussotti S., Guidetti P., Matricardi G. Morphological analysis of Posidonia oceanica flowers from a reef formation and a shallow water meadow of the Ligurian sea (North-Western Mediterranean), Banyuls-sur-mer, Vie et Milieu 48 no 1, 1998, p. 55-62.
- (it) D.Lgs. 152/2006
- (it) L. 19 ottobre 1984, n. 748, in materia di "Nuove Norme per la Disciplina dei Fertilizzanti"
- (it) Massimo Centemero, « Se la posidonia à compostabile », La Nuova Ecologia, 2005
- (en)G. Pergent et al, « Fate of primary production in Posidonia oceanica meadows of the Mediterranean », Aquatic Botany, décembre 1997, 59 n. 3-4: 307-321. DOI:10.1016/S0304-3770(97)00052-1, (ISSN 0304-3770)
- (en) M. C. Gambi et al., « Depth and seasonal distribution of some groups of the vagile fauna of the Posidonia oceanica leaf stratum: structural and trophic analyses », P.S.Z.N. I: Marine Ecology 13 n. 1: 17-39, 1992, (ISSN 0173-9565)
- (it) Pinna nobilis, Ministero dell'Ambiente e della Tutela del Mare
- (en) P. Francour, « Fish assemblages of Posidonia oceanica beds at Port-Cros (France, NW Mediterranean): Assessment of composition and long-term fluctuations by visual census », Marine Ecology, 18 n. 2: 157-173, 1997, (ISSN 0173-9565) Abstract
- (en) M.C., Gambi et al., « Borers in Posidonia oceanica scales: taxonomical composition and occurrence », Biologia Marina Mediterranea, 4 n. 1: 253-261, 384-387, 1997, (ISSN 1123-4245)
- (it) G. Di Maida et al., Distribuzione dei borers nelle praterie di Posidonia oceanica (L.) Delile della Sicilia, dans R. Casagrandi et P. Melià (éditeurs), « Ecologia quantitativa: metodi sperimentali, modelli teorici, applicazioni », Atti del XIII Congresso Nazionale della Società Italiana di Ecologia, Rome, Aracne, septembre 2003, (ISBN 887999767X)
- (en) L. Torta, S. Lo Piccolo, G. Piazza, S. Burruano, P. Colombo, D. Ottonello, R. Perrone, G. Di Maida, M. Pirrotta, A. Tomasello et S. Calvo, « Lulwoana sp., a dark septate endophyte in roots of Posidonia oceanica (L.) Delile seagrass », Plant Biol J, vol. 17, , p. 505-511 (ISSN 1435-8603, e-ISSN 1438-8677, lire en ligne, consulté le )
- (it)[PDF] Dir. n. 92/43/CEE
- (fr) J.M. Peres, La regression des herbiers à Posidonia oceanica, dans C. F. Boudouresque, A. Jeudy de Grissac et J. Olivier (éditeurs), International Workshop on Posidonia oceanica beds, GIS Posidonie publ., 1984. 445-454, (ISBN 2905540001), Abstract
- (en) G. D.Ardizzone et P. Pelusi, Regression of a Tyrrhenian Posidonia oceanica prairie exposed to nearshore trawling, Rapport et procès verbeaux de réunion, CIESM 28 n. 3: 175-177, (ISSN 0373-434X)
- (it) M. Milazzo et al, « Effetti degli ancoraggi sulla prateria a Posidonia oceanica della Riserva marina isola di Ustica: Dati preliminari », Biol. mar. Medit., 9 n. 1: 686-689, 2002, (ISSN 1123-4245)
- (en) Elena Balestra et al, (2004). « Variability in patterns of growth and morphology of Posidonia oceanica exposed to urban and industrial wastes: contrasts with two reference locations », Journal of Experimental Marine Biology and Ecology, 308 n. 1: 1-21. DOI:10.1016/j.jembe.2004.01.015, 2004, (ISSN 0022-0981)
- (fr) J.J. Blanc, Ruptures d'équilibre au littoral de la Provence occidentale, l'action des tempêtes, relations avec les aménagements littoraux sur les équilibres sédimentaires, et en particulier sur l’herbier à Posidonia oceanica, Tethys 11 n. 3 e 4: 350 e 329, 1985, (ISSN 0040-4012)
- (en) Joann M. Burkholdera et al, « Seagrasses and eutrophication », Journal of Experimental Marine Biology and Ecology, 350 n. 1-2: 46-72. DOI:10.1016/j.jembe.2007.06.024, 2007, (ISSN 0022-0981)
- (en) X. De Villele et M. Verlaque, (1995). « Changes and degradation in a Posidonia oceanica bed invaded by introduced tropical alga Caulerpa taxifolia in the North Western Mediterranean », Bot. Mar., 38 n. 1: 79-87, 1995, (ISSN 0006-8055), Abstract
- (en) G. Ceccherelli et al, (2000). « Response of the non-indigenous Caulerpa racemosa (Forsskal) J. Agardh tho the native seagrass Posidonia oceanica (L.) Delile: effect of density of shoots and orientation of edges of meadows », Journal of Experimental Marine Biology and Ecology, 243: 227-240. DOI:10.1016/S0022-0981(99)00122-7, 2000, (ISSN 0022-0981)
- Pergent, 1995 op. cit.
- (fr) G. Giraud, Contribution à la description et à la phénologie des herbiers à Posidonia oceanica (L.) Delile, Thèse Doctorat 3e Cycle, Univ. Aix-Marseille II: 150, 1977
- Gérard Giraud. Contribution à la description et à la phénologie quantitative des herbiers de Posidonia Oceanica (L.) Del. Thèse Universite d'Aix Marseille II, France, 1977 - 300 pages
- (en) Pergent-Martini, « Spatio-temporal dynamics of posidonia oceanica beds near a sewage outfall (Mediterranean–France) », dans J. Kuo et al (éd.) Seagrass Biology: Proceedings of an international workshop, Rottnest island, The University of Western Australia, 1996, 229-306 (ISBN 0864224451)
- (it)[PDF] Tania Dolce, Eugenio Fresi, Stanislao Ziantoni (Dipartimento di Biologia, Université Tor Vergata, Rome), Michele Scardi (Stazione Zoologica A. Dohrn, Naples). Studio lepidocronologico di Posidonia oceanica (L.) Delile in alcuni siti del Mar Tirreno, Società Italiana Ecologia Atti 17, 22-09-2000.
- Green et Short, op. cit.
- (es) « Descubren en las aguas de Formentera el organismo más grande del mundo, una alga de 8 kilómetros », La Verdad (es), (lire en ligne)
- Quentin Mauguit, « Une posidonie âgée de plus de 80.000 ans en Méditerranée », sur Futura-Sciences,
- (en) Sophie Arnaud-Haond, Carlos M. Duarte, Elena Diaz-Almela, Nùria Marbà, Tomas Sintes et Ester A. Serrão, « Implications of Extreme Life Span in Clonal Organisms: Millenary Clones in Meadows of the Threatened Seagrass Posidonia oceanica », PLoS One, vol. 7, no 2, , e30454 (DOI 10.1371/journal.pone.0030454, lire en ligne)
- George Cooper, « Jardinier de la mer », Cahier - Association Fondation G. Cooper, vol. Cahier no 5, (ISSN 0222-5743)
- « Les Jardiniers de la Mer » (consulté le )
- Portail de la botanique
- Portail de la mer Méditerranée