Ozonure
Un ozonure (ozonide en anglais) est soit :
- l'anion instable, O3−, dérivé de l'ozone ;
- un composé organique RO3 cyclique semblable à un peroxyde organique formé par réaction de l'ozone sur un composé insaturé.
Ozonure ionique
Les ozonures inorganiques sont des composés ioniques rouge profond qui contiennent des anions O3–. Cet anion a la même structure coudée que la molécule d'ozone[1].
Ces ozonures ioniques sont formés en brûlant du potassium ou rubidium ou césium dans l'ozone ou bien en traitant l'hydroxyde du métal alcalin correspondant avec de l'ozone. Le potassium laissé intact pendant des années dans de l'air sec, accumule une couverture de superoxyde et d'ozonure. Ces ozonures sont des explosifs très sensibles qui doivent être manipulés à basse température et sous atmosphère inerte. Les ozonures de lithium et de sodium sont extrêmement instables et sont préparés à basse température par échange d'ions en partant de CsO3. L'ozonure de sodium, qui se décompose facilement en NaOH et NaO2, a été pendant longtemps pensé impossible à obtenir sous forme pur[2]. Cependant, avec l'aide de cryptands et de méthylamine, du NaO3 pur peut être produit sous forme de cristaux rouges isostructuraux avec ceux de NaNO2[3]. L'ozonure de tétraméthylammonium, qui a pu être obtenu par métathèse avec de l'ozonure de césium dans l'ammoniac liquide est stable sous 74,85 °C (348 K) :
- CsO3 + [(CH3)4N][O2] → CsO2 + [(CH3)4N][O3]
Ozonure covalent par liaison simple
Les ozonures de phosphite de formule (RO)3PO3, sont utilisés pour la production d'atomes d'oxygène singulet. Ils sont formés par ozonisation d'un ester phosphite dans le dichlorométhane à basse température et décomposés pour produire de l'oxygène singulet et un ester de phosphate[4] :
- (RO)3P + O3 → (RO)3PO3
- (RO)3PO3 → (RO)3PO + 1O2
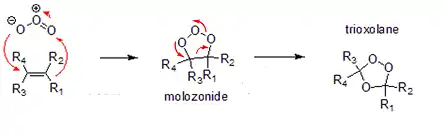
Molozonure et ozonure organique
les ozonures organiques (1,2,4-trioxolane) sont issus du réarrangement de molozonures (1,2,3-trioxolane) formés par une réaction d'addition entre l'ozone et un alcène. Les molozonures sont des cousins encore plus explosifs des peroxydes organiques. Ils sont instables et se convertissent rapidement en l'ozonure organique correspondant. Ces derniers apparaissent généralement comme des liquides huileux, très odorants et se décomposent rapidement en présence d'eau en composés carbonyl : aldéhydes, cétones, peroxydes.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ozonide » (voir la liste des auteurs).
- F. A. Cotton and G. Wilkinson, Advanced Inorganic Chemistry, 5th edition, 1988, p.462.
- N. Korber, M. Jansen, Ionic Ozonides of Lithium and Sodium: Circumventive Synthesis by Cation Exchange in Liquid Ammonia and Complexation by Cryptands, Chemische Berichte, 1996, vol. 129(7), pp. 773–777. DOI:10.1002/cber.19961290707.
- W. Klein, K. Armbruster, M. Jansen, Synthesis and crystal structure determination of sodium ozonide, Chemical Communications, 1998, vol. 6, pp. 707–708. DOI:10.1039/a708570b.
- Catherine E. Housecroft, Alan G. Sharpe, Inorganic Chemistry -Chapter 16: The group 16 elements, 2008, 3e éd., Pearson, p. 496. (ISBN 978-0-13-175553-6).
Voir aussi
- Ozonolyse
- Ozone
- Superoxyde, O2−
- Peroxyde, O2−2
- Oxyde, O2−
- Dioxygényle, O2+
- Portail de la chimie