Orange de xylénol
L'orange de xylénol est un colorant de la famille des triarylméthane et des sulfonephtaléines. C'est l'analogue sulfuré du violet de phtaléine. Il est notamment utilisé comme indicateur pour des titrages par complexométrie.
| Orange de xylénol | |
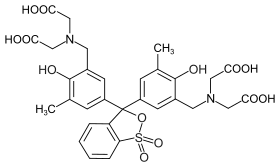
| |
| Forme totalement acide (protonée) de l'orange de xylénol | |
| Identification | |
|---|---|
| Nom UICPA | 3,3'-bis(N,N-bis(carboxyméthyl)aminométhyl)crésolsulfonephtaléine |
| No CAS | |
| No ECHA | 100.015.049 |
| No CE | 216-553-8 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C31H32N2O13S [Isomères] |
| Masse molaire[1] | 672,656 ± 0,036 g/mol C 55,35 %, H 4,8 %, N 4,16 %, O 30,92 %, S 4,77 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés chimiques
L'orange de xylénol possède une fonction acide sulfonique (sous la forme de sultone, pouvant être hydrolysée), quatre groupes carboxyle, deux groupes amine, et deux fonctions alcool phénolique, pouvant chacune être protonée ou déprotonée. À pH≈4,5, l'orange de xylénol prend une teinte jaune doré[2]. Sous cette forme, il peut se former avec des nombreux ions métalliques des complexes allant du rouge faible au rouge soutenu, voire au rouge violacé. Ces complexes peuvent alors être détruits par l'ajout d'un autre ligand, comme l'EDTA[3].
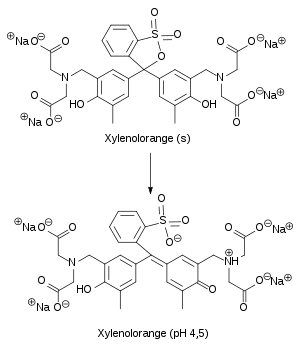
Une solution à 1 % en orange de xylénol a un pH de 8,1[4].
L'orange de xylénol possède un maximum d'absorption près de 546 nm et un maximum d'émission vers 580 nm[5], cette dernière variant légèrement en fonction de la concentration en ions.
Utilisation
L'orange de xylénol, sous forme de sel de tétrasodium, comme indicateur coloré pour le titrage d'ions métalliques, en particulier le bismuth et le plomb. Contrairement au noir ériochrome T, le titrage est plus précis en milieu acide modéré (pH entre 4 et 5).
L'orange de xylénol est aussi utilisé en biologie, dans des opérations de réparation de l'os in vivo, car il colore les os nouvellement constitués[6]. Il permet aussi de visualiser des micro-fissures à la surface des os, car des ions métalliques libres se lient alors à la surface[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) UNI Saarland: Skriptum zur Komplexometrie.
- (de) Universität Leipzig, Institut für analytische Chemie: Ausgewählte Titrationen.
- Datenblatt Xylenolorange bei Acros, abgerufen am 19. Februar 2010.
- (de) Olympus Fluorochrome Tabelle
- Rahn und Perren: "Xylenol orange, a fluorochrome useful in polychrome sequential labelling of calcifying tissues", in: Stain Technol., 1971, 46, S. 125–129.
- Lee et al., "Sequential labelling of microdamage in bone using chelating agents", in: J Orthop Res, 2000, 18, S. 322–325.
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Xylenolorange » (voir la liste des auteurs).
- Portail de la chimie