Neutralisation
La neutralisation ou neutralisation acidobasique est une réaction chimique où un acide réagit avec une base de façon à former de l'eau et un sel[1],[2]. Elle est couramment utilisée pour réguler le pH des milieux aqueux[3] (eaux usées, cours d'eau), tout comme les terres agricoles[4]. Le pH après la neutralisation dépend de la force de l'acide en présence.
Cet article concerne la réaction chimique. Pour l'action sportive, voir Neutralisation (technique de combat). Pour le concept pénologique, voir Neutralisation (pénologie).
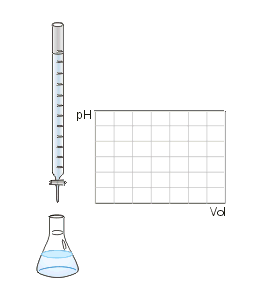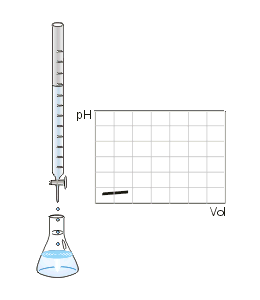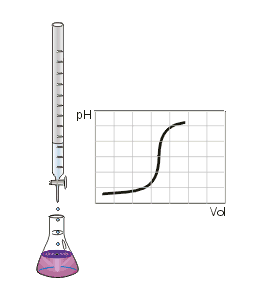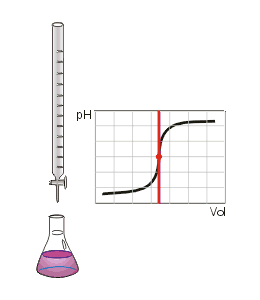
Titrage de la neutralisation d'un acide fort par une base forte. Le point d'équivalence est marqué par un point rouge.
Notes et références
- « Neutralisation », Outils pédagogiques utiles en sciences, (consulté le )
- G. Kroonen, R. Cahay, A. Cornélis, V. Collignon, B. Leyh et R. Wuytack, Les acides et les bases en solution aqueuse, Groupe Transition, Université de Liège, , Pdf (lire en ligne), p. 5
- Yves Moynot, « La Neutralisation », École des mines Saint-Étienne, (consulté le )
- (en) K. Bruce MacDonald, Les Sols acides et le chaulage en agriculture, Ottawa, Agriculture Canada, , Pdf (lire en ligne), p. 15
Articles connexes
- Chaulage (traitement des sols pour modifier leur pH)
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.