MitoNEET
MitoNEET est une protéine à centre Fe-S ancrée dans la membrane externe de la mitochondrie. La fonction de cette protéine est encore très mal définie.
Description
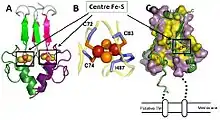
MitoNEET a été identifiée en 2004 comme une nouvelle cible potentielle de l’antidiabétique pioglitazone. Depuis cette interaction a été remise en cause. Elle doit son nom de sa localisation à la mitochondrie et d’une séquence en acides aminés particulière à son extrémité C-terminale (Asparagine/Asn/N – Glutamate/Glu/E-Glutamate/Glu/E-Thréonine/Thr/T) (figure 1).
MitoNEET est un dimère ancré à la membrane externe mitochondriale par son extrémité N-terminale. Elle possède un centre [2Fe-2S] par monomère, situé dans le cytosol. Chaque centre [2Fe-2S] est coordonné par trois cystéines (C72, C74 et C83) et une histidine (H87). Cette coordination atypique rend son centre Fe-S relativement labile (figure 2).
Structure cristallographique
Plusieurs fonctions potentielles de mitoNEET ont été proposées à ce jour. Selon les différentes équipes travaillant sur le sujet, mitoNEET pourrait être impliquée dans la régulation du transport d’électrons et des phosphorylations oxydatives4, serait un senseur du stress oxydatif et du NADPH, jouerait un rôle dans la croissance des cellules cancéreuses dans le cancer du sein (figures 3, 4 et 5), et pour finir, permettrait le stockage de triglycérides dans le tissu adipeux menant à l’obésité (figure 6). Récemment une autre fonction a été postulée : mitoNEET pourrait être impliquée dans la réparation du centre Fe-S de l’aconitase cytosolique à la suite de sa perte après un stress oxydatif (apo-aconitase ou IRP1). Cette réparation du centre Fe-S de l’aconitase (centre 4Fe-4S) se ferait par transfert du centre 2Fe-2S de mitoNEET vers IRP1 (figure 7).
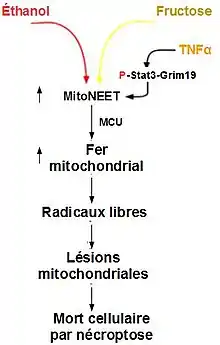
Le fructose et l'éthanol sont métabolisés principalement dans le foie. Le traitement par TNFα induit la translocation d'un complexe Stat3-Grim-19 à la mitochondrie, qui se lie à mitoNEET et favorise la libération rapide de son centre 2Fe-2S, ce qui provoque une accumulation du fer mitochondrial. L'augmentation spectaculaire du fer mitochondrial provoque une forte augmentation dans la formation d'espèces réactives de l'oxygène, ce qui entraîne des lésions mitochondriales et la mort cellulaire (notamment par nécroptose).
Croissance tumorale
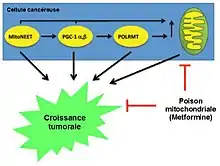
MitoNEET, PGC-1 (notamment les isoformes α et β) et POLRMT induisent tous la biogenèse mitochondriale et promeuvent efficacement la croissance tumorale, lorsqu'elle est exprimée dans les cellules cancéreuses. Ainsi, l'utilisation thérapeutique des inhibiteurs mitochondriaux ou « poisons » (tels que la metformine) va inhiber la croissance tumorale. Surtout, de nombreuses études cliniques ont montré que la metformine (un inhibiteur du complexe I mitochondrial) empêche l'apparition de presque tous les types de cancers humains chez les patients diabétiques.
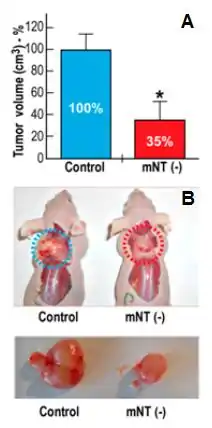
MitoNEET est requise pour la croissance tumorale. Les cellules du cancer du sein avec ou sans expression de mitoNEET (mNT -/-) ont été injectées par voie sous-cutanée dans le dos de souris et la croissance tumorale a été contrôlée au fil du temps. (A) Réduction du volume tumoral moyen exprimé en pourcentage du témoin dans les cellules mNT -/-. (B) Images de tumeurs représentatives de chaque groupe obtenues à la fin de l'expérience.
Implication intracellulaire
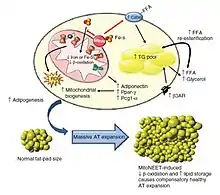
Il y a des conséquences métaboliques systémiques résultant d'une perturbation mitochondriale induite par la protéine mitoNEET. La protéine mitoNEET affecte la teneur en fer mitochondrial, qui peut contribuer à la baisse de la β-oxydation et améliore l'absorption des acides gras par la signalisation par le récepteur CD36. La fonction mitochondriale compromise déclenche donc une régulation positive compensatoire de l'adipogenèse, de la signalisation adrénergique par le récepteur adrénergique β-3 et la biogenèse mitochondriale. La diminution cellulaire dans l'activité mitochondriale améliore l’influx des lipides dans la cellule. L'incapacité à utiliser ces lipides efficacement dans les mitochondries augmente les substrats dans les groupements de triglycéride (TG). Par conséquent, les taux β-oxydation faibles, l'activité PPAR-γ élevé et les taux d'adiponectine augmentés sont accompagnés par le stockage des lipides en excès dans le tissu adipeux (AT) en expansion.
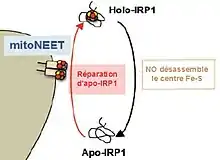
L’aconitase cytosolique (ou Holo-IRP1) perd son centre Fe-S à la suite d'un stress NO qui devient apo-IRP1. MitoNEET qui est localisée sur la membrane externe mitochondriale transfère son centre Fe-S à l’apo-IRP1 qui est réactivé en aconitase cytosolique[1],[2],[3],[4],[5],[6],[7],[8],[9],[10],[11],[12],[13],[14].
Notes et références
- (en) Jerry R. Colca, « Identification of a novel mitochondrial protein (mitoNEET) cross-linked specifically by a thiazolidinedione photoprobe », Am J Physiol Endocrinol Metab, no 286, , E252–E260
- (en) Colca JR, « Identification of a Mitochondrial Target of Thiazolidinedione Insulin Sensitizers (mTOT)—Relationship to Newly Identified Mitochondrial Pyruvate Carrier Proteins. », PLoS ONE, no 8,
- (en) Lin, J, « Crystal structure of human mitoNEET reveals distinct groups of iron-sulfur proteins. », Proc. Natl. Acad. Sci. USA, no 104, , p. 14640-14645
- (en) Wiley, S. E., « The outer mitochondrial protein mitoNEET contains a novel redox-active 2Fe-2S cluster. », The Journal of biological chemistry, no 282, , p. 23745–23749
- (en) Wiley S.E., « MitoNEET is an iron-containing outer mitochondrial membrane protein that regulates oxidative capacity. », Proc Natl Acad Sci U S A, no 27, , p. 5318-5323
- (en) Paddock, M. L., « MitoNEET is a uniquely folded 2Fe 2S outer mitochondrial membrane protein stabilized by pioglitazone. », Proc. Natl. Acad. Sci. USA, no 104, , p. 14342-14347
- (en) Xiaowei Hou, « Crystallographic Studies of Human MitoNEET. », J. Biol. Chem., no 282, , p. 33242-33246
- (en) Tao Zhou, « Binding of Reduced Nicotinamide Adenine Dinucleotide Phosphate Destabilizes the Iron-Sulfur Clusters of Human MitoNEET. », Biochemistry, no 49, , p. 9604–9612
- (en) John A. Zuris, « NADPH Inhibits [2Fe-2S] Cluster Protein Transfer from Diabetes Drug Target MitoNEET to an Apo-acceptor Protein. », JBC, no 287, , p. 11649–11655
- (en) Nataly Shulga, « Mitoneet mediates TNFa-induced necroptosis promoted by exposure to fructose and ethanol. », J Cell Sci., no 15, , p. 896-907
- (en) Ahmed F. Salem, « Mitochondrial biogenesis in epithelial cancer cells promotes breast cancer tumor growth and confers autophagy resistance. », Cell Cycle, no 11, , p. 4174-4180
- (en) Sohn YS, « NAF-1 and mitoNEET are central to human breast cancer proliferation by maintaining mitochondrial homeostasis and promoting tumor growth. », Proc Natl Acad Sci U S A., no 110, , p. 14676-14681
- (en) Kusminski CM, « MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. », Nature Medicine, no 18, , p. 1539-1549
- (en) Ferecatu I, « The drug diabetes mitoNEET governs a novel trafficking pathway to rebuild an Fe-S cluster into cytosolic aconitase/Iron Regulatory Protein 1. », J Biol Chem., no 289, , p. 28070-28086
- Portail de la biologie cellulaire et moléculaire