Microtubule
Les microtubules (MT) sont des fibres constitutives du cytosquelette, au même titre que les microfilaments d'actine et que les filaments intermédiaires.
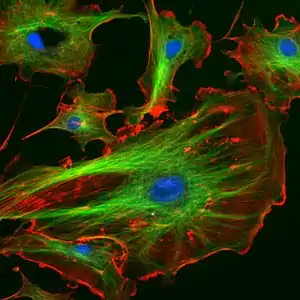
Ils ont un diamètre d'environ 25 nm et une longueur variable du fait de leur dynamique, conséquence de l'équilibre polymérisation ↔ dépolymérisation dans lequel chacune de leurs deux extrémités sont les sièges. Les microtubules sont ancrés sur le centrosome et le matériel péricentriolaire; ils irradient dans tout le cytoplasme. Ils sont impliqués dans la mitose, processus dans lequel leurs variations de longueur permanentes jouent un rôle essentiel (formation de la plaque équatoriale des chromosomes).
Ils sont absents chez les procaryotes[réf. nécessaire], et présents chez les eucaryotes. Chez les métaphytes (plantes), les microtubules sont pondéralement moins importants que chez les métazoaires (animaux).
Le temps de demi-vie des microtubules non stabilisés est d'environ 15 s durant la métaphase et de 5 min durant l'interphase.
Structure
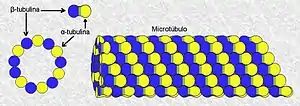
Les microtubules sont formés de dimères de tubulines constitués chacun de deux sous-unités, la tubuline α et la tubuline β, liées par des liaisons non covalentes. Les dimères sont assemblés en protofilaments qui constituent la paroi des microtubules dont l'intérieur semble "vide" sur les clichés de microscopie électronique.
Comme les dimères de tubuline sont polarisés et qu'ils sont orientés de façon également polarisée le long de chaque protofilament, une extrémité des microtubules ne présente que des tubulines β, tandis que l'autre ne présente que des tubulines α. Ces deux extrémités sont respectivement nommées (+) et (-).
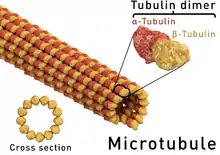
Cet assemblage (les microtubules sont des polymères) est extrêmement dynamique. Les deux extrémités des microtubules polymérisent et dépolymérisent en permanence. L'état des extrémités varie selon la concentration locale de dimères de tubuline et des propriétés cinétiques dynamiques des deux extrémités des microtubules. In vitro, l'extrémité (+), constituée de tubulines β exposées au solvant, est celle qui polymérise le plus vite. L'élongation d'un microtubule est liée à l'hydrolyse du GTP (guanosine triphosphate) qui libère de l'énergie. La molécule de GTP est scindée en deux entités: GDP+Pi, le Pi étant la molécule de phosphate inorganique. Ce tandem reste associée au dimère de tubuline avant que le Pi puis le GDP ne soient libérés en solution. Ce mécanisme génère un court segment le long du microtubule en cours d'élongation que l'on appelle: cap GDP-Pi. L'extrémité (-), constituée de tubulines α exposées au solvant, est celle qui dépolymérise le plus vite. Ainsi, à l'état d'équilibre (in vitro), un microtubule est soumis à un processus dit de treadmilling ou "tapis roulant" pendant lequel sa longueur reste constante alors que le nombre de dimères de tubulines gagnés à une extrémité égale celui de dimères perdus à l'autre. Si l'une des extrémités est "capée" (ou biochimiquement modifiée), ce processus est altéré, tout comme la dynamique du microtubule. In vivo comme in vitro, on peut observer des effondrements rapides ou, au contraire, la stabilisation des microtubules. Ces deux mécanismes sont mis à profit lors des chimiothérapies dans lesquelles on utilise de molécules qui modifient les propriétés dynamiques des deux extrémités des microtubules (par exemple, le taxol stabilise les microtubules, la colchicine, les vinblastines et autres vincristines, les déstabilisent).
Polymérisation
Il y a trois phases dans la polymérisation des dimères de tubuline qui mène à la mise en place du microtubule : la nucléation, l'élongation et l'équilibre.
La phase de nucléation consiste en l'assemblage des hétérodimères α et β de tubuline concomitant à l'hydrolyse de la GTP (guanosine triphosphate) catalysée par la sous-unité β. Ce germe constitue la base sur laquelle le microtubule croît.
Lors de la phase d'élongation, à l'état stationnaire, le microtubule croît, alors que l'hydrolyse du GTP est retardée par rapport à l'incorporation des dimères de tubulines dans le corps du microtubule. In vitro, les dimères se lient aux deux extrémités libres du microtubule, bien que la polymérisation soit plus rapide à l'extrémité (+). In vivo, le pôle (-) du microtubule est stabilisé pour être lié au centre de nucléation (centrosome), quelle que soit sa localisation dans la cellule.
À l'équilibre, la longueur du microtubule est constante, alors que les processus d'élongation et d'effondrement spontané ont des vitesses égales.
Les microtubules sont susceptibles de s'effondrer totalement sur eux-mêmes in vitro comme in vivo.
Protéines associées
Il existe des protéines associées aux microtubules ou MAP (Microtubule Associated Protein) : se lient aux microtubules et leur confèrent une fonction.
Protéines de séquestration
Dans les microtubules on associe aux monomères d'actine G liée au GTP (vide supra). On associe aux dimères de tubuline libres, des protéines de séquestration appelées stathmines.
Elles ont une double fonction:
- principalement elles fixent les dimères de tubuline en forme G libre pour en empêcher la polymérisation;
- mais elles sont impliquées aussi dans la présentation optimale des dimères libres à l’extrémité + des microtubules (stimulation de la polymérisation)
Ces protéines maintiennent une concentration faible des formes G libres (équilibre).
Ces protéines favorisent la dépolymérisation.
Protéines de fragmentation
Les protéines impliquées dans la fragmentation des microtubules sont :
- la katanine : notamment à la fin de la mitose, au moment de la cytodiérèse, rompt les microtubules en petits fragments qui se dépolymérisent en dimères. Ceux-ci peuvent se réassembler.
- MCAK : supprime les dimères des extrémités et entrainent un raccourcissement du microtubule.
- MIDD1 : MIDD1 est une protéine associée aux microtubules (MAP pour microtubule associated protein) appartenant à la famille RIP/MIDD. Cette famille est composée d’effecteurs de protéines Rho GTPase des Plantes (Rho family of GTPases Of Plants, ROP en anglais). Le MIDD1 s’accumule directement proche des microtubules dans les cellules, et in vitro, il s’y lie directement. Pendant la différentiation des cellules du xylème, MIDD1 interagit également avec kinesin-13A et induit une régulation négative des microtubules grâce au signal d’une ROP. Cela veut dire que le MIDD1 recrute la kinesin-13A pour engendrer une dépolymérisation des microtubules dans les régions où la ROP est active.[1]
Protéines stabilisatrices
Parmi les protéines stabilisatrices (ou MAP de stabilisation), on trouve:
| MAP2 | Tau | |
|---|---|---|
| Rôle | Relie 2 microtubules voisins
Solidarisent enveloppes des organites Orientent l'axe des microtubules rôle important dans les cellules nerveuses, en régulant la distance entre chaque microtubule de la dendrite. |
N'est liée qu'à 1 microtubule
Favorise le transport des vésicules et des lysosomes Organisation des microtubules |
| Localisation | Dendrites et corps cellulaires | Axone et corps cellulaires |
- Tau: elle assure le même rôle que MAP2 mais cette fois ci principalement dans les axones des cellules nerveuses. Lors du dysfonctionnement de cette protéine, on parle de tauopathie, étant l'une des causes (ou conséquences ?) des maladies neurodégénératives comme la maladie d'Alzheimer par exemple.
Dans la maladie d'Alzheimer, la protéine Tau est abondante et anormalement phosphorylée dans les neurones. Ce qui entraine une anomalie dans l'organisation des microtubules qui génère des amas neurofibrillaires avec filaments introduisant une dégénérescence neuronale.
Protéines motrices
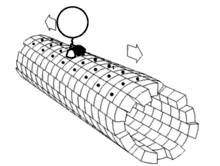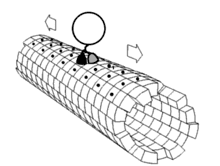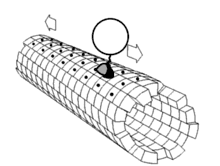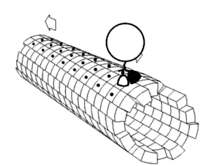
Les moteurs moléculaires sont des ATPases :
- Les kinésines, moteurs moléculaires liés à des éléments figurés qui se déplacent vers l'extrémité positive (+) des microtubules; on parle de transport antérograde.
- Les dynéines, moteurs moléculaires liés à des éléments figurés qui se déplacent vers l'extrémité négative (-) des microtubules; on parle de transport rétrograde.
Rôles
Division cellulaire (la mitose)
Les microtubules jouent un rôle très important dans la division cellulaire (mitose) et dans les courants cytoplasmiques grâce à la coopération avec les microfilaments d'actine (le déplacement des chromosomes). L'apparition des microtubules en phase G2 de l'interphase.
- Les microtubules polaires permettent aux 2 centrosomes de s'éloigner l'un de l'autre.
- Les microtubules radiaires (également appelés microtubules astériens) ancrent les centrosomes aux membranes plasmiques
- Les microtubules kinétochoriens relient les centrosome aux kinétochores (situés au niveau du centromère des chromosomes).
Transport cytoplasmique
Les déplacements cellulaires polarisés se produisent le long des microtubules et des microfilaments d'actine grâce à l'action de moteurs moléculaires spécifiques. Les microtubules sont très nombreux dans les neurones (dendrites, axones). Ils permettent d'acheminer divers composants soit vers les extrémités de ces prolongements cellulaires, soit vers le corps cellulaire lui-même. On peut les comparer à des rails le long desquels des vésicules sont transportées. La formation des vésicules synaptiques s'intègre dans ce processus très dynamique.
Le transport est possible grâce à des protéines associées aux microtubules (Microtubules-Associated Proteins ou MAP en anglais) :
- Moteurs moléculaires, entre autres
- MAP d'assemblage (protéine Tau, MAP-2 dans les neurones ; MAP-4 dans les autres types cellulaires).
- MAP de stabilisation (STOP)
Mobilité cellulaire et mouvement intracellulaire
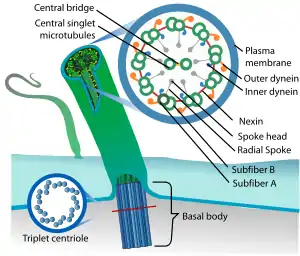
Les microtubules composent l'axonème, l'axe moteur axial des cils et des flagelles des cellules eucaryotes (spermatozoïdes protistes). Ils sont impliqués dans le transport de vésicules d'endocytose et d'exocytose, ainsi que dans la diapédèse qui dépend également des filaments d'actine.
Initiation et contrôle des motifs de la paroi cellulaire chez les plantes.
Chez les plantes, la polarisation de la membrane plasmique entraine la formation de l’architecture de la paroi secondaire, et engendre différente forme de cellules, avec des fonctions particulières. La protéine MIDD1 (voir plus haut) est ancrée dans la membrane plasmique et promeut la dépolymérisation des microtubules de façon très localisée afin de former le motif de la seconde paroi cellulaire.
Certaines ROP (Rho GTPases of Plant), ROPGEF4 et ROPGAP3 au moins, participent à l’initiation du motif en activant la ROP11. Cette protéine ainsi activée recrute MIDD1 pour induire une dépolymérisation locale des microtubules corticaux. A l’inverse, les microtubules corticaux éliminent de la membrane plasmique la ROP11 activée grâce au MIDD1. C’est grâce à cette interaction mutuellement inhibitrice entre les domaines de ROP actifs et les microtubules corticaux que le motif de la seconde paroi cellulaire peut s’établir. [2]
Autres
Les microtubules ont d'autres rôles, parmi eux le maintien de la forme tridimensionnelle des cellules.
Régulation
La biogenèse des microtubules : les MT polymérisent à partir de centres organisateurs (MTOC) :
- les centrosomes (division cellulaire).
- corpuscule basal ou cinétosome (cils et flagelles).
- la matière péricentriolaire amorphe (cellules animales) ou masse amorphe (cellules végétales) pour la polymérisation des autres MT.
Molécules agissant sur les microtubules
Il existe des inhibiteurs de la polymérisation comme la colchicine (par réaction réversible), la vinblastine, la vincristine et le nocodazole. Ceux-ci modifient l'équilibre de la réaction de polymérisation et favorisent ainsi la dépolymérisation. Ces inhibiteurs sont utilisés in vitro pour détruire le fuseau mitotique des cellules en mitose pour établir un caryotype, mais également en clinique pour lutter contre les cellules cancéreuses. Il existe aussi des inhibiteurs de dépolymérisation comme le Taxol, qui vient stabiliser les microtubules.
Pathologies liées aux anomalies biochimiques des microtubules et des MAPs
Il existe de nombreuses pathologies liées aux microtubules et aux protéines auxquelles ils sont associées. Les tubulines peuvent être altérées et conduire à des modifications de leur polymérisation et des liaisons que les microtubules contractent avec les protéines qui leur sont associées. Le syndrome de Kartagener est sémiologiquement défini comme une dyskinésie ciliaire primitive (DCP) qui est due à une altération de l'expression des gènes qui spécifient les dynéines, les kynésines et autres MAPs (microtubule associated proteins). Ces altérations biochimiques impliquent une diminution essentielle de la motilité ciliaire (et/ou flagellaire) qui aura une influence sur le système respiratoire (ciliature bronchique), l'appareil reproducteur masculin (spermatozoïdes) et féminin (altération de la ciliature des trompes de Fallope, grossesse extra-utérine) et pourra conduire à une malformation anatomique majeure, le situs inversus, vraisemblablement liée à une altération du (des) cil(s) primaire(s) essentiel(s) aux mouvements cellulaires embryonnaires précoces (symétrisation).
D'autres pathologies des microtubules:
Notes et références
Voir aussi
Liens externes
- Ressource sur le cytosquelette très complète et complémentée par sept animations 2D et 3D (entre autres l'assemblage d'un microtubule)- Kramer/Tramu, Université Bordeaux-1.
- (en) The inner life of the cell: Mini film très bien fait, par Biovision d'Harvard, de l'intérieur de la cellule. Le microtubule est le tube vert, on le voit se dépolymériser. On observe à la séquence suivante une kinésine effectuant un transport vésiculaire du pôle négatif vers le pôle positif.
- Portail de la biologie cellulaire et moléculaire