Loi de Gay-Lussac
La loi de Gay-Lussac, du nom du chimiste et physicien français Louis Joseph Gay-Lussac, est l'une des lois de la thermodynamique constituant la loi des gaz parfaits.
Énoncé
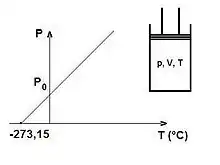
La loi de Gay-Lussac stipule qu'à volume constant, la pression d'un gaz parfait est directement proportionnelle à la température absolue (exprimée en K), soit, pour une même quantité de gaz dans deux états 1 et 2 au même volume :
En prenant comme référence un gaz à la température et sous la pression , on peut également écrire, si la température est exprimée par exemple en °C :
- , où dépend de .
On constate expérimentalement que le coefficient , pour des volumes de plus en plus grands, tend vers une valeur universelle, indépendante du gaz et environ égale à 0,003 661 = 1/273,15, lorsque les températures sont exprimées en degré Celsius.
Histoire des sciences
Le nom de loi de Gay-Lussac est également donné à la loi de Charles reliant le volume et la température à pression constante. La loi de Charles a en effet été énoncée pour la première fois par Louis Joseph Gay-Lussac en 1802, mais avait été découverte par Jacques Charles dès 1787. On réservera le nom de loi de Charles à la relation entre volume et température à pression constante et le nom de loi de Gay-Lussac à la relation entre pression et température à volume constant.
Voir aussi
Bibliographie
- Michel Lagière, Physique industrielle des fluides : Notions fondamentales et applications numériques, Paris, Éditions Technip, , 394 p. (ISBN 2-7108-0701-7, lire en ligne), p. 122.
Liens externes
- Loi de Gay-Lussac sur Bibliothèque virtuelle Allô Prof.
- Olivier Perrot (I.U.T. de Saint-Omer Dunkerque, département Génie thermique et énergie), « Cours de thermodynamique » [PDF], 2010-2011 (consulté le ).
- Portail de la physique