Liaison π
La liaison π est une liaison chimique covalente qui est créée entre deux atomes par recouvrement d'orbitales de nombre quantique secondaire ≥ 1 (orbitales p, d…). Le recouvrement est latéral, c'est-à-dire que les 2 lobes des deux orbitales en interaction sont parallèles, contrairement au cas des liaisons σ où les lobes des 2 orbitales atomiques pointent l'un vers l'autre. Par ailleurs il n'y a pas d'électron dans l'axe de liaison.
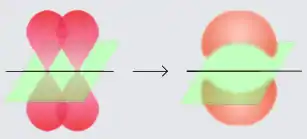
La liaison π est présente notamment dans les alcènes et dans les alcynes :
- alcènes : présence de liaisons doubles dans un squelette carboné ;
- alcynes : présence de liaisons triples dans un squelette carboné.
La présence d'une liaison π empêche toute libre rotation autour de cette liaison, car elle entraîne une rigidité moléculaire. C'est à cette rigidité qu'est due la stéréoisomérie de certains alcènes ou alcynes. De plus, la liaison π permet les réactions d'addition, car elle se casse facilement, à l'inverse de la liaison σ. Par exemple, l'ajout de diiode sur le propyne se fait par rupture des liaisons π (il reste toujours la liaison σ).
Une molécule qui possède plusieurs liaisons π (ou une liaison π et des doublets non liants ou des lacunes électroniques) présente la caractéristique de posséder plusieurs formes mésomères : les électrons sont délocalisés.
Une liaison π est moins forte qu'une liaison σ, en moyenne, une liaison π entre deux atomes de carbone a une énergie de dissociation de 250 kJ.mol-1 tandis qu'une liaison σ nécessitera 348 kJ.mol-1 pour être rompue.
Articles connexes
- Liaisons covalentes : liaison π, liaison σ, liaison δ, liaison osidique
- Liaison hydrogène
- Liaison ionique
- Liaison métallique
- Liaison de van der Waals
- Interaction orbitalaire
- Énergie de liaison
- Portail de la chimie