John Mayow
John Mayow, John Mayouwe ou John Mayo, FRS (1641-1679) est un chimiste, médecin et physiologiste britannique. C'est un pionnier dans la recherche sur la respiration et la nature de l'air. Ses conclusions sur la présence d'oxygène dans l'air précèdent d'un siècle celles d'Antoine Lavoisier et Joseph Priestley.
Biographie
Le lieu de naissance, Cornouailles ou Londres, et la date de naissance, de 1641 à 1645, de John Mayow prêtent à controverses. L'historien Donald F. Proctor, après de longues recherches, avance que Mayow est né en 1641 dans la paroisse de Morval du comté des Cornouailles et qu'il a été accepté en 1658 au Wadham College de l'université d'Oxford à l'âge de 17 ans[1]. L'année suivante, il est érudit à Oxford. En 1660, il est élu membre du All Souls College. Il est diplômé en droit (bachelor en 1665, puis docteur en 1670)[2].
Il se tourne cependant vers la médecine, où il se taille une bonne réputation dans une pratique établie à Bath dans le Somerset, travaillant surtout en période estivale. En 1678, sur recommandation de Robert Hooke, Mayow est élu membre de la Royal Society[3]. L'année suivante, il meurt à Londres. Son corps est enterré à l'église Saint-Paul de Covent Garden[2].
Le nom de ce savant britannique s'orthographie « John Mayow », « John Mayouwe » ou « John Mayo »[3].
Travaux
Mayow publie en 1668, à Oxford, deux documents sur la respiration et le rachitisme. Les deux seront réimprimés en 1674, le premier étant corrigé, avec trois autres : De sal-nitro et spiritu nitro-aereo , De respiratione foetus in utero et ovo et De motu musculari et spiritibus animalibus, dans l'ouvrage Tractatus quinque medico-physici. Ce travail, republié plusieurs fois et traduit en néerlandais, allemand et français, démontre qu'il est un chercheur largement en avance sur son époque.
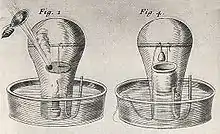
Postulant que l'air est essentiel à la combustion, tel que démontré par les expériences de Robert Boyle, Mayow démontre que le feu se manifeste grâce à une partie de l'air. Il la nomme spiritus igneo-aereus et parfois nitro-aereus (parce qu'il l'a identifié comme la partie acide du nitre, c'est-à-dire le nitrate de potassium), substance qu'il pense formée par l'union d'un alcali avec une essence d'acide. Lors d'une combustion, la particulae nitro-aereae – qu'elle soit partie de la substance consommée ou qu'elle provienne de l'air – se combine avec le matériel brûlé. Mayow observe que l'antimoine, porté à très haute température, voit sa masse augmentée et conclut que ce phénomène doit être imputé à ces particules.
Mayow a aussi argué que ces mêmes particules sont consommées lors du processus respiratoire, parce qu'il a découvert que s'il enfermait un petit animal et une chandelle allumée dans un récipient scellé et rempli d'air, l'animal mourait peu de temps après que la chandelle se soit éteinte. S'il n'y avait pas de chandelle allumée, l'animal vivait deux fois plus longtemps. Il conclut donc que cette composante de l'air est absolument essentielle à la vie et fait l'hypothèse que les poumons la séparent de l'air tout en le poussant dans le sang. Il infère de plus qu'il est nécessaire à l'activité musculaire, le savant pense donc que la contraction des muscles est possible à la suite de la combinaison avec d'autres particules combustibles (salino-sulfureuses) se trouvant dans le corps. Il conclut que le cœur, constitué de tissu musculaire, cesse de battre quand la respiration cesse. La chaleur animale est aussi le résultat de la combinaison de particules nitro-aériennes, obtenues grâce à la respiration, avec des particules combustibles du sang.
On peut donc conclure que Mayow – qui a fait une remarquable description anatomique du processus de respiration – précède d'un siècle Joseph Priestley et Antoine Lavoisier en déterminant l'existence de l'oxygène, l'appelant spiritus nitro-aereus en tant que partie distincte de l'air. Mayow a perçu le rôle du spiritus nitro-aereus dans la combustion et dans l'augmentation de la masse des calces (oxydes) des métaux (lorsque comparées aux masses des métaux qui n'ont pas réagi). Rejetant les conceptions courantes de l'époque (la respiration sert à faire refroidir le cœur, aide à faire passer le sang du côté gauche au côté droit du cœur ou ne fait qu'agiter le cœur), Mayow a vu dans l'inspiration un mécanisme pour introduire de l'oxygène dans le sang, où il est consommé lors de la production de chaleur ou dans l'activité musculaire. Il conçoit même, de façon confuse, l'expiration comme un mécanisme de sécrétion. Grâce à des vases en forme de cloche plongés dans de l'eau, Mayow calcule que la substance active (l'oxygène) constitue le cinquième de l'air par la masse[4].
Une partie des conclusions de Mayow sont en accord avec les travaux modernes sur l'air et la combustion[3]. Mayow a observé, comme d'autres avant lui, l'augmentation de masse des matériaux soumis à une forte chaleur. Antoine Lavoisier (1743–1794) et d'autres plus tard ont conclu que ce gain était la conséquence d'une réaction avec une substance gazeuse dans l'air.
Pour une critique des travaux de Mayow, consulter Holmyard[5] et Hudson[6], auteurs qui font des comparaisons avec les notions modernes de chimie.
Œuvres
- (la) Tractatus de respiratione et de rachitide, 1669
- (la) Tractatus Quinque Medico-Physici, 1674
- (la) Opera omnia medico-physica, 1681
- (la) Tractus de sal-nitro et spiritu nitro-aëreo, Oxford, 1669
- (en) John Mayow, Medico-physical Works : Being a translation of Tractatus Quinque Medico-physici, Édinbourg, The Alembic Club, (lire en ligne) (publié la première fois en 1674)
Notes et références
(en) Cet article est partiellement ou en totalité issu de la page de Wikipédia en anglais intitulée « John Mayow » (voir la liste des auteurs).
- (en) Donald F. Proctor, A History of Breathing Physiology, New York, Marcel Dekker, Inc., , 416 p. (ISBN 0-8247-9653-5)
- (en) A. A. Wood, Athenae Oxonienses. An Exact History of all the Writers and Bishops who Have Had Their Education in the University of Oxford, vol. III, Londres, F., C. & J. Rivington, , p. 1199
- (en) Philip Joseph Hartog, « Mayow, John », dans Sidney Lee, Dictionary of National Biography, vol. 37, Londres, Smith, Elder & Co., 1885-1900 (lire en ligne)
- Calcul avec une très bonne approximation pusique sa proportion exacte est de 20,95 %
- (en) Eric John Holmyard, Makers of Chemistry, Oxford, Oxford University Press, , 154–158 p.
- (en) John Hudson, The History of Chemistry, New York, Chapman and Hall, , 44–46 p. (ISBN 0-333-53551-0)
Annexes
Bibliographie
- (en) « John Mayow (1641–1679) », JAMA, vol. 197, no 5, , p. 364–365 (PMID 5329985, DOI 10.1001/jama.1966.03110050102029)
- (en) J. J. Beringer, « John Mayow: Chemist and Physician », Royal Institution of Cornwall, vol. IX, 1886–1899, p. 319–324 (lire en ligne, consulté le )
- (de) W. Boehm, « [John Mayow and Descartes] », Sudhoffs Archiv für Geschichte der Medizin und der Naturwissenschaften, vol. 46, , p. 45–68 (PMID 13870464)
- (en) Alexander Crum Brown, « Dr. John Mayow: The Harveian Oration for 1899 », Y. J. Pentland., vol. 6, , p. 116–129 (lire en ligne, consulté le )
- (en) J. R. Partington, « The life and work of John Mayow (1641–1679) », Isis, vol. 47, no 149, , p. 217–30 (PMID 13366533, DOI 10.1086/348501)
- (en) J. R. Partington, « Some early appraisals of the work of John Mayow », Isis, vol. 50, no 3, , p. 211–26 (PMID 14430648, DOI 10.1086/348773)
- (en) Donald F. Proctor, A History of Breathing Physiology, New York, Marcel Dekker, Inc., , 416 p. (ISBN 0-8247-9653-5, lire en ligne) (consulter en particulier les chapitres 7 à 9 qui portent sur la vie et l'œuvre de Mayow)
- (en) G. L. Sternbach et J. Varon, « Resuscitation Great. John Mayow and oxygen », Resuscitation, vol. 60, no 3, , p. 235–237 (PMID 15050753, DOI 10.1016/j.resuscitation.2003.12.013)
Liens externes
- Notices d'autorité :
- Fichier d’autorité international virtuel
- International Standard Name Identifier
- Bibliothèque nationale de France (données)
- Système universitaire de documentation
- Bibliothèque du Congrès
- Gemeinsame Normdatei
- Service bibliothécaire national
- Bibliothèque nationale d’Espagne
- Bibliothèque royale des Pays-Bas
- Bibliothèque nationale d’Israël
- Bibliothèque nationale de Catalogne
- Bibliothèque nationale de Suède
- Bibliothèque apostolique vaticane
- WorldCat Id
- WorldCat
- Ressources relatives aux beaux-arts :
- (en) British Museum
- (en) National Portrait Gallery
- Ressource relative à la santé :
- Ressource relative à la recherche :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Portail du Royaume-Uni
- Portail de la chimie
- Portail de la médecine