Inflammation
L'inflammation est la réaction du système immunitaire stéréotypée à une agression externe (infection, trauma, brûlure, allergie, etc.) ou interne (cellules cancéreuses). C'est un processus dit ubiquitaire ou universel qui concerne tous les tissus, faisant intervenir l'immunité innée et l'immunité adaptative.
L'inflammation chronique est une réponse à de nombreuses transformations de l'environnement et du comportement modernes (elle est favorisée par la sédentarité, la mauvaise hygiène alimentaire (malbouffe), la pollution, les altérations du microbiote humain) et un facteur important dans le développement de maladies de civilisation telles que la résistance à l'insuline, l'obésité, les maladies cardiovasculaires, les maladies immunitaires, et même les troubles de l'humeur et du comportement[1].
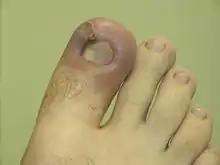
Symptômes et signes biologiques
Signes et symptômes physiques
L’inflammation peut se manifester par :
- une rougeur (érythème correspondant à une vasodilatation locale) ;
- un gonflement (œdème) ;
- une sensation de chaleur ;
- une douleur qui semble pulser ;
- une éventuelle altération du fonctionnement de l’organe concerné (ex. : difficulté à bouger (impotence fonctionnelle) dans le cas d'une articulation).
On fait parfois référence aux noms latins, notamment dans les langues étrangères, pour décrire les manifestations de l’inflammation. Ces manifestations ont été décrites il y a 2 000 ans par Celsus : rubor (rougeur), calor (chaleur), tumor (gonflement), dolor (douleur), functio laesa (impotence fonctionnelle). Si l’inflammation est connue depuis l’Antiquité, l’impotence fonctionnelle a été rajoutée à sa définition par Rudolf Virchow en 1858.
Signes biologiques
Le phénomène inflammatoire s'accompagne de modifications biologiques telles que l'augmentation de la concentration sanguine de plusieurs protéines dont l'haptoglobine, la céruloplasmine, des globulines, ou la protéine C réactive (CRP). Une électrophorèse des protéines plasmatiques permet d'objectiver ces changements dans leur globalité[pas clair].
L'élévation des « protéines inflammatoires » accroît la vitesse de sédimentation.
La ferritine augmente, reflétant la séquestration tissulaire du fer sérique. Cette séquestration est secondaire à l'augmentation de la sécrétion d'hepcidine, médiée notamment par l'interleukine 6. Cette séquestration est un des facteurs concourant à l'installation d'une anémie sur le long terme (anémie inflammatoire).
Dans certains cas, une polynucléose neutrophile est présente.
Mécanisme inflammatoire
L'inflammation se déroule en trois temps.
Phase vasculaire ou vasculo-exsudative
Elle est déclenchée par l'action de médiateurs chimiques, on constate :
- La libération d'amines vaso-actives préformées par les mastocytes (histamine et sérotonine) ;
- L'activation de protéines plasmatiques inactives (facteur XII (Hageman), bradykinine, kallikréine, complément) ;
- La sécrétion de médiateurs lipidiques (prostaglandines dont prostacycline, leucotriènes, facteur d'activation plaquettaire (PAF)).
Cette première phase comporte trois phénomènes.
Congestion active
Sous l'influence de médiateurs chimiques, les cellules endothéliales (formant les vaisseaux sanguins) s'activent. Cela entraîne une vasodilatation locale artériolaire puis capillaire[2] qui provoque :
- une augmentation de l'apport sanguin ;
- une diminution de la vitesse du flux sanguin.
Ce gonflement local des vaisseaux sanguins provoque la rougeur et la sensation de chaleur. Il a pour but d’augmenter la circulation du sang afin d’évacuer les cellules mortes et les toxines (détersion), et d’apporter les éléments nécessaires à la guérison, notamment des globules blancs pour combattre les corps étrangers.
Les cellules inflammatoires, dont les leucocytes, se dirigent de façon unidirectionnelle vers le lieu de l’inflammation, par le chimiotactisme. Ces leucocytes ont tendance à quitter le milieu du courant dans la région inflammatoire pour s’accoler à la paroi de l’endothélium du vaisseau, par la margination. Cette margination est le fait des molécules d’adhésion (CAM, intégrines, sélectines).
Parallèlement à la congestion active, les cellules endothéliales activées expriment des molécules d'adhésion (nécessaires à la diapédèse) tandis que le vaisseau devient plus perméable (épanchement de l’eau du plasma sanguin par osmose vers les tissus, ce qui provoque l’œdème).
Œdème inflammatoire
L’œdème inflammatoire est la conséquence du passage du plasma (plus précisément d'un exsudat) dans la zone lésée. Il se traduit par un gonflement du tissu touché et comprime les nerfs alentour, provoquant la sensation douloureuse et les démangeaisons.
Il a plusieurs rôles : il permet l'apport jusqu'à la lésion de moyens de défense (immunoglobulines, protéines du complément...), la dilution de l'agent pathogène et la limitation du foyer inflammatoire.
Diapédèse leucocytaire
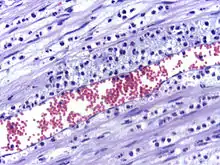
La diapédèse leucocytaire est le phénomène permettant le passage des leucocytes de la circulation sanguine jusqu'au foyer de l'inflammation. On peut distinguer trois étapes :
- Margination leucocytaire ;
- Rolling : interaction des leucocytes et des cellules endothéliales par l'intermédiaire de sélectines ;
- Diapédèse : passage de la paroi endothéliale par les leucocytes, qui commence par l'adhésion cellulaire par l'intermédiaire des intégrines et de molécules d'adhésion (ICAM, en anglais : intercellular adhesion molecule).
Phase cellulaire
La phase cellulaire fait suite à la diapédèse, lorsque les leucocytes sont amassés dans le tissu interstitiel.
Elle correspond à la formation du granulome inflammatoire[Note 1]. Il participe à la détersion (rôle des granulocytes et des macrophages) et permet le développement de la réaction immunitaire adaptative. Les cellules composant le granulome ont également un rôle de sécrétion de médiateurs chimiques.
La résolution de l'inflammation
Un changement de paradigme sur la façon d’appréhender l’inflammation
L’inflammation bien contrôlée est une réponse normale du corps qui nait s’amplifie et s’éteint. Elle est consécutive à une agression interne (comme un cancer) ou externe (comme une infection). Lorsque le corps n’arrive plus à maîtriser l’inflammation, celle-ci peut engendrer des maladies diverses comme le diabète, le cancer ou devenir chronique comme l’arthrite, la maladie de Crohn par exemples.
Des efforts importants ont été déployés pour comprendre les mécanismes moléculaires inflammatoires et comment les combattre. En effet, une inflammation de trop longue durée ou trop intense peut avoir des effets délétères sur l’organe où elle siège et potentiellement entraver sa fonction. Les mécanismes de la phase d’initiation de l’inflammation sont maintenant bien compris. En revanche, les mécanismes de la phase d’arrêt de l’inflammation n’étaient jusque récemment pas connus[3]. Ces dernières années, les travaux de l’équipe du professeur Charles Serhan, de l’École de Médecine de Harvard CETRI (Center for Experimental Therapeutics and Reperfusion : injury), ont permis de comprendre cette phase appelée résolution[4] caractérisée par l’arrêt de la réponse inflammatoire, la réparation du tissu enflammé pour permettre au final le retour à l’état initial du tissu appelé homéostasie.
De nombreuses études scientifiques[5] démontrent ainsi que le corps humain dispose de mécanismes naturels pour contrôler et programmer l’arrêt de l’inflammation. Ces mécanismes portent le nom de Résolution, processus associé à la synthèse d’une famille de molécules spécifiques appelée SPM (en) pour médiateurs spécialisés de la résolution ou Specialized Pro-resolving Mediators en anglais.
Qu’est ce que la résolution ?
On peut définir la résolution de l’inflammation comme le processus biologique naturel et indispensable pour stopper naturellement l’inflammation. Ce mécanisme est piloté par des médiateurs appelés SPM issus des acides gras polyinsaturés (AGPI) comme les oméga 3.
Les AGPI qui donnent naissances aux SPM sont l’acide arachidonique (AA), l’acide docosahexahenoique (DHA), l’acide eicosapentaénoique (EPA) et l’acide docosapentaénoique (DPA). Ainsi l’AA va donner naissance aux lipoxines, l’EPA au résolvines de type E, le DHA aux résolvines de type D, aux marésines, aux protectines et le DPA aux résolvines de la famille n-3.
Dans certains cas, le corps ne produit pas ces molécules en quantité suffisante ou au bon moment. L’arrêt de l’inflammation est alors altéré et peut s’accompagner de complications telles que fibrose, cicatrices ou perdurer de façon chronique.
De nombreux travaux ont ainsi permis de mieux comprendre la finesse des mécanismes mis en place naturellement par notre organisme et de démontrer que les réponses inflammatoires chroniques semblent être dues à un défaut de résolution.
A la faveur de ces découvertes, l’enjeu pour arrêter l’inflammation n’est donc plus de la bloquer, mais de la réguler en favorisant sa phase de résolution. Ce nouveau champ de recherches porte le nom de pharmacologie de la résolution[6].
Le mode d’action des SPM (Specialized Pro-resolving Mediator)
Les SPM[7] agissent de façon différente aux anti-inflammatoires et représentent donc une alternative thérapeutique très prometteuse pour arrêter de façon programmée l’inflammation sans la bloquer.
Ils agissent en :
- Contrebalançant l’effet des médiateurs pro-inflammatoires,
- Diminuant la pénétration des polynucléaires dans les tissus inflammés,
- Stimulant la défense innée par phagocytose (cellules apoptotiques, pathogènes…),
- Atténuant la douleur,
- Favorisant la régénération des tissus,
Les SPM présentent des activités biologiques très bénéfiques car ils sont synthétisés au niveau du site inflammatoire et passent dans la circulation sanguine pour exercer leur activité à distance (activité autacoïde). Ils vont permettre ainsi d’arrêter l’inflammation (en inhibant les voies dépendantes de NF-kB par exemple). En permettant un arrêt programmé de l’inflammation, ils évitent le versant fibrotique d’une mauvaise cicatrisation et favorisent les capacités de défense de l’organisme (ils sont non immunosuppresseurs).
Comment sont mesurés les SPM ?
Il existe actuellement deux méthodes principales pour mesurer les SPM :
- Les tests EIA (Enzyme Immunosorbant assay). Cette méthode est limitée car peu de kits sont disponibles et ils ne permettent de quantifier qu’un marqueur à la fois alors que les SPM sont une famille de molécule
- La chromatographie liquide associé à la spectrométrie de masse (ou LC/MS/MS). Il s’agit de la technique de référence qui permet de coupler sensibilité et robustesse pour l’identification de plusieurs SPM en une analyse unique. Des méthodes de quantification des SPM par LC/MS/MS ont été décrites dans la littérature[8].
Des preuves de l’efficacité des SPM
Des études cliniques montrent que l’augmentation des SPM dans le corps est corrélée à une amélioration clinique de l’état inflammatoire.
C’est le cas par exemple de l’étude Barden publiée en 2016[9]qui a montré une corrélation négative entre la douleur perçue par le patient et la présence de RVE2 dans le liquide synovial suggérant que la production de SPM peut être associée à la gestion naturelle de l’inflammation et de la douleur par le corps humain.
En effet dans les modèles animaux d’autres SPM ont également montré des effets atténuateurs sur la douleur[9],[10]. Ces effets analgésiques sont médiés par des récepteurs spécifiques couplés aux protéines G[11].
Pour aller plus loin dans les recherches sur le rôle des SPMs dans les maladies inflammatoires, l’Union européenne via son programme H2020, a sélectionné et financé le projet immunAID (H2020-EU.3.1.1. Grant agreement no: 779295). Ce projet est coordonné par l’INSERM et il est composé de 24 partenaires dans 12 pays.
Inflammation et pathologies
Des études récentes ont lié l'inflammation chronique à plusieurs types de pathologies, dites « maladies de civilisation » : maladies cardio-vasculaires, diabète et obésité...
L'état inflammatoire chronique est reconnu favoriser le développement des tumeurs et a fortiori des tumeurs cancéreuses,.
Lutte contre l'inflammation
L’inflammation, est une réaction de défense généralement bénéfique, mais pose parfois problème, par la douleur qu'elle engendre ou lorsqu'elle perdure et devient chronique, risquant alors de nuire à la structure ainsi qu'à la fonction de l'organe touché.
Moyens thérapeutiques
Le froid (glace à travers un tissu par exemple) suffit parfois à combattre l’inflammation (il induite une vasoconstriction, diminuant l’œdème et calme la douleur).
Des médicaments anti-inflammatoires peuvent calmer les symptômes ou limiter les effets délétères de l'inflammation sur l'organisme. On distingue les anti-inflammatoires non stéroïdiens et les glucocorticoïdes. Ces médicaments existent sous de nombreuses formes (orale, suppositoire, inhalation, perfusion ou bien locale par pommade, collyre...) selon les indications.
Des thérapies récentes (biothérapies) bloquent spécifiquement certains médiateurs de l'inflammation (anti-TNFα, anti-IL4...). Elles ont révolutionné la prise en charge de maladies inflammatoires telles que la polyarthrite rhumathoïde ou les spondylarthrites ankylosantes mais avec des effets secondaires.
Mode de vie et alimentation
Certains aliments contribuent à réduire l'inflammation - ou ses marqueurs sanguins -, en particulier les omega-3[12],[13],[14],[15] (contenus dans les poissons gras et l'huile de lin ou de colza par exemple), les anthocyanes (contenus dans les fruits rouges et la betterave par exemple), le bêta-glucane (contenu par l'avoine et les grains entiers par exemple), le riz complet[16], le thym, le curcuma[17], le gingembre[18], le chou, l'ananas, l'huile d'olive[19], les noix, l'ail[20], les oignons[21]. À l'inverse, les aliments à fort indice glycémique ou à forte charge glycémique (sucre, amidon par exemple) contribuent à augmenter ces marqueurs sanguins[22].
La restriction calorique semble réduire l'inflammation. Dans une étude de restriction calorique portant sur 218 personnes pendant 2 ans, dénommée CALERIE[23], le taux de Protéine C réactive a baissé de 47 %.
Micronutrition
Basée sur l’approche développé par le Professeur Charles Serhan[24], Professeur à l’école de médecine de Harvard, qui a établi le concept de résolution de l’inflammation à la suite de la découverte des SPM, une approche micronutritionnelle peut également être développée pour lutter contre l’inflammation.
Elle consiste en premier lieu à apporter à notre corps le substrat qui lui permet d'augmenter la synthèse de SPM lors d’une réponse inflammatoire, qu’elle soit aiguë, chronique ou de bas grade. Cet apport peut se faire via l’ingestion d’acides gras polyinsaturés spécifiques enrichis en SPM ou favorisant la production de SPM.
Types d’inflammation
Selon la persistance de l'inflammation
Selon la morphologie du foyer inflammatoire
- Inflammation non spécifique
- Inflammation spécifique
Localisation
Selon l’endroit où est située l’inflammation, elle peut prendre différents noms, en général en -ite :
- amygdalite (ou angine) : inflammation de l’amygdale ;
- appendicite : inflammation de l’appendice iléo-cæcal ;
- artérite : inflammation d’une artère ;
- arthrite : inflammation des articulations ;
- blépharite : inflammation de la paupière ;
- bouton d'acné ou comédon : inflammation généralement située sur le visage ;
- bronchite : inflammation aiguë des bronches et des bronchioles ;
- capillarite : inflammation des petits vaisseaux cutanés ;
- catarrhe : inflammation des muqueuses, des voies respiratoires, accompagnée d'une hypersécrétion (terme vieilli) ;
- cellulite : inflammation de la peau ;
- cérébellite : inflammation du cervelet ;
- colite : inflammation du côlon ;
- conjonctivite : inflammation de la conjonctive (surface de l’œil) ;
- cholécystite: inflammation de la vésicule biliaire ;
- cystite : inflammation de la vessie ;
- dermatite ou dermite : inflammation de la peau ;
- desmodontite : inflammation du desmodonte (dent) ;
- encéphalite : inflammation de l’encéphale (cerveau) ;
- endocardite : inflammation de l’endocarde ;
- endométrite : inflammation de l'utérus ;
- endophtalmie : inflammation de l'œil ;
- entérite : inflammation de l’intestin grêle ;
- épicondylite ou épitrochléite : inflammation de l’épicondyle ou de l’épitrochlée de l'humérus ;
- épididymite : inflammation de l’épididyme ;
- gastrite : inflammation de l’estomac ;
- gastro-entérite : inflammation simultanée de l’estomac et de l’intestin grêle ;
- gingivite : inflammation des gencives ;
- labyrinthite : inflammation du labyrinthe ;
- laryngite : inflammation du larynx ;
- mammite ou mastite : inflammation de la glande mammaire. En particulier, en médecine vétérinaire, inflammation du pis de la vache ;
- méningite : inflammation des méninges ;
- mastoïdite : inflammation de la mastoïde ;
- mucite : inflammation de la bouche ;
- myélite : inflammation de la moelle épinière ;
- myocardite : inflammation du myocarde (muscle du cœur) ;
- néphrite : inflammation du rein ; le mot n’est guère plus utilisé seul, mais dans le nom de maladies touchant le rein qui ne sont pas toutes inflammatoires : glomérulonéphrite, tubulonéphrite, pyélonéphrite ;
- névrite : inflammation d'un nerf ;
- orchite : inflammation du testicule ;
- otite : inflammation de l’oreille ;
- ostéite ou ostéomyélite : inflammation de l’os et de sa moelle ;
- panaris : inflammation du doigt ;
- pancréatite : inflammation du pancréas ;
- parotidite : inflammation des glandes salivaires ;
- péricardite : inflammation du péricarde ;
- péritonite : inflammation du péritoine ;
- pharyngite : inflammation du pharynx ;
- pleurésie : inflammation de la plèvre ;
- poliomyélite : inflammation de la moelle épinière (de la substance grise) ;
- pulpite ou rage de dent : inflammation de la pulpe dentaire ;
- rhinite ou rhume : inflammation du nez ;
- salpingite : inflammation de la trompe utérine ;
- sinusite : inflammation des sinus ;
- stomatite : inflammation des muqueuses buccales ;
- tendinite : inflammation des tendons ;
- phlébite ou (thrombose veineuse profonde) : inflammation d’une veine causée par un caillot ;
- trachéite : inflammation de la trachée ;
- urétrite : inflammation de l’urètre (canal urinaire) ;
- uvéite : inflammation de l'uvée.
Notes et références
Références
- SL Prescott, « Early-life environmental determinants of allergic diseases and the wider pandemic of inflammatory noncommunicable diseases », J Allergy Clin Immunol, vol. 131, no 1, , p. 23-30. (PMID 23265694, DOI 10.1016/j.jaci.2012.11.019)
- « Cours », sur campus.cerimes.fr (consulté le )
- « L’inflammation, une immunité innée qui s’est retournée contre l’humanité », Le Monde, (lire en ligne, consulté le )
- (en) Charles Serhan, « Pro-resolving lipid mediators are leads for resolution physiology », Nature, (lire en ligne)
- Serhan C. N., Brain S. D., Buckley C. D., Gilroy D. W., Haslett C., O'Neill L. A. J., Perretti M., Rossi A. G., Wallace J. L. (2007) Resolution of inflammation: state of the art, definitions and terms. FASEB J. 21, 325–332 [PMC free article] [PubMed] [Google Scholar]
- Perretti M1, Leroy X2, Bland EJ3, Montero-Melendez T4. Resolution Pharmacology: Opportunities for Therapeutic Innovation in Inflammation. Trends Pharmacol Sci. 2015 Nov;36(11):737-755. doi: 10.1016/j.tips.2015.07.007. Resolution Pharmacology: Opportunities for Therapeutic Innovation in Inflammation.
- Inflammation : Mieux vaut stimuler sa résolution qu'empêcher son déclenchement Le Monde Consulté le 1 mai 2020
- (en) Le Faouder, Baillif V, Spreadbury I, Motta JP, Rousset P, Chêne G, Guigné C, Tercé F, Vanner S, Vergnolle N, Bertrand-Michel J, Dubourdeau M, Cenac N., « LC-MS/MS method for rapid and concomitant quantification of pro-inflammatory and pro-resolving polyunsaturated fatty acid metabolites. », Science DIrect, (lire en ligne)
- (en) Barden, Moghaddami, Mas, Phillips, Cleland, Mori, « Specialised pro-resolving mediators of inflammation in inflammatory arthritis. », sur https://www.ncbi.nlm.nih.gov/pubmed/27033423,
- (en) Sungwhan F. Oh, Maria Dona, Gabrielle Fredman, Sriram Krishnamoorthy, Daniel Irimia and Charles N. Serhan, « Resolvin E2 Formation and Impact in Inflammation Resolution », sur The Journal of Immunology,
- (en) Gheorghe, Korotkova M, Catrina AI, Backman L, af Klint E, Claesson HE, Rådmark O, Jakobsson PJ., « Expression of 5-lipoxygenase and 15-lipoxygenase in rheumatoid arthritis synovium and effects of intraarticular glucocorticoids. », sur Pub Med.Gov,
- Effects of selected bioactive food compounds on human white adipocyte function.
- Shahida A. Khan, Ashraf Ali, Sarah A. Khan et Solafa A. Zahran, « Unraveling the complex relationship triad between lipids, obesity, and inflammation », Mediators of Inflammation, vol. 2014, , p. 502749 (ISSN 1466-1861, PMID 25258478, PMCID 4166426, DOI 10.1155/2014/502749, lire en ligne, consulté le )
- (en) Bello KJ, Fang H, Fazeli P, Bolad W, Corretti M, Magder LS, Petri M, « Omega-3 in SLE: a double-blind, placebo-controlled randomized clinical trial of endothelial dysfunction and disease activity in systemic lupus erythematosus », Rheumatol International,
- (en) Kiecolt-Glaser JK, Belury MA, Andridge R, Malarkey WB, Glaser R, « Omega-3 supplementation lowers inflammation and anxiety in medical students: a randomized controlled trial », Brain Behav Immun.,
- Effect of Brown Rice Consumption on Inflammatory Marker and Cardiovascular Risk Factors among Overweight and Obese Non-menopausal Female Adults
- Curcumin: an anti-inflammatory molecule from a curry spice on the path to cancer treatment
- Ginger Extract (Zingiber Officinale) has Anti-Cancer and Anti-Inflammatory Effects on Ethionine-Induced Hepatoma Rats
- Effects of Olive Oil on Markers of Inflammation and Endothelial Function—A Systematic Review and Meta-Analysis
- Antihyperglycemic, antihyperlipidemic, anti-inflammatory and adenosine deaminase– lowering effects of garlic in patients with type 2 diabetes mellitus with obesity
- Foods that fight inflammation, Harvard Medical School
- (en) Buyken AE, Goletzke J, Joslowski G, et al., « Association between carbohydrate quality and inflammatory markers: systematic review of observational and interventional studies », The American Journal of Clinical Nutrition, vol. 99, no 4, , p. 813-833 (DOI 10.3945/ajcn.113.074252, lire en ligne)
- NIH study finds calorie restriction lowers some risk factors for age-related diseases
- « Charles Serhan »
Notes
- La présence d'un granulome inflammatoire ne signifie pas qu'il s'agit d'une inflammation granulomateuse, caractérisée par la présence de cellules géantes et de cellules épithélioïdes
Voir aussi
Articles connexes
Liens externes
- Portail de la biologie
- Portail de la médecine
