Indium
L'indium est l'élément chimique de numéro atomique 49, de symbole In.
| Indium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
.jpg.webp) Échantillon d'indium. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | In | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Indium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 49 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 13 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 5e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Métal pauvre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Kr] 4d10 5s2 5p1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 18, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 114,818 ± 0,003 u[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 155 pm à 153 pm (193 pm non lié) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 142 ± 5 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 193 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | 1, 2 (accessoire), 3 (le plus commun pour les applications semi-conductrices) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,78 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | basique (sesquioxyde d'indium) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 5,78636 eV | 2e : 18,8703 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 28,03 eV | 4e : 54 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 7,31 g·cm-3 (20 °C)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Tétragonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté | 1,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Gris argenté, blanc argenté | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 156,5985 °C (congélation)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 2 072 °C[1], 2 000 °C ou 1 999,85 °C[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 3,263 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 231,5 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 15,76×10-6 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 1,42×10-17 Pa à 156,6 °C[réf. souhaitée], 8,31×10-11 Pa à 326,85 °C[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 1 215 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 233 J·kg-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 11,6×106 S·m-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 81,6 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | soluble dans HCl[7] et autres acides minéraux, insoluble dans l'eau, (pratiquement) insoluble dans les bases. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.028.345 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 231-180-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Attention |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cet article concerne l'élément chimique indium, le corps simple et les diverses combinaisons de l'élément. Pour les autres significations, voir Indium (homonymie).

Généralités sur l'élément indium et son corps simple
Cet élément monoisotopique stable appartient au bloc p, au groupe 13 et à la période 5 et au groupe IIIA dit du bore du tableau périodique ainsi qu'à la famille des métaux pauvres. Le rayon atomique de l'indium avoisine 150 pm (1,50 Å).
Le corps simple indium In est un métal gris brillant, à bas point de fusion à peine supérieur à 156 °C, résistant à la corrosion atmosphérique.
Ce métal malléable présente une chimie assez analogue à l'aluminium et au gallium, mais aussi au cadmium et au thallium. L'électronégativité selon Pauling est de l'ordre de 1,7(̠8), alors que celles du Ga et Al avoisinent respectivement 1,6 et 1,5.
Il est rare. L'indium est resté un « métal ou un élément de laboratoire » jusque dans le début de l'entre-deux-guerres[10]. En 1924, on découvre que l'indium peut stabiliser les métaux non ferreux[11]. En 1940, l'indium comme revêtement protecteur et anticorrosion de longue durée améliore les roulements à billes du matériel aéronautique militaire. Au début des années 1970, selon le chimiste Bruce Mahan, l'indium ne présente pas d'usage important. Au début des années 1980, les contributeurs chimistes de l'Encyclopedia Universalis admettent qu'il y a peu de composés d'indium étudiés et bien connus (probablement en vue d'applications). Sa récente utilisation massive, notamment dans les écrans plats LCD, ont fait passer son prix de 80 à 800 €/kg (70 à 1 000 $/kg aux taux courants[12]) entre 2001 et 2005[13],[14]. La pénurie actuelle en fait une matière première minérale critique.
Histoire

L'indium, nommé d'après la couleur supposée analogue à l'indigo (indǐcum en latin classique et indium en latin médiéval) au test de flamme, couleur composite expliquée en réalité par une raie bleu foncé intense et une raie violette plus faible de son spectre atomique, a été découvert par Ferdinand Reich et Hieronimus Theodor Richter en 1863 alors qu'ils testaient des minerais de zinc et de cuivre à base de "blende de Freiberg" avec un spectrographe inventé par Robert Wilhelm Bunsen pour y prouver, par la couleur verte, la présence du thallium.
Le chimiste Richter isole facilement le sulfure d'indium et le chlorure d'indium, puis l'hydroxyde d'indium avant de se perdre dans les (sous)oxydes d'indium. Toutefois il réussit une double réduction à partir du sesquioxyde d'indium, d'abord à l'aide de charbon de bois ou charbon actif et de soude, puis par flux de gaz hydrogène à isoler de façon quantitative le corps simple métal en 1867[15]. Il faut 100 kilogrammes de blende de Freiberg à un chimiste confirmé dans les années 1880 pour recueillir une trentaine de grammes d'indium, par un traitement chimique à l'acide[16]. La blende est d'abord traitée à l'acide chlorhydrique étendu, en insuffisance, l'indium extrait précipité avec le zinc en un résidu noir contenant encore de fortes impuretés de plomb, du cuivre et du fer. L'attaque à chaud par l'acide sulfurique concentré en excès est menée jusqu'à siccité. la matière sèche est reprise à l'eau, qui dissout facilement les sulfates d'indium, de zinc, de fer et de cuivre. La solution aqueuse est traitée avec un excès d'ammoniaque, l'oxyde d'indium impur précipité avec quelques traces d'oxyde de fer. L'acide sulfurique étendu permet de dissoudre le sel d'indium, qui peut être précipité par addition de zinc pur.
Bunsen, professeur de chimie de l'université de Heidelberg et ami de Reich, avait contribué comme expert à l'établissement du spectromètre de flamme de la Bergakademie de Freiberg. Ayant bénéficié en retour d'échantillons d'indium métal, il a montré que la chaleur spécifique de l'indium suivait bien la loi des chaleurs spécifiques[17].
Isotopes
L'indium possède 39 isotopes connus, de nombre de masse variant entre 97 et 135, et 47 isomères nucléaires. Parmi ces isotopes, un seul est stable, 113In, faisant de l'indium un élément monoisotopique. Cependant, l'indium naturel est aussi constitué et même majoritairement (~95,7 %) d'un radioisotope faiblement radioactif, 115In, avec une demi-vie d'environ 441 000 milliards d'années, ce qui fait que l'indium n'est pas un élément mononucléidique. L'indium partage d'ailleurs la caractéristique avec le rhénium et le tellure d'avoir un radioisotope naturel à longue vie plus abondant que son (ou ses) isotope(s) stable(s). La masse atomique standard attribuée à l'indium est de 114,818(3) u
Occurrences dans les milieux naturels, minéralogie et géologie
L'indium est un élément rare. Le clarke s'élève à 100 à 50 mg par tonne[18]. Avec une valeur de 0,1 ppm, il serait ainsi trente fois plus rare que l'élément gallium.
L'indium existe à l'état natif, il s'agit du corps simple naturel que les minéralogistes nomment indium natif. On ne le trouve qu'en quantité infime dans les mines de zinc, de cuivre, de plomb, de fer... notamment à l'état de traces dans de nombreux sulfures, comme les blendes.
Gisements exploitables et techniques de production
Il s'agit surtout d'un sous-produit du raffinage du zinc, autrefois du plomb. Il est raffiné et obtenu sous forme métal par électrolyse.
Corps simple et corps composés chimiques
Propriétés physiques et chimiques du corps simple
Le corps simple est un métal blanc argenté ou parfois gris argenté, brillant, moyennement dense de densité 7,31 à 20 °C. Il donne un beau poli, inaltérable à l'air et ses surfaces brillantes à fortes réflectances proches de celle du métal argent peuvent justifier son usage comme miroir, d'autant que cette surface est peu sensible à la corrosion. Il peut servir de revêtement galvanoplastique anti-corrosion, voire de traitement de surface anti-usure.
Comme le métal gallium de même aspect, le métal indium est stable dans l'air et l'eau, hormis en présence d'oxygène libre.
Ce métal est rayable à l'ongle, facilement ductile et sectile (découpable facilement au cutter), plastique et très facilement déformable. Il est plus mou, plus tendre et plus malléable que le métal plomb. Une opération d'écrouissage n'entraîne aucun durcissement, son laminage à froid reste très aisé. Toutefois, soumise à une pression plus vive, une plaque ou pastille de métal casse. Il est possible de communiquer une énergie mécanique et thermique à un morceau d'indium en le frottant avec un morceau de gallium de façon à l'allier à ce dernier par frottements et petits chocs répétés, tel que l'alliage GaIn métal ainsi formé puisse prendre une consistance quasi-liquide et ainsi s'étaler lentement sur une surface froide comme le verre, formant un miroir. Il est alors possible d'écrire avec cet alliage placé au bout d'un coton tige sur du papier.
Le pliage ou le stress d'une barre, d'une tige, d'une pastille, d'une plaque, d'un lingot d'indium génère des sons caractéristiques, un "cri aigu" ou un crunch, un crackling noise pour les Anglo-saxons. Ils sont dus aux frottements internes des grands cristaux, provoquant la séparation trop rapide et forcée des cristaux jumelés, de manière similaire à l'étain courbé.
Ces propriétés plastiques sont conservées à (très) basses températures.
Son point de fusion est bas à 156,6 °C et son point d'ébullition plutôt élevé vers 2 300 K (précisément à 2 000 °C), ce qui donne une plage liquide dépassant 1 800 °C. L'indium liquide est donc très fluide, il s'insinue très facilement dans les pores et les interstices des matériaux.
L'indium est diamagnétique. C'est un métal semi-conducteur de l'électricité, soumis à l'effet Peltier et moyennement conducteur de la chaleur. Il devient supraconducteur en dessous de 3,41 K.
L'indium peut être utilisé dans les jonctions de transistor n-p-n avec le germanium.
Alliages notables
Il existe une grande variété d'alliages, conçus souvent pour des applications spécifiques.
L'alliage Ga0.76In0.24 est liquide à la température ambiante. Le galinstan possède des propriétés similaires.
Chimie et principales combinaisons
Les états d'oxydation les plus communs sont I et III, accessoirement II.
Dans les plus simples de ces combinaisons, l'élément métal est monovalent par effet de paire orbitale s inerte. Mais la plupart des composés trivalents de l'indium possède des propriétés semi-conductrices, parfois recherchées. Les principales propriétés chimiques sont assez proches de celle du cadmium, à l'exception notable de l'oxyde d'indium, insoluble dans l'ammoniaque.
Résistant dans l'air à la température ordinaire, le corps simple brûle après chauffage au rouge, avec une flamme bleu-violette caractéristique, laissant une matière poudreuse jaune, peu fusible, solubles dans les acides, le sesquioxyde d'indium[19].
- 4 Insolide métal chauffé au rouge + 3 O2 gaz oxygène en balayage → 2 In2O3 sesquioxyde d'indium
-iodide-3D-balls.png.webp)
Le métal se dissout dans la plupart des acides minéraux, mais n'est pas dissout par les bases, ni bien sûr par l'eau[20]. L'indium peut être dissous dans les cyanures, par le cyanure de potassium. Cette technique de cyanuration est un moyen de purification.
Le métal indium est couramment obtenu par électrolyse de ses sels en solutions aqueuses. Par son potentiel d'électrode[21], l'indium est un réducteur plus faible que le gallium et surtout l'aluminium.
- In3+ + 3 e- → In0 métal avec un potentiel d'électrode normal ε0 de l'ordre de −0,34 V avec log K = -17,2[22].
L'ion indium monovalent ou trivalent existe à l'état hydraté. Les solutions des ions In3+ sont fortement hydrolysés, du type [In (H2O))6]3+ analogue à [Ga(H2O)6]3+. Le rayon ionique de In3+ équivaut à 81 pm (0,81 Å).
L'indium se combine à chaud avec les halogènes et le soufre. Le chlorure d'indium divalent InCl2, analogue de GaCl2, peut être obtenu par :
- Insolide métal + 2 HCl gaz réactif → InCl2 dichlorure d'indium + H2 gaz hydrogène
En réalité, il s'agit d'une structure en In2Cl2.
Les divers sels d'indium sont obtenus par exemple par l'action d'un acide minéral sur le métal ou les oxydes, avec différentes techniques de cristallisation. Ils sont solubles dans l'eau, à laquelle ils confèrent, selon les anciens glycochimistes, une indéniable saveur métallique. Soumis au test de flamme, ils engendrent une flamme peu éclairante avec deux raies caractéristiques, bleu foncé et violet plus faible.
Citons parmi les composés les plus communs :
- les halogénures d'indium(I) InCl, InBr ou InI
- le sous-oxyde In2O poudre intensément noire
- le sesquioxyde d'indium In2O3 est totalement basique et nullement amphotère comme Ga2O3 et Al2O3. Cet oxyde qui peut être amorphe (rouge brun) ou cristallin de maille trigonale (jaune claire) engendre assez peu d'hydrates et d'hydroxydes[23]. Il est très connu par son dopage ou association partielle avec l'oxyde d'étain(IV) SnO2 sous le nom d'oxyde d'indium-étain ou son acronyme anglo-saxon ITO.
- l'hydroxyde d'indium(III) In(OH)3, corps composé blanc, insoluble dans l'eau froide, obtenu généralement par l'action de l'ammoniaque concentré sur divers sels d'indium[24].
- le fluorure d'indium(III), InF3 à structure polymère, très peu soluble dans l'eau, avec 0,04 g/100 g d'eau à 25 °C[25].
- le chlorure d'indium(III), InCl3 corps incolore à légèrement coloré, très soluble dans l'eau. Il s'agit d'un acide de Lewis, à l'instar de AlCl3.
- les chlorures doubles d'indium et d'alcalin (Na, K...)
- le bromure d'indium(III), InBr3 très soluble dans l'eau
- le iodure d'indium(III), InI3 jaune
- le sulfure d'indium(III) In2S3 matière jaune brillante en écailles ou en poudre rouge suivant sa morphologie.
- le sulfate d'indium anhydre In2(SO4)3, corps cristallin monoclinique, gris blanc, très hygroscopique et très soluble dans l'eau chaude.
- le nonahydrate correspondant In2(SO4)3. 9 H20, matière blanche de densité 3,44, hygroscopique et très soluble dans l'eau, qui se décompose vers 250 °C
- les sulfates doubles d'indium et d'alcalin (Na, K...)
- le nitrate d'indium(III) anhydre In2(NO3)3 très hygroscopique
- le nitrate d'indium hydraté In2(NO3)3. 9/2 H20 en aiguilles déliquescentes, très soluble dans l'eau, soluble dans l'alcool, à décomposition thermique facile.
- l'acétate d'indium, le tartrate d'indium et les composés organo-indié comme le triméthylindium In(CH3)3, l'indium cyclopentanediènyle In(C5H5)... ainsi que de nombreux complexes.
- l'hydrure d'indium InH3, véritable hydrure polymère
- le triméthylindium, In(CH3)3 et le triéthylindium, In(CH2CH3)3, des composés organométalliques de l'indium
- le phosphure d'indium InP
- la multitude de composés trivalents semi-conducteurs
Toxicologie
L'indium n'est pas considéré comme un oligo-élément utile aux organismes vivants car il n'a aucun rôle biologique connu à ce jour.
La toxicité du métal pur paraît faible, mais cette toxicité et sa pharmaco-cinétique dans l'organisme[26] peuvent être exacerbées par certains facteurs[27] ; d'autre part, ce métal étant rare, et très utilisé depuis peu, elle reste assez mal connue. Par contre certains de ses composés (semi-conducteurs notamment, tels que arséniure d'indium (InAs) et phosphure d'indium (InP), peu solubles et peu dégradables (et donc rémanents) se montrent toxiques sur le modèle animal (toxicité aiguë et/ou chronique d'après Tanaka et al., 2004)[28].
Les sels d'indium sont réputés peu toxiques par ingestion orale en faible quantité, mais sont des poisons violents en injection sous-cutanée ou intraveineuse. Ils perturbent les fonctions du cœur, du sang, du foie et des reins, en altérant leur fonctionnement. Ils détruisent irrémédiablement ces organes en prises chroniques, ou à forte dose (quelques milligrammes).
De plus, l'InP (phosphure d'indium) « a clairement démontré un potentiel cancérigène dans des études d'inhalation à long terme effectuées sur des animaux de laboratoire »[29].
l'Indium affecte également le développement embryonnaire et du fœtal (d'après le modèle animal[30]).
Dans les années 1970 on a évoqué une possible activité antitumorale de certains de ses sels [31].
En ce qui concerne les risques et dangers pour l'homme, sur la base des quelques données disponibles sur les effets néfastes de ce métal pour la santé des travailleurs exposés à des particules contenant de l'indium (métallurgie, recyclage des métaux...), la société japonaise pour la santé au travail a fixé comme seuil d’exposition professionnelle 3 μg/L de sérum sanguin[29].
En raison de sa récente et large diffusion dans de nombreux objets électroniques, les toxicologues recommandent de « porter une attention beaucoup plus grande à l'exposition humaine aux composés de l'indium, et les précautions contre une exposition éventuelle aux composés de l'indium sont primordiales pour la gestion de la santé des travailleurs manipulant de l'indium »[29].
Utilisations du corps simple, des alliages et des composés

Le métal possède la propriété unique d'être utilisé comme joint de surface métal-métal ou non métal, par exemple de réaliser les scellements hermétiques verre-métal, verre-verre, avec le marbre, le quartz, la faïence ou la porcelaine pouvant se substituer au verre.
Ces brasures à l'indium permettent d'assurer l'étanchéité des appareillages à vide très poussés par cette obturation des joints métal-non métal. L'indium se retrouve dans les joints d'assemblage et autres scellements à la température de l'oxygène liquide.
Le principe de ces soudures froides pour raccord métal/non métal d'installation à vide élevé se retrouvent dans les soudures de transistors et semi-conducteurs sensibles.
Les alliages d'indium peuvent servir de revêtement galvanoplastique anti-corrosion. L'intérêt en miroiterie de l'indium se justifie, car à pouvoir réflecteur quasi équivalent à l'argent, les surfaces ont une meilleure résistance à la corrosion en pratique.
En mécanique, l'indium est présent dans les coussinets pour paliers lisses. Il permet d'obtenir des alliages anti-friction. L'alliage d'indium à l'acier diminue fortement la résistance au frottement et, par là, les pertes de puissance.
L'indium est présent souvent avec le gallium dans les alliages à bas point de fusion. Il est utilisé dans certaines soudures permettant d'éviter la présence de plomb. L'alliage gallium-indium (76 % — 24 %) est liquide à la température ambiante. Il est utilisé (expérimentalement) pour constituer un miroir liquide pour télescope en substitut non polluant au mercure.
Les alliages très fusibles comportent souvent du bismuth Bi, du cadmium Cd, du plomb Pb et de l'étain Sn. Ils sont employés dans les coupe-circuit, les régulateurs de chaleur ou thermistor, les systèmes de sécurité Sprinkler.
Les alliages binaires avec Cd/Zn sont conçus pour la soudure à l'aluminium.
Les alliages avec l'arsenic As et l'antimoine Sb sont utiles pour fabriquer des transistors, des photoconducteurs, des détecteurs de source de chaleur (IR). L'arséniure d'indium InAs et le séléniures d'indium InSe sont des semi-conducteurs. L'alliage InSb présente une résistivité variable sous les divers rayonnements infrarouges. Cet antimoniure d'indium est un semi-conducteur de jonction à cristaux p-n, n-p. Ce photoconducteur est ainsi présent dans les filtres infrarouges, ainsi que les détecteurs infrarouges.
L'oxyde d'indium trivalent In2O3, pigment dans l'industrie verrière, permet d'obtenir des verres teintés en jaune pâle.
Écran à cristaux liquides et écrans tactiles

Transparent en couche mince tout en conduisant l'électricité, l'oxyde d'indium(III) (In2O3) adhère fortement au verre. Additionné d'oxyde d'étain(IV) (SnO2), l'oxyde d'indium-étain (ITO) représente le matériau idéal pour réaliser les fines électrodes transparentes recouvrant un écran LCD, c'est-à-dire un affichage à cristaux liquides, éventuellement à propriétés tactiles[32].
Les écrans à cristaux liquides sont ainsi la principale application de l'indium, représentant 80 % de ses utilisations[33].
Cellule photovoltaïque
Certains composés d'indium sont des photoconducteurs remarquables. Ils se retrouvent dans les :
- Cellules à jonction
- On utilise l'indium sous plusieurs formes : de séléniure d'indium InSe2, de nitrure d'indium-gallium InGaN et de diséléniure de cuivre-indium CuInSe2. Les recherches en cours sur des cellules combinant plusieurs couches : gallium-indium-phosphore, arséniure de gallium et germanium (GaInP-AsGa-Ge) permettent d'espérer des rendements supérieurs à 30 %.
 Antimoniure d'indium, matériau semi-conducteur
Antimoniure d'indium, matériau semi-conducteur
- Cellules en couche mince
- Elles ont un rendement inférieur (10-20 %) mais sont beaucoup plus faciles à fabriquer en grande dimension, on utilise de l'oxyde d'indium-étain, un mélange cuivre-indium-sélénium ou double séléniure d'indium ou de cuivre (CuInSe2) ou encore cuivre-indium-gallium-sélénium. L'indium est ainsi présent dans les panneaux photovoltaïques.
- Détecteurs infrarouges
 Phosphure d'indium (InP)
Phosphure d'indium (InP)
- arséniure d'indium jusqu'à 3,8 μm et antimoniure d'indium (InSb) jusqu'à 5 μm.
Télécommunications
Le phosphure d'indium InP est le substrat des composants opto-électroniques (DEL, diodes laser, photodiodes) pour les communications sur fibres optiques (réseaux FTTH, métropolitains et longue distance, à 1300/1550 nm)
Absorbant neutronique, mesure de flux de neutrons et médecine nucléaire
L'indium présente une section efficace de capture de 194 barn, ce qui a conduit à l'utiliser associé à l'argent et au cadmium comme absorbant neutronique dans les grappes de contrôle des réacteurs à eau pressurisée. L'alliage AgInCd est présent dans les barres de contrôle des réacteurs nucléaires.
L'indium permet des mesures de flux de neutrons thermiques des réacteurs nucléaires. Dans le cadre de la protection civile, il permet de réaliser des dosimètres à neutrons.
En médecine nucléaire, l'indium 111, avec ses deux émissions gamma de 173 et 247 keV, permet de réaliser certains examens. Par exemple, il est possible de réaliser une scintigraphie au moyen de globules blancs marqués à l'indium 111 pour repérer des processus abdominaux actifs et des processus infectieux récents (depuis moins de 2 semaines). Lié à certains pharmaceutiques, cet isotope radioactif peut permettre de localiser différentes tumeurs neuro-endocrines (insulinomes, gastrinomes, paragangliomes, carcinoïde, phéochromocytome, etc). Il est également utile en scinticisternographie.
Il existe aussi l'isotope 113 en médecine nucléaire.
Électrochimie
Les anodes sacrificielles sont en alliage d’aluminium activé à l’indium pour protéger les pièces en acier immergées dans l'eau de mer.
Économie : vers une pénurie ?

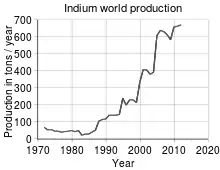
Les téléviseurs, les ordinateurs, les récepteurs GPS, les téléphones mobiles, les appareils photo, etc., tous les appareils à écran LCD ont vu leur production augmenter exponentiellement à partir des années 2000. L'oxyde d'indium dopé à l'oxyde d'étain(IV) permet en effet d'allier facilement transparence et conductivité, conditions nécessaires, dans la couche conductrice des écrans tactiles capacitifs (aussi appelés multicouche) à la reconnaissance du touché par les doigts de l'utilisateur. Un petit écran plat de quinze pouces (une quarantaine de cm) contient un gramme d'indium et les plus grandes usines de fabrication en consomment plusieurs tonnes par mois. Logiquement, le cours de l'indium a explosé : de 70 dollars le kilogramme en 2001, il est passé par un pic à 1 000 dollars en 2005 et se négocie entre 400 et 600 dollars en 2010.
En 2009, la demande atteint 1 210 t à 50% issues du recyclage[34]. La production minière annuelle en 2008 était de 570 t, en 2009 de 600 t[35] à partir de déchets spécifiques, principalement en Chine, Corée du Sud et Japon.
Ressources
Les ressources naturelles d'indium : selon l'U.S. Geological Survey en 2010[36] :
- 35 % Chine
- 26 % Canada
- 16 % Japon
- 8 % Belgique
- 15 % autres
En 2006, la Chine produisait 60 % de l'indium mondial, mais, devant les menaces d'épuisement à l'horizon 2020, elle a décidé de progressivement réduire ses exportations pour préserver son marché intérieur. Le conflit entre le Japon et la Chine concernant un bateau de pêche chinois arrêté aux large des Îles japonaises Senkaku, le a mis en lumière le tarissement de ces ressources. D'autres pays commencent à préserver leurs propres gisements, comme le Canada et la Russie[37].
L'évaluation des réserves en 2007 était de 11 000 t[35], soit un ratio volume de réserves (2007) / production annuelle (2008) de 19,3 ans seulement.
L'engouement depuis 2010 pour les dispositifs électroniques à écrans tactiles (ordinateurs, smartphones, tablettes tactiles...) ont accéléré sa raréfaction. Les stocks planétaires connus d'indium ont été vidés en quelques décennies, et les procédés de récupération sont à ce jour couteux et polluants.
Des laboratoires cherchent donc activement à
- améliorer le recyclage, par exemple via l'électrodéposition en liquide ionique à température ambiante [38].
- développer des alternatives[13], par exemple à base de polymères de carbone pour remplacer les oxydes métalliques rares[39].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. in: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, DOI:10.1021/je1011086.
- Data Periodic Table, Royal Chemical Society, en lien externe
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- SIGMA-ALDRICH
- L'intérêt des chimistes pour la course aux éléments ainsi que la thèse de Karl Josef Bayer en 1871 contribue à maintenir l'intérêt des chimistes de laboratoire.
- Sydney J. French, "A story of indium", Journal of Chemical Education, Volume 11, No 5, 1934, p. 270-271.
- Historique des cours du dollar US en euros.
- Écrans LCD : bientôt une pénurie d'indium, article de Futura Sciences du 26 décembre 2007
- L'indium plus résistant que l'or, Le Monde 8 novembre 2011
- Quelques grammes d'indium avaient été isolées et caractérisées par le binôme avant la retraite de Reich en 1866, probablement vers 1864/1865.
- Au cours du traitement métallurgique, l'indium est distillé avec le zinc.
- Il a corrigé la valeur initialement mesurée, proposant une valeur de l'ordre de 56 kilocalories/kg/degré Celsius.
- Alain Foucault, opus cité.
- Ce trioxyde peut être obtenu directement par simple calcination contrôlée du nitrate d'indium.
- L'indium métal est très peu soluble dans la soude caustique.
- Standard electrode potential
- Par comparaison, Ga3+ + 3 e- → Ga0 métal avec un potentiel d'électrode ε0 de −0,52 V
- Sa densité est 7,179. Il est soluble dans les acides (forme amorphe). Il se décompose vers 850 °C.
- Ce corps blanc instable thermiquement (perte d'une molécule d'eau vers 150 °C) est insoluble dans l'eau froide et l'ammoniaque, peu soluble dans l'hydroxyde de sodium aqueux, et facilement soluble dans les acides.
- Ce corps légèrement coloré a une densité de 4,39 à 20 °C. Son point de fusion avoisine 1 170 °C et son point d'ébullition serait supérieur à 1 200 °C s'il ne commençait à se décomposer.
- Castronovo Jr, F. P., & Wagner Jr, H. N. (1973). Comparative toxicity and pharmacodynamics of ionic indium chloride and hydrated indium oxide. Journal of Nuclear Medicine, 14(9), 677-682.
- Castronovo, F. P., & Wagner, H. N. (1971). Factors affecting the toxicity of the element indium. British journal of experimental pathology, 52(5), 543.
- Tanaka et al. (2004). Toxicity of indium arsenide, gallium arsenide, and aluminium gallium arsenide. Toxicology and Applied Pharmacology, 198 (3), 405–411.
- Tanaka, A., Hirata, M., Kiyohara, Y., Nakano, M., Omae, K., Shiratani, M., & Koga, K. (2010) Review of pulmonary toxicity of indium compounds to animals and humans. Thin Solid Films, 518(11), 2934-2936 (résumé).
- Nakajima, M., Sasaki, M., Kobayashi, Y., Ohno, Y., & Usami, M. (1999). Developmental toxicity of indium in cultured rat embryos. Teratogenesis, carcinogenesis, and mutagenesis, 19(3), 205-209.
- Hart M.M & Adamson R.H (1971) Antitumor activity and toxicity of salts of inorganic group IIIa metals: aluminum, gallium, indium, and thallium. Proceedings of the National Academy of Sciences, 68(7), 1623-1626.
- LCD pour Liquid Crystal Display.
- Umicore, Christian Hageluken, IERC Salzburg, 2010
- UNEP (2009), Critical Metals for Future Sustainable Technologies and their Recycling Potential
- USGS
- (en) Indium (data in metric tons unless otherwise noted, sur l'UGCS
- Arnaud de la Grange, « Pékin joue de l'arme des « terres rares » », Le Figaro, le 25 octobre 2010
- Traore Y (2012) Perspective nouvelle pour la récupération de l'indium issu des e-déchets par électrodéposition dans les liquides ioniques à température ambiante (Doctoral dissertation, Université de Grenoble)
- Molécules miracles pour écrans tactiles, Courrier international, 24 février 2011
Bibliographie
- Pierre Balazy, El-Aïd Jdid, Métallurgie de l'indium, Fiche M2-368, édition Techniques de l'ingénieur, 12 pages.
- Alain Foucault, Jean-François Raoult, Fabrizio Cecca, Bernard Platevoet, Dictionnaire de Géologie - 8e édition, Français/Anglais, édition Dunod, 2014, 416 pages. Avec la simple entrée "indium", p. 180.
- Paul Pascal, Nouveau traité de chimie minérale, 6. Bore, aluminium, gallium, indium, thallium, Paris, Masson, (réimpr. 1966), 32 volumes
- (en) Ulrich Schwarz-Schampera, Peter M. Herzig, Indium: Geology, Mineralogy, and Economics, Springer Science & Business Media, 2013, 258 pages.
Voir aussi
Articles connexes
Liens externes
- Article sur l'indium par Georges Kayas, Encyclopædia Universalis
- L'indium présenté en six rubriques (production, fabrication, utilisation, environnement, social, recyclage, substitution, perspectives) par Ecoinfo, édité par le groupement de service (GDS) des technologies de l'information et de la communication (TIC) du Centre nationale de la Recherche scientifique (CNRS)
- Indium sur Futura Sciences
- Présentation du métal In par la SCF
- Fichier INRS sur l'indium 111
- Mémoire de physique : Caractérisation de nanocolonnes d'InGaN en vue d'étudier l'origine de la haute conductivité de l'InN
- (en) Présentation de l'élément Indium par la Table périodique de la Royal Society of Chemistry
- (en) Petite étude d'une pastille d'indium (attention la réaction à l'eau concerne le lithium)
- (en) Démonstration des propriétés mécaniques d'une pastille métal indium, avaec analogie pâte à mâcher
- ADEME, « Étude du potentiel de recyclage de certains métaux rares », juillet 2010, fiche métal de l'argent : 1re partie, p. 56-63
- (en) « Technical data for Indium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||
- Portail des minéraux et roches
- Portail de la chimie