Hapticité
Le terme hapticité est utilisé pour décrire la coordination d'un groupe contigu d'atomes d'un ligand à un atome central. L'hapticité d'un ligand est désigné par la lettre grecque η. En général cette notation est complétée par le nombre d'atomes de ligand liés à l'atome central, placé en exposant. Cette notation n'est en revanche pas utilisée quand il n'y a qu'un atome coordiné (la notation κ est alors préférée).
Historique
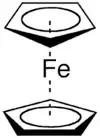
La nécessité de compléter la nomenclature pour les composés organométalliques apparait dans les années 1950 lorsque Dunitz, Orgel et Rich décrivent la structure du complexe sandwich ferrocène par étude cristallographique aux rayons X[1]. Dans cette structure un atome de fer est pris en sandwich entre deux cyclopentadiènes parallèles. Cotton propose plus tard le terme hapticité qui dérive du préfixe hapto (du grec haptein, lier, pour indiquer le contact ou l'accolement) placé devant le nom du composé[2]. La lettre grecque η est alors utilisée pour indiquer le nombre d'atomes qui se suivent d'un ligand liés à un atome central. Le terme est employé habituellement pour décrire des ligands contenant des systèmes π étendus ou avec une liaison agostique non évidente d'après la formule.
Composés historiquement importants où les ligands sont décrits avec l'hapticité
- Ferrocène - bis(η5-cyclopentadiène)fer
- Uranocène - bis(η8-1,3,5,7-cyclooctatétraène)uranium
- W(CO)3(PPri3)2(η2-H2 ) - le premier composé synthétisé avec ligand H2[3],[4].
- IrCl(CO)[P(C6H5)3]2(η2-O2) -le dérivé oxygéné qui se forme de manière réversible lorsqu'on fait réagir le complexe de Vaska avec de l'oxygène.
Exemples
La notation η est rencontré pour de nombreux complexes :
- Liaisons latérales de molécules contenant des liaisons σ comme le dihydrogène (H2) :
- Ligands liés latéralement contenant de multiples atomes liés, par exemple l'éthylène dans le sel de Zeise ou avec des fullerènes, qui est lié via sa liaison π :
- K[PtCl3(η2-C2H4)].H2O
- Autres complexes contenant des ligands pontants à liaison π :
- À noter que certains ligands pontants, un autre mode de liaison est observé, par exemple κ1,κ1, comme dans le (Me3SiCH2)3V(μ-N2-κ1(N),κ1(N'))V(CH2SiMe3)3 qui contient une molécule de diazote pontante coordonnée par ses extrémités à deux centres métalliques.
- La liaisons d'espèce porteuses de liaisons π qui peut être étendue à plusieurs atomes, comme les ligands allyle, butadiène, ou encore les cycles de cyclopentadiényle ou de benzène qui peuvent partager leurs électrons.
- Des violations apparentes de la règle des 18 électrons parfois explicables pour des composés présentant une hapticité inhabituelle :
- Le complexe à 18-VE (η5-C5H5)Fe(η1-C5H5)(CO)2 contient un cyclopentédiényle η5 et un cyclopentédiényle η1.
- La réduction du composé à 18-VE [Ru(η6-C6Me6)2]2+ (où les deux cycles aromatiques sont liés via une coordination η6), résultant en un autre composé à 18-VE : [Ru(η6-C6Me6)(η4-C6Me6)].
- Exemples d'hétérocycles et de cycles inorganiques polyhapto-coordonnés : Cr(η5-C4H4S)(CO)3 contenant un hétérocycle sulfuré (thiophène) et Cr(η6-B3N3Me6)(CO)3 contentnat un cycle inorganique (B3N3).
Électrons donnés par « ligands π » vs. hapticité
| Ligand | Électrons contributeurs (comptage neutre) | Électrons contributeurs (comptage ionique) |
|---|---|---|
| η1 allyle | 1 | 2 |
| η3-allyle cyclopropenyle | 3 | 4 |
| η3-allényle | 3 | 4 |
| η2-butadiène | 2 | 2 |
| η4-butadiène | 4 | 4 |
| η1-cyclopentadiényle | 1 | 2 |
| η3-cyclopentadiényle | 3 | 4 |
| η5-cyclopentadiényle pentadiényle cyclohexadiényle | 5 | 6 |
| η2-benzène | 2 | 2 |
| η4-benzène | 4 | 4 |
| η6-benzène | 6 | 6 |
| η7-cycloheptatriényle | 7 | 6 |
| η8-Cyclooctatétraényle | 8 | 10 |
Changement d'hapticité
L'hapticité d'un ligand peut changer au cours d'une réaction chimique, par exemple lors d'une oxydo-réduction[8]:
Il y a passage de cycles benzéniques η6 à un cycle η4 et l'autre η6.
De manière similaire l'hapticité peut changer lors d'une réaction de substitution:
Ici le cyclopentadiényle η5 se change en cyclopentadiényle η3, ce qui permet d'avoir un ligand L supplémentaire qui apporte deux électrons. L'hapticité η5 est restaurée en ôtant une molécule CO supplémentaire et en apportant deux électrons encore grâce au ligand cyclopentadiényle. L'effet indényle décrit également des changements d'hapticité lors d'un réaction de substitution.
Hapticité et denticité
L'hapticité doit être distinguée de la denticité, la première décrivant la liaison entre un groupe d'atomes liés et un autre élément, et la seconde qui décrit le nombre de centres de coordination entre le ligand et l'élément lié, ces centres n'étant pas forcément reliés entre eux directement. Ainsi, un ligand polydentate est un ligand qui se coordonne via plusieurs centres de coordination. Dans ce cas, les atomes coordonnés sont décrits en utilisant une notation κ, comme dans le cas de la coordination du 1,2-bis(diphénylphosphino)éthane (Ph2PCH2CH2PPh2) au NiCl2 formant le dichloro[éthane-1,2-diylbis(diphénylphosphane)-κ2P]nickel(II). Si les atomes de coordinations sont contiguës (c'est-à-dire connectés entre eux), c'est la notation η-notation qui est utilisée, comme dans le cas du dichlorure de titanocène : dichlorobis(η5-2,4-cyclopentadién-1-yl)titane[9].
Hapticité et fluxionalité
Les molécules possédants des ligands d'hapticité multiples ont souvent la capacité de subir des réarrangements intramoléculaires rapides, des atomes étant interchangés entre structures équivalentes (fluxionalité). Pour les complexes organométalliques de ce type, deux classes de fluxionalité prédominent:
- cas 1: quand l'hapticité est inférieure au nombre de carbones d'hybridation sp2. Dans cette situation, le métal migre souvent de carbone à carbone, en maintenant une hapticité nette constante. Le ligand η1-C5H5 dans (η5-C5H5)Fe( η1-C5H5)(CO)2 se réarrange rapidement en solution de telle manière que le fer lie alternativement chaque carbone du ligand 1-C5H5. Cette réaction est dite dégénérée. C'est un exemple de réarrangement sigmatropique.
- cas 2: des complexes contenant des ligands cycliques d'hapticité strictement supérieure à 1 et même maximisée. Ces ligands ont tendance à tourner. Un exemple bien connu est le ferrocène Fe(η5-C5H5)2 dans lequel le groupe cyclopentadiényl tourne avec une faible barrière énergétique autour de l'axe principal de la molécule.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « hapticity » (voir la liste des auteurs).
- J. Dunitz, L. Orgel, A. Rich (1956). "The crystal structure of ferrocene". Acta Crystallographica 9: 373–5. DOI:10.1107/S0365110X56001091
- F. A. Cotton (1968). "Proposed nomenclature for olefin-metal and other organometallic complexes". J. Am. Chem. Soc. 90 (22): 6230–6232. DOI:10.1021/ja01024a059
- Kubas, Gregory J. (March 1988). "Molecular hydrogen complexes: coordination of a σ bond to transition metals". Accounts of Chemical Research 21 (3): 120–128. DOI:10.1021/ar00147a005
- Kubas, Gregory J. (2001). Metal Dihydrogen and σ-Bond Complexes - Structure, Theory, and Reactivity (1 ed.). New York: Kluwer Academic/Plenum Publishers. LCCN 00-059283. (ISBN 978-0306464652)
- (en) Gregory J. Kubas, « Molecular hydrogen complexes: coordination of a σ bond to transition metals », Accounts of Chemical Research, vol. 21, no 3, , p. 120–128 (DOI 10.1021/ar00147a005, lire en ligne)
- (en) Gregory J. Kubas, Metal Dihydrogen and σ-Bond Complexes : Structure, Theory, and Reactivity, New York, Kluwer Academic/Plenum Publishers, , 1re éd., 472 p. (ISBN 978-0-306-46465-2, LCCN 00059283, lire en ligne)
- (en) D. Sutton, « Organometallic diazo compounds », Chem. Rev., vol. 93, no 3, , p. 995–1022 (DOI 10.1021/cr00019a008)
- Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). "Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0)". Angewandte Chemie, International Edition in English 10 (8): 556–557. DOI:10.1002/anie.197105561
- (en) Union internationale de chimie pure et appliquée, Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005, Cambridge, RSC–IUPAC, , 366 p. (ISBN 0-85404-438-8, lire en ligne [PDF]), chap. IR-9.2.4.1 Coordination Compounds - Describing the Constitution of Coordination Compounds: Specifying donor atoms - General, pp. 154-155.
2.png.webp)
.png.webp)