Hévéa
Hevea brasiliensis

| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Magnoliopsida |
| Sous-classe | Rosidae |
| Ordre | Euphorbiales |
| Famille | Euphorbiaceae |
| Genre | Hevea |
| Ordre | Malpighiales |
|---|---|
| Famille | Euphorbiaceae |
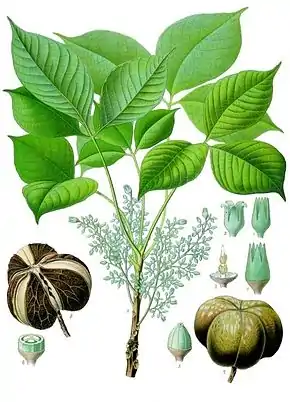
L’arbre à caoutchouc, l’hévéa ou l’hévéa du Brésil (Hevea brasiliensis) est une espèce d’arbres, du genre Hevea de la famille des Euphorbiaceae. On en extrait un latex qui est utilisé pour être transformé en caoutchouc.
Description



Dans son milieu naturel en Amazonie, l’Hevea brasiliensis est un arbre pouvant atteindre fréquemment plus de 30 m de hauteur pour une circonférence de 1 m. Son écorce est vert grisâtre. Ses feuilles sont composées de trois folioles disposées à l’extrémité d’un pétiole. L’hévéa perd ses feuilles et les renouvelle chaque année. Elles se forment périodiquement, par étage à l’extrémité des unités de croissance. Les fleurs sont petites, jaune clair et rassemblées en grappes. Les fruits sont composés d’une capsule à trois loges contenant chacune une graine de 2 cm environ, ovale, de couleur brune décorée de taches blanchâtres. On dit de ce fruit qu’il est déhiscent[1].
Le tissu laticifère se retrouve dans toutes les parties de l’arbre, des racines aux feuilles, en passant par l’écorce du tronc, siège de l’exploitation du latex chez l’hévéa. Les vaisseaux laticifères se développent en manchons concentriques dans le liber (écorce tendre) qui contient également les vaisseaux conducteurs de la sève élaborée, le phloème. Les vaisseaux laticifères s’anastomosent de façon à former un réseau continu à l’intérieur de chaque manchon. Les cellules qui composent les vaisseaux laticifères sont vivantes et possèdent tous les organites (noyau, mitochondries, plastes, etc.) nécessaires à leur fonctionnement.
Le latex est différent de la sève. Celle-ci assure la distribution de l’eau, des sels minéraux ou des sucres alors que le latex est plutôt impliqué dans les mécanismes naturels de défense de l’arbre. Il circule dans un réseau distinct de vaisseaux : les canaux laticifères. Comme la résine, il suinte lors d’une éventuelle blessure de la plante et forme en séchant une barrière protectrice. Le latex récolté par saignée est le cytoplasme, c’est-à-dire le contenu liquide, des cellules laticifères. Il est composé d’une suspension de particules de caoutchouc, mais également d’organites comme les lutoïdes. En revanche, les noyaux et les mitochondries demeurent attachés aux parois des cellules, assurant ainsi le renouvellement du latex après récolte. Les particules de caoutchouc représentent 25 à 45 % du volume du latex et 90 % de la matière sèche.
Culture de l'hévéa
Histoire
Cette espèce est originaire de la grande forêt amazonienne qui s'étend sur le territoire du Brésil (États d'Amazonas, du Mato Grosso ou du Pará), du Pérou, de la Bolivie , de la Guyane et de la Colombie.
Après que l’explorateur anglais Henry Alexander Wickham eut réussi à ramener 74 000 graines d'hévéa brésilien aux jardins botaniques royaux de Kew à Londres, les Britanniques purent ainsi constituer des plantations d'hévéas dans leurs propres colonies, comme en premier lieu, Ceylan. D'autres puissances coloniales imitèrent le Royaume-Uni dans cette voie comme la France.
Sa culture a été ainsi répandue dans toutes les régions tropicales, notamment dans le Sud-Est asiatique (Thaïlande, Malaisie, Indonésie, Viêt Nam, Inde, Chine, etc.), ainsi qu’en Afrique (République démocratique du Congo, Nigeria, Liberia, Cameroun, Côte d'Ivoire).
Production de latex
La production mondiale de latex est estimée à 9,7 millions de tonnes environ, dont trois pays, Thaïlande, Indonésie et Malaisie, représentent près des trois quarts, sachant que l'Asie en produit 95 %. Elle s’étend sur 8,3 millions d’hectares environ (83 000 km2, soit 2,75 fois la taille de la Belgique).
C’est toutefois au Liberia que se trouve la plus vaste plantation d’hévéas au monde : 48 000 hectares, qui sont la propriété de Firestone, le géant américain du pneu devenu depuis 1988 une filiale du groupe japonais Bridgestone.
En 2010, l'industrie du pneu consommait 70 % du latex produit dans le monde[2]. La demande mondiale en caoutchouc est fortement croissante car l'automobile individuelle se développe en Chine[3].
Méthode d'exploitation

Le latex se récolte par saignées sur l’écorce du tronc de l’hévéa. Au moyen d’un couteau spécifique, les saigneurs pratiquent une légère entaille en descendant sur la moitié ou le tiers de la circonférence du tronc. La saignée débute en général à environ 1,50 m de hauteur, lorsque les arbres ont atteint 50 cm de circonférence à 1 m de hauteur. À chaque saignée, l’encoche est ravivée en découpant une fine lamelle d’environ 2 mm d’épaisseur, sur toute la profondeur de l’écorce. Il est toutefois important de ne pas toucher le cambium (assise génératrice du bois) car cela provoque des cicatrices.
Le latex, en sortant de l’entaille, coule dans la tasse pendant quelques heures. Puis l’encoche se bouche par coagulation du latex et l’écoulement s’arrête. La récolte peut se faire sous forme liquide (on parle de récolte en latex) si on procède juste après la saignée, ou solide si on laisse le latex coaguler dans la tasse (récolte en coagulum). En cas de récolte sous forme liquide, on peut ajouter un peu d’ammoniac pour empêcher la coagulation précoce. À l’inverse, le processus de transformation post-récolte démarre par l’ajout d’un peu d’acide (formique en général) pour faire coaguler le latex.
Les saignées ont lieu périodiquement. Il existe des systèmes plus ou moins intensifs, allant de la saignée deux jours sur trois à la saignée hebdomadaire, la fréquence la plus courante étant tous les deux jours. Lorsque toute l’écorce du côté exploité (appelé panneau) a été consommée, on passe sur le panneau suivant. Cela a lieu après six ans en général. Lorsque toute l’écorce basse a été utilisée, on peut pratiquer la saignée haute, remontante. Cette dernière, bien que délicate est très productive. Elle se pratique en quarts de spirales et peut durer ainsi au moins quatre ans. Il est alors possible de recommencer la saignée basse sur l’écorce déjà saignée qui se sera entre-temps régénérée. L’arbre peut ainsi produire du latex à partir de l’âge de cinq ans et pendant trente ans environ. Cependant, dans de nombreuses régions et en particulier en Thaïlande, premier pays producteur, la tendance est au raccourcissement des cycles, avec une exploitation sur moins de vingt ans.
À l’issue de sa période d’exploitation, l’hévéa est abattu pour être replanté. Les progrès de la recherche permettent de procéder à ces replantations avec un matériel végétal beaucoup plus performants.
Effets environnementaux


Remarque : l'exposition du lixiviat filtré aux UV n’accroit pas ou peu sa toxicité pour les daphnies, mais la toxicité du lixiviat « non filtré » (contenant donc encore des particules de caoutchouc) augmente « considérablement » lors d'une exposition aux UV (aspect n'ayant pas été pris en compte par de nombreuses études de laboratoire)[4].
Destruction de la forêt tropicale
Les vastes monocultures équiennes d'hévéas Hevea brasiliensis se font au détriment de la forêt tropicale[6],[7], y compris dans des pays et sur des continents où l'hévéa n'existait pas.
En Asie du Sud et Sud-Ouest, plus de deux millions d'hectares plantés de 2000 à 2010 ont bouleversé les écosystèmes et les réseaux socioéconomiques, constituant une menace de plus pour la biodiversité[8],[9]. En une génération (en 29 ans ; de 1983 à 2012), la surface de plantation est passée de 5,5 millions d'hectares environ à 9,9 millions (57 % de la surface dédiée au palmier à huile), mais avec un taux qui a atteint 71 % en Asie du sud-est en 2015. Comme pour l'eucalyptus ou l'huile de palme[10], cette tendance s’accélère : dans les années 2000 environ 219 000 hectares supplémentaires d'hévéas ont été implantés (plus du double des 108 000 hectares/an des deux décennies précédentes)[11],[12].
Cette extension se fait au détriment de la forêt primaire, de sa biodiversité[13] et des grands équilibres écologiques (des aires protégées qui ont ainsi déjà été sacrifiées aux plantations), et donc avec des effets négatifs (comparables à ceux des cultures d'huile de palme[14]), notamment dans le sud-est asiatique (Indonésie, Malaisie, Laos, Cambodge, Viêt Nam, sud-ouest de la Chine et Philippines),
À titre d'exemple, la réserve naturelle Snoul (Cambodge) a été en quatre ans (de 2009 à 2013) recouverte à plus de 70 % par 75 000 hectares d'hévéas en dépit de la présence de nombreuses espèces menacées (banteng, cerf d'Eld et plusieurs singes carnivores)[12]. La croissance de ces cultures était de 3,5 %/an dans les années 2010-2015) et de 5,3 % si l'on ne tient compte que des pneus[3]. En 2018, la revue Nature relève que 23,5 % de la surface boisée du Cambodge — plus de 2,2 millions d'hectares — ont été détruits entre 2001 et 2015 pour pallier la demande[15], menaçant gravement les gibbons et d'autres espèces dépendantes de la forêt primaire, et de nombreuses espèces aviaires, de chauves-souris et scarabées seraient affectées (déclin attendu : jusqu'à 75 %). L'érosion des sols et la turbidité et la pollution de l'eau augmenteraient aussi[11]. Dans des pays comme le Viêt Nam, l'hévéaculture s'étend aussi sur les pentes et en altitude dans les derniers refuges de la biodiversité[16]. Enfin, ces immenses monoculture sont propices aux maladies capables de décimer les hévéas.
De 2000 à 2010, l'opinion publique s'est montrée plus sensible aux impacts de l'huile de palme qu'à ceux — moins médiatisés — de l'hévéaculture. Pourtant, en 2015 selon W. Thomas, « Au minimum, les entreprises qui convertissent, en toute légalité, des forêts protégées en plantations d’hévéas devraient faire l’objet de restrictions d’accès au marché, avec une certification d’exploitation durable »[11], ce qu'encourage une initiative dite Sustainable Natural Rubber Initiative (SNR-i) depuis et l'écocertification de certaines plantations gérées en agrosylviculture, en Indonésie par exemple[17],[18]. La même année, Ahlheim et al. se demandent même s'il ne serait pas plus économiquement et écologiquement rentable dans le sud-ouest de la Chine de replanter des forêts tropicales à la place des monocultures d'hévéas[19].
Pollution des pneus usagés
Les pneus s'usent (de plusieurs millimètres sur la bande de roulement) en roulant, contribuant à la pollution routière et urbaine. Vers 2005, environ 460 000 t de caoutchouc (enrichies d'additifs mal connus) ont ainsi été générées et dispersées en un an dans l'air, le sol et l'eau le long des routes européennes[20] (soit l'équivalent de 13 150 camions de 35 t de caoutchouc de pneu).
En fin de vie lors de leur mise en décharge, incinération ou recyclage, ils sont aussi sources de particules, de polluants et substances chimiques problématiques dans l'air, l'eau et les sédiments, pouvant affecter la santé humaine, animale et les écosystèmes.
Alors que dans les années 1990 on constate que des fragments de caoutchouc issus de pneus ou de leur valorisation sont répandues dans l'environnement, peu de données scientifiques (méta-analyses en particulier) sont disponibles en matière de santé environnementale (caractérisation chimique fine d'éluats et lixiviat des pneus ou de leur résidus, études écoépidémiologiques d'exposition, données précises de toxicité et d'écotoxicité, de mutagénicité et cancérogénicité pour les mammifères, les organismes aquatiques et du sol, les microbes, et résidus dans leurs organites. Des chercheurs plaident pour des études interdisciplinaires et pour une modélisation de la pollution associé à la gestion des pneus usés[21]. On a montré (2006) que les substances relarguées par les pneus se montrent toxiques pour la daphnie (espèce modèle courante en toxicologie)[4] et en 2009 qu'ils peuvent être retrouvés « dans tous les compartiments environnementaux, dont l'air, l'eau, les sols / sédiments et le biote »[5]. Les taux maximaux (PEC[22]) de microparticules issues de l'usure des pneus dans les eaux de surface vont de 0,03 à 56 mg/L, grimpant de 0,3 à 155 g/kg de matière sèche dans les sédiments, deux milieux où ils peuvent être absorbés par des animaux, filtreurs notamment[5]. Une étude basée sur Ceriodaphnia dubia et Pseudokirchneriella subcapitata a cherché à calculer la PNEC[23] et le ratio PEC/PNEC pour l'eau et les sédiments[5]. Ce ratio dépassait la valeur 1, ce qui signifie que ces particules présentent un risque potentiel pour les organismes aquatiques, suggérant qu'il serait utile de traiter ou gérer les particules de pneus usés notamment dans les eaux de ruissellement routières et urbaines[5]. En 2009, divers tests écotoxilogiques en laboratoire (sur l'algue Pseudokirchneriella subcapitata, deux crustacés : Daphnia magna, Ceriodaphnia dubia, et sur un poisson Danio rerio) ont confirmé ces risques à moyen et long termes pour trois types différents de pneus, aux concentration attendues dans l'environnement, ces effets écotoxiques et reprotoxiques ayant été attribuée au zinc d'une part et aux composés organiques lixiviés[20].
Notes et références
- Connaissance des végétaux - Hévéa (Hevea brasiliensis) Description statique.
- ANRPC, Natural Rubber Trends & Statistics, A monthly bulletin of market trends and statistics, vol. 2, no 12, décembre 2010, Association of Natural Rubber Producing Countries, Kuala Lumpur, Malaisie.
- Rubberworld, IRSG Offers Latest World Rubber Industry Outlook, 2014, Rubberworld.com.
- Wik A. et Dave G., Acute toxicity of leachates of tire wear material to Daphnia magna--variability and toxic components, Chemosphere, septembre 2006, 64(10):1777-8, Epub 8 février 2006, , DOI:10.1016/j.chemosphere.2005.12.045.
- Wik et Dave G., Occurrence and effects of tire wear particles in the environment - a critical review and an initial risk assessment, Environ. Pollut., janvier 2009, 157(1):1-11, Epub 5 novembre, résumé, , DOI:10.1016/j.envpol.2008.09.028.
- Li, Z. et Fox, J.M., Mapping rubber tree growth in mainland Southeast Asia using time - series MODIS 250 m NDVI and statistical data, Appl. Geogr., 2012, 32, 420–432.
- FAO, FAOSTAT, 2013, Online Statistical Service.
- Joshi, L., Wibawa, G., Beukema, H., Williams, S., van Noordwijk, M., Used, S. et Tolerated, S., Technological change and biodiversity in the rubber agroecosystem of Sumatra, Tropical Agroecosystem, 2000, 133-155.
- Fox, J. et Castella, J.-C., Expansion of rubber (Hevea brasiliensis) in Mainland Southeast Asia: what are the prospects for smallholders?, J. Peasant Stud., 2013, 40, 155–170.
- Harris, N.L., Brown, K., Netzer, M., Killeen, T.J. et Gunarso, P., Projections of oil palm expansion in Indonesia, Malaysia and Papua New Guinea from 2010 to 2050, Reports from the Technical Panels of the 2nd Greenhouse Gas Working Group of the Roundtable on Sustainable Palm Oil (RSPO), 2013. Roundtable on Sustainable Palm Oil (RSPO).
- Warren‐Thomas, E., Dolman, P. M. et Edwards, D. P., Increasing Demand for Natural Rubber Necessitates a Robust Sustainability Initiative to Mitigate Impacts on Tropical Biodiversity, Conservation Letters, 2015 (résumé).
- Après l'huile de palme, le caoutchouc, Journal de l'environnement, 17 avril 2015.
- Li, H., Aide, T.M., Ma, Y., Liu, W. et Cao, M., Demand for rubber is causing the loss of high diversity rain forest in SW China, Biodivers. Conserv., 2007, 16, 1731–1745.
- Koh, L.P. et Wilcove, D.S., Is oil palm agriculture really destroying tropical biod iversity?, Conserv. Lett., 2008, 1, 60–64.
- (en) « Cambodian forests fall victim to global demand for rubber tyres », sur Nature, (consulté le )
- Nguyen B.T., Large-scale altitudinal gradient of natural rubber production in Vietnam, Ind. Crops Prod., 2013, 41, 31–40.
- Leimona, B., Eco-certified natural rubber from sustainable rubber agroforests in Sumatra, 2010, Indonésie (résumé).
- Feintrenie, L. et Levang, P., Sumatra’s rubber agroforests: advent, rise and fall of a sustainable cropping system, Small - scale For., 2009, 8, 323–335.
- Ahlheim, M., Börger, T. et Frör, O., Replacing rubber plantations by rain forest in Southwest China—who would gain and how much?, Environmental Monitoring and Assessment, 2015, 187(2), 3.
- Wik A., Nilsson E., Källqvist T., Tobiesen A. et Dave G., Toxicity assessment of sequential leachates of tire powder using a battery of toxicity tests and toxicity identification evaluations, Chemosphere, novembre 2009, 77(7):922-7, DOI:10.1016/j.chemosphere.2009.08.034, Epub 15 septembre, résumé.
- Evans J.J., Rubber tire leachates in the aquatic environment, Rev. Environ. Contam. Toxicol., 1997, 151:67-11, résumé.
- PEC pour Predicted Environmental Concentrations.
- PNEC pour Predicted No Effect Concentrations.
Voir aussi
Articles connexes
Liens externes
- (en) Référence Flora of China : Hevea brasiliensis
- (en) Référence Catalogue of Life : Hevea brasiliensis (Willd. ex A.Juss.) Müll.Arg. (consulté le )
- (fr) Référence Tela Botanica (France métro) : Hevea brasiliensis (Willd. ex A. Juss.) Müll.Arg.
- (fr) Référence Tela Botanica (Antilles) : Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg.
- (fr+en) Référence ITIS : Hevea brasiliensis (Willd. ex Adr. Juss.) Muell. Arg.
- (en) Référence NCBI : Hevea brasiliensis (taxons inclus)
- (en) Référence GRIN : espèce Hevea brasiliensis (Willd. ex A. Juss.) Mull. Arg.
Bibliographie
- http://www.cirad.fr/content/download/1131/9755/version/2/file/hevea.pdf
- International Rubber Research and Development Board (IRRDB).
- International Rubber Study Group (IRSG).
- Centre de coopération internationale en recherche agronomique pour le développement (Cirad). Unités de recherche Cirad :
- Compagnon, P., Le caoutchouc naturel, Biologie - Culture - Production, 1986, Maisonneuve et Larose éditeurs, 595 p.
- Nath, T.K., Inoue, M. et De Zoysa, M., Small-Scale Rubber Planting for Enhancement of People’s Live lihoods: A Comparative Study in Three South Asian Countries, Soc. Nat. Resour., 2013, 26, 1066–1081.
- Portail de la botanique
- Portail des plantes utiles