Grippe
La grippe (ou influenza) est une maladie infectieuse fréquente et contagieuse causée par certains virus à ARN de la famille des orthomyxoviridés : le virus de la grippe A, le virus de la grippe B, le virus de la grippe C et le virus de la grippe D[2]. Elle touche les oiseaux et certains mammifères dont le porc, le phoque et l'être humain.
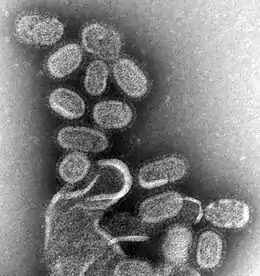
Cliché de microscopie électronique en transmission issu de la bibliothèque d'images de Santé publique du Center for Disease Control[1].
| Spécialité | Médecine générale, pneumologie et maladie infectieuse |
|---|
| CISP-2 | R80 |
|---|---|
| CIM-10 | J10, J11 |
| CIM-9 | 487 |
| OMIM | 614680 |
| DiseasesDB | 6791 |
| MedlinePlus | 000080 |
| eMedicine | 219557 et 972269 |
| eMedicine | med/1170 ped/3006 |
| MeSH | D007251 |
| Incubation min | 3 h |
| Incubation max | 72 h |
| Symptômes | Fièvre, congestion nasale (en), myalgie, céphalée, fatigue, toux, rhinite, douleur thoracique et frissonnement (en) |
| Maladie transmissible | Transmission aéroportée (d), contamination par les sécrétions respiratoires (d), transmission directe (d) et transmission par surface contaminée (d) |
| Causes | Virus de la grippe |
| Médicament | Peramivir, oseltamivir, zanamivir et Baloxavir |
| Patient UK | Influenza |
![]() Mise en garde médicale
Mise en garde médicale
Elle sévit sur un mode épidémique saisonnier essentiellement automno-hivernal dans les pays tempérés, permanent dans des pays tropicaux comme le Cameroun. Elle se traduit chez l'être humain par un ensemble de signes non spécifiques associant fièvre, céphalées, toux, pharyngite, myalgies, asthénie et anorexie. Ces symptômes, éléments du syndrome grippal dont la grippe n'est qu'une cause parmi d'autres, font évoquer le diagnostic par la soudaineté de leur apparition, leur survenue en période d'épidémie grippale et leur disparition habituelle après quelques jours d'évolution. Dans les cas les plus sérieux, la grippe est grevée de complications (au premier rang desquelles les pneumonies bactériennes et la déshydratation) possiblement fatales.
La transmission inter-humaine de la maladie est essentiellement respiratoire, via des gouttelettes riches en virus provenant de la toux et des éternuements des sujets infectés. Le diagnostic de la grippe en période d'épidémie est simple, et une grippe non compliquée relève habituellement d'un traitement symptomatique. Des antiviraux sont disponibles pour le traitement et la prophylaxie de la grippe, parmi lesquels les inhibiteurs de la neuraminidase tiennent aujourd'hui une place de choix. La prévention de la grippe repose sur une vaccination annuelle, proposée dans la plupart des pays industrialisés aux personnes à risque[3] et administrée aux volailles d'élevage[4].
Souvent banalisée comme synonyme de rhume ou de « coup de froid », la grippe est une maladie sérieuse et un problème majeur de santé publique à l'échelle planétaire[5]. Elle est responsable dans le monde d'une morbidité élevée, avec environ 5 millions de cas de maladies graves et de 290 000 à 650 000 décès par an, essentiellement des personnes à risque - les jeunes enfants, les personnes âgées et celles souffrant d’affections chroniques[6]. En France, la grippe touche entre 2 et 7 millions de personnes et provoque environ 10 000 morts chaque hiver[7],[8],[9]. Le coût sanitaire et social annuel de la grippe est considérable, évalué à plusieurs milliards de dollars aux États-Unis, et à 460 millions d'euros en France[10] pour une épidémie moyenne.
Virologie
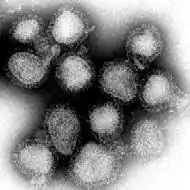
Les virus de la grippe sont des virus à ARN. Ils appartiennent à la famille des Orthomyxoviridae et se répartissent en quatre espèces virales : virus de la grippe A, virus de la grippe B, virus de la grippe C et virus de la grippe D[11] distingués par l'antigénicité de leurs nucléoprotéines. Depuis 2003, les virus de type A (les plus fréquents et les plus virulents) sont encore plus finement caractérisés et différenciés en sous-types sur la base de leurs antigènes de surface : l'hémagglutinine (H1 à H18) et la neuraminidase (N1 à N11)[12]. Les antigènes H16, 17 et 18 ont été identifiés plus tardivement[13],[14]. Les virus de type A et B sont responsables des épidémies grippales annuelles, mais seuls les virus de type A sont à l'origine des pandémies grippales. Le virus de type C semble lié à des cas sporadiques et donne le plus souvent une grippe d'expression modérée. Les virus A et C infectent plusieurs espèces, tandis que le virus B est presque spécifique de l'espèce humaine (on ne le rencontre sinon que chez les phoques)[15],[16].
Structure de la particule virale
La particule virale est constituée d'une enveloppe lipidique hérissée de spicules formées par les glycoprotéines de surface. Les virus A et B ont deux glycoprotéines de surface, l'hémagglutinine (H) et la neuraminidase (N).
L'hémagglutinine qui représente environ 40 % des glycoprotéines de surface, est formée par l'association de deux sous unités, HA1 et HA2, reliées par un pont disulfure. L'association de trois monomères HA forme une spicule d’hémagglutinine à la surface de la particule virale. L'hémagglutinine permet la fixation du virus sur l'acide sialique terminal des cellules de l'épithélium cilié de l'arbre respiratoire : elle est très immunogène induisant la production d'anticorps dont certains peuvent être neutralisants. L'hémagglutinine favorise également la fusion des membranes virales et cellulaires au cours de la phase de pénétration du virus.
La neuraminidase (ou N-acetyl-neuraminyl-hydrolase), est une sialidase présente sous la forme d'homotétramères à la surface de la particule virale. Elle permettrait la libération de virions néoformés en lysant les acides sialiques à la surface de la cellule, ce qui détache l'hémagglutinine et donc la particule virale.
Dans le cas du virus de type C, il n'y a qu'une sorte de spicule à la surface de la particule virale qui assure les fonctions à la fois de l'hémagglutinine et de la neuraminidase.
En plus des glycoprotéines de surface, l'enveloppe virale est constituée de deux autres protéines virales : la protéine de matrice, M1, qui sous-tend l'ensemble de l'enveloppe virale et la protéine M2 qui joue le rôle de canal ionique pour les virus de type A. Pour les virus de sous-type B, une protéine de surface NB s'insère dans la bicouche lipidique et assurerait des fonctions équivalentes à celles de la protéine M2 des virus de type A. Enfin, une protéine CM2 serait l'homologue pour les virus de type C.
À l'intérieur de la particule virale, le génome viral est présent sous la forme de sept ou huit nucléocapsides de symétrie hélicoïdale qui résultent chacune de l'association d'une molécule d'ARN à polarité négative et de nombreuses molécules de nucléoprotéine, NP. Cette protéine fait partie des antigènes internes du virus : elle détermine le type viral A, B ou C. Trois polymérases, PA (protéine acide), PB1 et PB2 (protéine basique 1 et 2, respectivement), forment le complexe réplicase/transcriptase et sont associées aux nucléocapsides. Le génome des virus A et B est constitué de huit segments d'ARN alors que celui du virus C n'en comporte que sept.
Le virus de la grippe reste pathogène durant environ une semaine à température corporelle, plus de trente jours à 0 °C et presque indéfiniment à des températures très basses (par exemple les lacs du nord-est de la Sibérie). La plupart des souches de virus grippal sont aisément inactivées par les désinfectants et les détergents[17],[18],[19].
Classification et nomenclature
La classification des virus grippaux ne s’applique qu’aux virus de type A dont certains sont hautement pathogènes pour l’homme. Elle s'appuie sur les propriétés antigéniques de l'hémagglutinine (H) et de la neuraminidase (N). Il existe 18 sous-types H, et 11 sous-types N[20].
Cela peut donner 18 X 11 soit 198 combinaisons possibles. Chez l'homme, il existe des virus à H1, H2, H3 et N1 ou N2 responsables de la grippe annuelle. Tous les sous-types existent dans le monde aviaire avec des virus ayant une pathogénicité très variable pour les oiseaux. Ces dernières années, un virus hautement pathogène pour l'Homme, H5N1 (avec une hémagglutinine de sous-type H5 et une neuraminidase de sous-type N1) s'est propagé sous la forme d'une panzootie d'influenza aviaire et se transmet de manière très rare à l'homme ; il est alors question de grippe aviaire.
Pour le virus de la grippe aviaire, le terme « H5N1 » est encore large, et peut comprendre d'autres sous-types. En effet, actuellement, différentes souches virales circulent avec des pouvoirs pathogènes très variables. Par exemple : A/chicken/Shantou/423/2003(H5N1) ou A/bar-headed goose/Qinghai/5/2005(H5N1). La nomenclature doit être comprise comme cela : type / animal chez lequel il a été isolé, sauf si c'est l'homme / lieu d'isolement de la souche virale / numéro de la souche / année d'isolement (sous-type).
D'autres souches (H5 ou H7) sont transmissibles à l'homme sans toutefois avoir le même pouvoir pathogène. D'autres souches atteignent d'autres espèces de mammifères tels que le cheval, le porc, etc.
Origine de la variabilité des virus grippaux
Les virus grippaux évoluent et mutent selon deux mécanismes : les mutations (glissements antigéniques ou en anglais : drift) ou réassortiment antigéniques (shift), ce qui permet au virus de s'adapter aux défenses immunitaires de ses hôtes.
Glissement
Les mutations sont des variations antigéniques qui ne modifient pas la structure antigénique globale du virus et permettent donc de conserver une immunité partielle à court terme. Ces mutations se produisent au moment de la synthèse des ARN viraux en raison du taux élevé d'erreurs de l'ARN polymérase virale. Pour tenir compte des glissements antigéniques, les vaccins grippaux sont donc préparés chaque année à partir des souches virales ayant circulé l'année précédente. En février de chaque nouvelle année, l'Organisation mondiale de la santé (OMS) fixe les souches virales qui composeront le vaccin antigrippal de l'année suivante, en fonction des données épidémiologiques résultant de la surveillance des virus de la grippe circulants. En 2005, l'OMS a demandé le remplacement de la souche de la grippe A/Fujian/411/2003(H3N2) par la souche A/California/7/2004(H3N2) pour la préparation des vaccins antigrippaux.
Réassortiment
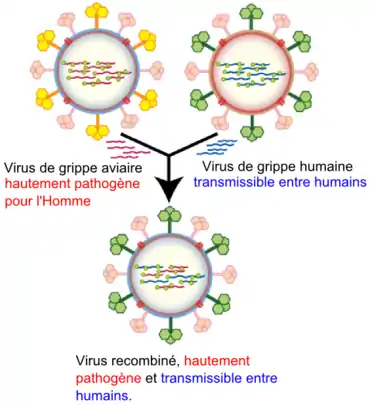
Les réassortiments antigéniques sont des changements radicaux de la structure de l'hémagglutinine. Elles résultent de réassortiments génétiques survenant entre des virus de sous-types différents. Ces réassortiments aboutissent notamment au remplacement d'un type d'hémagglutinine par un autre. L'antigène nucléoprotéique NP, lui, est conservé, il s'agit toujours d'un virus de type A. L'immunité préexistante à ce changement est sans effet sur le nouveau virus si bien que les grandes pandémies surviennent à la suite de cassures antigéniques. À l’heure actuelle, les spécialistes craignent une recombinaison génétique entre un virus de la grippe aviaire A(H5N1) et un virus humain circulant qui pourrait donner naissance à un nouveau virus hautement pathogène pour l’homme.
Diagnostic
Clinique
La période d'incubation est courte (1–2 jours). La maladie débute brutalement par une fièvre supérieure à 38,5 °C avec frissons, des céphalées, une sensation de malaise général (asthénie), de l'anorexie, avec des douleurs diffuses en particulier des muscles (myalgies) et des articulations (arthralgies). À ce tableau s'ajoutent des signes d'atteinte respiratoire (congestion nasale, rhinorrhée, toux sèche), de l'odynophagie, de la dysphonie. La fièvre dure 2 à 4 jours, la guérison est rapide mais l'asthénie et la toux peuvent persister jusqu'à deux semaines.
Il est courant d'observer un « V » grippal. Après l'incubation, il y a une forte fièvre (39 - 40 °C), puis une chute de la température avant une remontée, d'où le terme de fièvre « en V ». Bien que les nausées et les vomissements puissent être rencontrés dans la grippe, surtout chez les enfants, ils sont plus souvent l'expression d'une gastro-entérite virale dont l'épidémiologie est également hivernale[21].
Les risques de complication sont à prendre plus particulièrement en compte chez les sujets d'âges extrêmes (nouveau-nés, nourrissons, enfants de moins de cinq ans, personnes âgées), les femmes enceintes et ceux présentant des comorbidités (immunodépression, diabète, atteinte cardiaque, atteinte respiratoire, atteinte rénale chronique). La grippe est parfois un facteur de décompensation de pathologies sous-jacentes déjà présentes. Les formes compliquées sont rares mais graves : œdème aigu du poumon dû à une insuffisance cardiaque gauche, myocardite, rhabdomyolyse, méningite lymphocytaire, formes neurologiques.
Des complications liées à une surinfection bactérienne sont fréquentes : otite moyenne aiguë, bronchite, pneumonie bactérienne secondaire, sinusite chez l'enfant. Il peut également y avoir de la déshydratation (à cause de la fièvre), des complications thrombo-emboliques de décubitus, l'apparition d'une grippe maligne associée à un syndrome de détresse respiratoire aiguë (SDRA), l'apparition du syndrome de Reye en cas de prise d'aspirine ou de salicylés au long cours.
La grippe grave ne doit jamais être méconnue du fait de la possibilité de décès : il faut savoir que la grippe est la seconde cause de mortalité par maladie infectieuse en France par an en France, derrière la pneumonie à pneumocoque. Entre 2016 et 2019, la grippe a tué entre 8 000 et 16 000 personnes selon les années[22]. Ce tableau clinique particulier associe des signes aspécifiques de grippe avec une insuffisance respiratoire aiguë, et parfois défaillance multi-viscérale. Elle est toujours consécutive à l'infection d'un sujet fragilisé.
Virologique
Le tableau clinique du syndrome grippal peut être induit par d'autres virus (paramyxovirus, adénovirus qui produisent des syndromes fébriles douloureux). Le diagnostic de certitude est essentiel pour dater le début d'une épidémie. Le diagnostic se fait par l'analyse de prélèvements respiratoires : écouvillonnage nasal, aspiration nasopharyngée. En cas de pneumopathie, notamment chez l'adulte, un liquide de lavage bronchoalvéolaire peut être prélevé. La détection rapide du virus par une technique immunologique (immunofluorescence indirecte, tests immunophorétiques rapides…) est la plus employée, car produisant un résultat en 3 à 4 heures, pour un coût faible, en répondant aux exigences de sensibilité et de spécificité des laboratoires de virologie.
Il existe aussi des tests chromatographiques permettant de déceler qualitativement les antigènes viraux d'influenza dans des échantillons préparés à partir de prélèvement respiratoire. Ces tests peuvent donner des résultats très rapidement (environ 15 minutes) mais ont tendance à donner de faux-négatif et ne peuvent donc pas remplacer les tests plus poussés. Ils sont cependant fortement utilisés comme tests présomptifs afin d'orienter rapidement le traitement. Les résultats négatifs sont toujours confirmés par des méthodes plus sensibles et spécifiques, par exemple par PCR[23].
De plus en plus de laboratoires utilisent aussi des techniques de biologie moléculaire : extraction de l'ARN viral du prélèvement, puis RT-PCR en point final ou RT-PCR quantitative. Ces techniques permettent un diagnostic assez rapide (moins de deux heures pour l'extraction suivie de la RT-PCR quantitative) et fiable, qui a l'avantage aussi de permettre un premier typage. La RT-PCR peut ensuite être complétée par un séquençage du génome viral, dans un but essentiellement épidémiologique. C'est par exemple ce qui est réalisé dans les Centres Nationaux de Référence de la grippe en France.
L'isolement du virus sur culture cellulaire (cellules de reins de chien, MDCK) est exceptionnellement nécessaire. Il est utile pour le suivi épidémiologique annuel de la grippe. En l'absence d'effet cytopathogène du virus, la culture doit être complétée par une réaction d'hémagglutination (HA), d'inhibition d'hémagglutination (IHA) ou d'immunofluorescence (IF).
Prospective
En , une équipe[24] a annoncé [25] disposer d'un analyseur de poche capable de détecter (par puce) le H5N1 dans un échantillon de mucus ou de selles (humain ou aviaire), en moins de 30 minutes. Selon l'équipe, il est « aussi sensible, 440 % plus rapide et 2 000 à 5 000 % moins coûteux » que les meilleurs tests existants, et pourrait être adapté au SRAS, au VIH (virus du SIDA), à l'hépatite B. La production commerciale n'en est toutefois pas faite, et l’OMS semble rester prudente en attendant d’en savoir plus. Le système se présente sous la forme d’un appareil compact entièrement automatisé, intégrant l’extraction, l’amplification (RT-PCR) et la détection en temps réel sur biopuces de l’ARN viral. Il permettra la détection sur site du virus de la grippe à partir d’un échantillon clinique ou vétérinaire en identifiant la nature H ou N des souches connues du virus notamment les formes actuelles de la grippe aviaire ou porcine.
Un projet européen « Portfastflu »[26] doté de 3,8 millions d’€, dans le cadre du 7e programme cadre de recherche, vise à valider et développe un système de diagnostic rapide (détectant tous les virus grippaux dont H5N1 HP et H1N1 HP en moins d'une heure) pour améliorer la veille et l’alerte épidémiologique à la grippe, y compris dans les pays pauvres.
Prévention
Mesures d'hygiène
Comme pour beaucoup de maladies infectieuses, l'hygiène est la première forme de prévention de la contagion en période épidémique :
- se laver les mains soigneusement et plusieurs fois par jour, au savon ou avec une solution hydro-alcoolique désinfectante pour les mains, surtout après tout contact physique direct avec une personne potentiellement infectée ou s'occupant d'un malade, ou avec des surfaces potentiellement contaminées par le virus ;
- se protéger et protéger les autres des projections (buccales ou nasales) en toussant ou éternuant dans un mouchoir jetable (à jeter dans une poubelle fermée aussitôt avant de se laver ou se désinfecter les mains) ou en toussant ou éternuant dans le creux du bras (plutôt que dans les mains) si l'on ne dispose pas de mouchoirs. Les projections d'un malade peuvent être réduites par le port d'un masque de type chirurgical en présence de tiers.
Mais en pratique :
- il ne semble pas que l'emploi de systèmes de protection respiratoire autre qu'un simple masque chirurgical aboutisse à une contamination moindre[27] ;
- l'importance du lavage des mains (dans la grippe) semble surestimée[28] ;
- aucune étude ne valide l'usage des mouchoirs en papier versus ceux en tissu. Il en est fait mention, dans les recommandations, comme protection lors de la toux et des éternuements, mais pas lors du mouchage. Il est bien recommandé de les jeter ensuite « dans une poubelle fermée », mais en pratique cela aboutit au rejet dans l'environnement de nombreux mouchoirs infectés, dont on peut penser qu'ils participent à la diffusion du virus. La méthode alternative consistant à tousser dans son coude replié semble donc préférable.
Il vaut mieux privilégier les méthodes efficaces, comme le port du masque, ou les méthodes d'éviction : rester chez soi si l'on est malade, et éviter tout contact inutile avec des personnes non-malades, éviter toute atmosphère confinée, aérer régulièrement les pièces. Si un individu sain cohabite avec un autre individu malade, il est fortement conseillé à l'individu sain de désinfecter tout objet ayant pu être contaminé par la personne malade : poignées de porte, ustensiles, etc. Il est préférable que l'individu sain reste également en quarantaine ; si toutefois il est dans l'obligation d'avoir un contact avec une tierce personne (apport de denrées alimentaires par cette tierce personne par exemple), il est impératif de garder le masque et de penser à se laver rigoureusement les mains avant et après ce contact.
En France, une ordonnance médicale permet d'acquérir en pharmacie un lot de 50 masques chirurgicaux (à changer après quatre heures de port), mais ils ne sont pas pris en charge par la sécurité sociale.
Ces mesures (lavage de mains et masques chirurgicaux) sont surtout efficaces si elles sont prises très tôt dans le cours de la maladie[29]. La protection n'est cependant pas absolue, en partie probablement parce qu'elles sont difficiles à mettre en place de façon rigoureuse dans la durée.
Nutrition
La réponse immunitaire à la grippe est inhibée par l'additif alimentaire E319 (tert-butylhydroquinone (tBHQ))[30].
Oligothérapie
Des experts américains recommandent, à la lumière de l'expérience acquise dans la gestion de la pandémie par le virus H1N1, de s'assurer tout d'abord que la population à risque ne souffre pas de déficit même marginal en zinc[31]. Ce déficit marginal apparaît comme étant fréquent dans les populations à risque (enfants et vieillards) dans les pays développés[32],[33], et se traduit par une baisse du zinc lymphocytaire et de la thymuline circulante à taux plasmatiques de zinc normaux. La réponse immunitaire qualitative et quantitative s'en trouve affectée, que ce soit sur le bras cellulaire ou humoral[34]. D'autre part, on a démontré que l'adjonction de zinc induisait l'apoptose des cellules infectées par le virus de la grippe et facilitait ainsi leur phagocytose, limitant la propagation du virus de la grippe[35]. La supplémentation en zinc doit se faire avec l'apport d'autres oligoéléments (cuivre, zinc) et vitamines afin de ne pas induire un effet négatif sur leur absorption intestinale[36].
Vaccination
L’OMS recommande la vaccination antigrippale saisonnière, ou dite annuelle pour (par ordre de priorité) :
- les femmes enceintes à n'importe quel stade de leur grossesse ;
- les enfants de 6 mois à 5 ans ;
- les personnes âgées (≥ 65 ans) ;
- les personnes souffrant d’affections chroniques ;
- les agents de santé.
La vaccination contre la grippe est surtout efficace lorsque les virus vaccinaux correspondent bien aux virus en circulation. L’OMS surveille les virus grippaux qui circulent chez l’homme et actualise deux fois par an la composition des vaccins grippaux, traditionnellement des vaccins trivalents qui ciblent les trois types de virus en circulation les plus représentatifs (deux sous-types du virus A et un virus du type B) et, depuis peu dans l’hémisphère Nord, les recommandations de l’OMS portent aussi sur un deuxième virus grippal de type B en plus des virus contenus dans les vaccins trivalents classiques. Un certain nombre de vaccins grippaux inactivés et de vaccins grippaux recombinants sont disponibles sous forme injectable. Le vaccin vivant atténué est administré par voie intranasale[37].
- Chez les personnes âgées de plus de 65 ans
- une revue Cochrane de 2018 portant sur 8 études incluant environ 5 000 personnes a montré que les personnes âgées recevant le vaccin contre la grippe pourraient avoir un risque plus faible de grippe (de 6 à 2,4 %), et ont probablement un risque plus faible de syndromes grippaux par rapport à celles qui ne reçoivent pas de vaccination au cours d'une seule saison de la grippe (de 6 à 3,5 %). Les données disponibles relatives aux complications sont en revanche insuffisantes pour donner de claires indications de santé publiques sur ce point[38].
- Chez les enfants en bonne santé de 2 à 16 ans
- une revue Cochrane mise à jour en 2018 portant sur 41 études incluant plus de 200 000 enfants en bonne santé a montré que la vaccination par vaccins vivants atténués semblait réduire le risque de contracter la grippe saisonnière de 18 à 4 %. Quant au vaccin inactivé, il permettrait une réduction 30 à 11 %. On ne disposait pas de suffisamment de données pour tirer des conclusions définitives sur les complications graves comme la pneumonie ou l'hospitalisation[39].
- Chez les adolescents et adultes en bonne santé de 16 à 65 ans
- une revue Cochrane de 2018 portant sur 52 études incluant plus de 80 000 personnes a montré que les vaccins ont réduit l'incidence de la grippe confirmée en laboratoire de 2,3 à 0,9 %, ce qui représente une réduction du risque d'environ 60 %. Cependant, dans le cas d'une maladie semblable à la grippe, définie comme les mêmes symptômes de toux, de fièvre, de maux de tête, d'écoulement nasal et de douleurs corporelles, le vaccin a réduit le risque de 21,5 à 18,1 %. Il s'agit d'une réduction beaucoup plus modeste du risque d'environ 16 %. La différence s'explique probablement par le fait que plus de 200 virus causent des symptômes identiques ou similaires à ceux du virus de la grippe[40].
- Chez les personnes ayant un cancer
- une revue Cochrane mise à jour en 2018 portant sur 2 275 participants montre que les données actuelles, bien que de qualité faibles, suggèrent un avantage pour la vaccination contre la grippe chez les adultes atteints de cancer et que le vaccin ne s'est pas révélé nocif. Les vaccins antigrippaux administrés aux adultes atteints de cancer contiennent un virus inactivé qui ne peut pas causer la grippe ou une autre infection virale. Le niveau de preuve de ces données est limité par le faible nombre d'études et par leur faible qualité méthodologique (risque élevé de biais)[41].
Antiviraux
L'utilisation de l'oseltamivir en prophylaxie antivirale est indiquée seulement dans le cas où le sujet est déjà contaminé ou risque fortement de l'être. Elle permet la réduction de 80 % du nombre de cas de grippe chez les sujets contacts traités précocement, dans les premières 48 heures après la contagion [réf. nécessaire]. La prophylaxie post-exposition par l'oseltamivir est recommandée pour les sujets de plus de 13 ans et à risques de complications grippales graves et/ou non protégés par la vaccination, car immunodéprimés, non vaccinés, ou à la suite d'une vaccination trop récente ou dont la souche injectée est inadaptée.
Traitement
L'augmentation de la température centrale (fièvre) est un mécanisme physiologique immunitaire antiviral qui perturbe la biochimie des réplications virales. Il n'y a pas de preuves scientifiques du bénéfice (en termes de morbi-mortalité) des traitements symptomatiques des infections virales aiguës bénignes saisonnières de l'adulte sain en général et de l'infection grippale, en particulier.
Le repos (l'arrêt de travail permet de limiter la contagion et les risques de propagation de l'infection) est nécessaire. Des traitements médicamenteux peuvent inclure antalgiques, antitussifs, antipyrétiques (le paracétamol est utilisé en première intention car il entraine peu d'effets secondaires) et même vitamine C (qui peut être indiquée contre l'asthénie passagère due au syndrome grippal). L'aspirine est contre indiquée chez les jeunes enfants, car son administration lors d'une grippe peut entrainer un syndrome de Reye, rare mais potentiellement mortel. L'hydratation est également nécessaire en fonction de la fièvre.
Les antibiotiques ne sont prescrits qu'en cas de surinfection bactérienne (notamment l'amoxicilline).
Traitement antiviral
Il existe des médicaments antiviraux. Ces traitements, pris précocement, peuvent diminuer modérément l'importance des symptômes et la durée de l'affection et également prévenir l'infection. Mais ils sont coûteux et doivent être pris dans les 48 heures après l'apparition des symptômes :
- l'oseltamivir (Tamiflu) et le zanamivir (Relenza) sont des inhibiteurs de la neuraminidase ;
- le baloxavir, un inhibiteur de l'endonucléase, réduit les symptômes et la charge virale[42] ;
- l'amantadine (Mantadix) et la rimantadine sont actives contre la grippe A (mais pas sur les autres types), avec un taux important de résistance, ce qui fait qu'ils ne sont plus recommandés[43].
En Juin 2020, la Commission de Transparence de la Haute Autorité de Santé à estimé le service médical rendu de l'oseltamivir comme faible en traitement préventif en situation de pandémie grippale avérée ou potentielle. Dans les autres autres indications de l'oseltamivir (notamment en traitement curatif), le service médical rendu est considéré comme insuffisant et ne justifie plus un remboursement au titre de la solidarité nationale.
Épidémiologie
À la suite d'une épidémie grippale de soldats américains en 1947 au cours de laquelle leur vaccin s'est montré peu efficace (faisant suspecter l'émergence d'un nouveau virus), l’OMS a développé un programme mondial de surveillance de la grippe par des laboratoires de référence[44].
En France
En France métropolitaine, la surveillance[45] de la grippe a d'abord été réalisée par deux réseaux de médecins libéraux créés en 1984. Le réseau Sentinelles de l'unité de recherche UMR-S-707 INSERM UPMC et le Réseau des GROG (groupes régionaux d'observation de la grippe) et sur une surveillance virologique réalisée par deux centres nationaux de référence (Institut Pasteur de Paris pour le nord de la France, CHU de Lyon pour le sud). En préparation à une pandémie grippale, ce réseau a été peu à peu complété à partir de 2003. Il existe dorénavant une surveillance des passages et hospitalisations pour grippe à travers un réseau de services d'urgences, le réseau Oscour, une surveillance des cas graves de grippe admis en réanimation, une surveillance de la mortalité toutes causes en temps réel (données administratives de l'état-civil transmis par les mairies à l'Insee) et un signalement des épidémies d'infections respiratoires aiguës déclarées par les collectivités de personnes âgées. Les deux réseaux historiques, Sentinelles et GROG, alimentent depuis la pandémie de 2009 la même base de données avec une même définition de cas, permettant ainsi une meilleure précision des estimations d'incidence nationale et régionales. Depuis , le projet GrippeNet.fr[46] complète les systèmes de surveillance déjà en place, en collectant des données directement auprès de la population de France métropolitaine. Dans les Antilles françaises, en Guyane et à la Réunion, un système équivalent a été mis en place tant au niveau des médecins généralistes qu'en milieu hospitalier. La surveillance est animée par les cellules de l'InVS en région, la Cire Antilles-Guyane et la Cire Océan Indien.
En 2014, le réseau des GROG a cessé son activité faute de financement[47].
L'ensemble de la surveillance de la grippe, qui débute le 1er octobre et se termine environ à la mi-avril de chaque année est coordonné par l'Institut de veille sanitaire qui synthétise dans son bulletin hebdomadaire les informations récoltées par tous les dispositifs. Une description détaillée de ces dispositifs et leurs résultats sont disponibles dans le « dossier grippe » du site de l'InVS[48].
Fin janvier 2013, la grippe est responsable d’environ 1 100 000 recours aux médecins généralistes et pédiatres en France métropolitaine. Les trois virus A(H1N1)pdm09, A(H3N2) et B sont impliqués[49].
Selon les modèles statistiques développés par l'agence française de sécurité sanitaire, la grippe tue en moyenne 10 000 personnes par an en France[50],[51]. La courbe de mortalité suit un mouvement périodique, qui comprend un pic hivernal. À partir de ce modèle, on recense tous les décès supplémentaires qui surviennent en période d’épidémie grippale et on les attribue à la grippe.
Selon le Centre d’épidémiologie sur les causes médicales de décès (CépiDc un laboratoire de l’Inserm chargé d’élaborer chaque année la statistique des causes médicales de décès), la grippe aurait tué environ 431 personnes en moyenne chaque année. Pour obtenir ce chiffre, les chercheurs ont comptabilisé les certificats de décès complétés par les médecins mentionnant la grippe comme cause de la mort[52],[53].
Données épidémiologiques hospitalières
L’Institut de veille sanitaire (InVS) recueille quotidiennement et automatiquement auprès d'un grand nombre d'établissements hospitaliers des données relatives à l’activité syndromique, dont la grippe, des services d’urgences.
Surveillance en population générale
Depuis 2012, le réseau Sentinelles et l’InVS ont mis en place GrippeNet.fr, un nouveau projet de surveillance épidémiologique et de recherche sur la grippe. Ce système permet de recueillir des informations directement auprès de la population française, par Internet. Quel que soit leur âge, leur nationalité ou leur état de santé, toutes les personnes qui résident en France métropolitaine peuvent participer à cette surveillance de façon anonyme et rapide. En , plus de 5 000 personnes participaient à cette surveillance. Ce projet s’insère dans le projet européen influenzanet.eu.
Caractère saisonnier
La grippe est nettement plus fréquente et épidémique en hiver dans les zones tempérées, sauf lors de certaines pandémies. Ce phénomène est mal compris. Des dizaines d’hypothèses tentent d'expliquer cette saisonnalité, parmi lesquelles[54] :
- en période froide, rester plus souvent à l'intérieur, où l'atmosphère confinée et immobile maintient les micro-gouttelettes porteuses de virus, favorise leur transmission ;
- diminution du taux de vitamine D lié à un ensoleillement plus faible en hiver ;
- le faible taux d'humidité de l'air à l'intérieur durant l'hiver assèche davantage la muqueuse nasale, la rendant plus fragile et perméable à la pénétration du virus. Un air sec apparaît comme un milieu propice à la diffusion des particules virales qui ne sont pas rabattues vers le sol par la condensation ;
- caractéristiques virales ; des expériences d’élevage et transmission du virus chez des cochons d’Inde élevés en environnement contrôlé montrent que deux facteurs semblent déterminants[55] :
- la température ; l’air froid (5 °C) semble favoriser la transmission virale, qui est freinée à 20 °C et presque nulle à 30 °C. Le froid pourrait favoriser le virus en rendant le dégagement des voies respiratoires plus difficile (mucus plus épais et plus abondant),
- l’hygrométrie ; un air sec (20 % à 35 % d’humidité relative) favorise également la contagion par l’air.
Dans un air sec et froid, le virus grippal serait donc plus stable et plus durablement infectieux. Une température de plus de 20 °C associée à une humidité relative de plus de 50 % semble défavoriser la contagion (hors contact physique direct). Néanmoins, des foyers infectieux importants sont constatés en zone tropicale et équatoriale, chez la volaille et chez l'homme.
Confirmant ces résultats, mais leur donnant une autre explication, une étude du National Institute of Health américain, publié dans Nature Chemical Biology début 2008, indique que « le virus de la grippe est enveloppé d’une couche de molécules grasses qui durcit et le protège quand les températures baissent. Cette enveloppe, constituée de cholestérol, fond une fois que le virus a pénétré dans l’appareil respiratoire de sa victime, il peut alors infecter une cellule et se reproduire. Lorsqu’il fait trop chaud la couche protectrice ne résiste pas et le virus meurt, à moins d’être à l’intérieur d’un organisme, ce qui explique sa propension à sévir en hiver. […] Résultat : une température de 5 °C et un degré d’humidité de 20 % sont parfaits pour que les hamsters malades contaminent les autres. À 30 °C les chercheurs n’ont observé aucune transmission virale[56],[57]. »
Des chercheurs ont confirmé un phénomène observé par les praticiens, qui est qu’en hiver, un délai d’environ une semaine (4 à 10 jours) sépare le début des épidémies de rhinopharyngites chez l’enfant et l’apparition de la grippe saisonnière[58].
Grippes pandémiques
Indépendamment des épidémies, des pandémies grippales plus meurtrières sont susceptibles de survenir plusieurs fois par siècle lors de l'émergence de nouvelles souches virales, hautement contagieuses en conséquence de l'absence d'immunité dans la population humaine. Jusqu'à ce jour, il apparaîtrait que le porc représente un hôte intermédiaire entre le monde aviaire et l'homme, ce qui fait dire, pas toujours à raison, que ce sont des souches d'origine porcine dites « grippes porcines », qui ont été responsables des grippes dites espagnole (1918), asiatique (1956-1958), de Hong Kong (1968), ou mexicaine (2009). En 1997, l'apparition d'une grippe aviaire de type A sous-type H5N1 en Asie a fait craindre une nouvelle pandémie par un virus venant directement du monde aviaire, car H5N1 a infecté des humains avec des conséquences graves[59]. Ces craintes ont été pour l'instant démenties (en 2015), car la transmission d'homme à homme de H5N1 s'est avérée extrêmement inefficace (2 cas documentés).
En revanche, en une pandémie éclate provoquée par le virus de la grippe A (H1N1) pandémique, dont l'origine porcine semblait établie, sans pourtant que ce virus ait été détecté en circulation dans la population porcine. Ce virus s'est révélé très contagieux chez l'homme, mais avec une mortalité faible, ce qui n'était pas anticipé au moment de l'éclatement de la pandémie. Ce virus H1N1 pandémique a néanmoins déplacé le virus H1N1 circulant précédemment dans la population humaine.
Les réassortiments génétiques peuvent être à l'origine de grandes pandémies mondiales de grippe. Trois sont dénombrées au cours du XXe siècle, en 1918 (« grippe espagnole »), 1957 (« grippe asiatique »), et 1968 (« grippe de Hong Kong »). Ces pandémies nécessitent une souche virale très « transmissible » (contagieuse) et sont caractérisées par une morbidité voire une mortalité élevées. Ainsi la « grippe espagnole » en 1918 et 1919 aurait fait de 30 à 100 millions de victimes (selon les évaluations, 40 millions selon le site de l'Institut Pasteur), dont plus de la moitié chez les jeunes adultes[60]. Le virus en cause, proche de la grippe porcine, était très différent de ceux circulant à l'époque.
Historique
Terminologie
Le mot « influenza » (abrégé en flu) a été utilisé pour la première fois pour qualifier la grippe dans un traité médical anglais du XVIIIe siècle qui fait référence à l'épidémie de 1743. Mais son origine est plus ancienne, provenant probablement de l'expression italienne « influenza di freddo » ([sous] l'influence du froid)[61]. Il rappelle le caractère saisonnier de la maladie, qui laisse supposer l'influence de l'environnement extérieur sur l'homme, la maladie apparaissant lors des refroidissements vers la fin de l'automne. Le virus est réputé mieux survivre à l’extérieur de l’organisme par temps sec et froid, raison pour laquelle les épidémies saisonnières surviennent en hiver dans les climats tempérés. Néanmoins les pandémies se sont montrées actives sur toute la planète, et le virus aviaire H5N1 semble adapté (variants[62] ?) aux zones tempérées et froides (Sibérie), comme aux zones chaudes puisqu'il a surtout sévi en Asie du Sud-Est et en Indonésie, avec quelques foyers en Afrique, dans la zone tropicale.
Le mot français grippe aurait une origine germanique, Grippen signifiant « agripper, saisir brusquement ». Autrement dit : on n’attrape pas la grippe, c'est elle qui nous « agrippe ». La grippe était aussi nommée « folette » en 1733.
Le virus grippal infecte d'autres mammifères que l'Homme, terrestres et marins. Mais c'est chez l'oiseau qu'elle est la plus fréquente. Chez l’animal il est longtemps nommé « peste aviaire », « grippe aviaire » ou « grippe du poulet ». L'évolution terminologique chez l'animal est due à deux raisons. La première est l'identification de deux groupes de virus causaux de ce qui avait été dénommé peste, d'où la segmentation en maladie de Newcastle et influenza, la deuxième est la décision de ne se préoccuper, au niveau sanitaire, que des virus influenza hautement pathogènes pour l'espèce Gallus gallus. Au symposium de Beltsville, Maryland (1981), il est décidé de ne plus parler de « peste du poulet » mais « d’influenza hautement pathogène », bien que le caractère pathogène ne dépende pas uniquement du virus, mais aussi de l'immunité de l'individu infecté.
Origine
La grippe serait apparue chez les oiseaux il y a environ 6 000 ans, et la grippe humaine vers −2500 en Chine avec le développement de la domestication des oiseaux, notamment des canards qui constituent le réservoir important des gènes viraux[44], ainsi que de l'élevage des porcs qui « jouent un rôle crucial dans l'émergence des pandémies »[63].
Épidémiologie de l'Antiquité au XIXe siècle
Les symptômes de la grippe humaine ont été clairement décrits par Hippocrate il y a près de 2 400 ans[64],[65]. Tite-Live décrivit dans la Rome antique des épidémies brutales qui semblent rétrospectivement pouvoir être attribuées à la grippe. Depuis lors, le virus a été responsable de nombreuses pandémies. Les données historiques concernant la grippe sont difficiles à interpréter, car le syndrome grippal se rencontre également dans d'autres maladies épidémiques (diphtérie, peste bubonique, fièvre typhoïde, dengue, typhus, hépatite A). La première observation convaincante remonte à 1580, avec une pandémie qui partit d'Asie et s'étendit à l'Europe et à l'Afrique. Plus de huit mille morts furent comptés à Rome et plusieurs villes espagnoles furent frappées. Les pandémies se poursuivirent de façon sporadique au XVIIe siècle et au XVIIIe siècle[66], et on note une pandémie étendue entre 1830 et 1833 (un quart des personnes exposées auraient été infectées). Ce n'est qu'à partir des années 1850 qu'une description systématique des épidémies fut entreprise par le britannique Theophilus Thompson[67].
Pandémies du XXe siècle
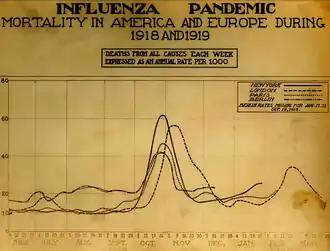
La pandémie la plus meurtrière connue à ce jour est celle de la « grippe espagnole » (virus de la grippe A, sous-type H1N1) qui sévit entre 1918 et 1919. Les plus anciennes estimations parlent de quarante à cinquante millions de morts[68], tandis que des évaluations plus récentes livrent le chiffre de cinquante à cent millions de morts dans le monde[69], ce qui en ferait une des plus graves catastrophes sanitaires de tous les temps, au même titre que la peste noire de 1347-1350. Une autre particularité de cette pandémie est qu'elle tua principalement de jeunes adultes, 99 % des décès étant survenus avant soixante-cinq ans et plus de la moitié entre vingt et quarante ans[70]. Cette forte létalité s'explique par un taux d'attaque très élevé (près de 50 % des personnes exposées) et par la sévérité extrême des symptômes, dont il est suspecté qu'elle soit liée à une réaction immunitaire excessive (« orage cytokinique »)[68]. Les symptômes, inhabituels pour une grippe, firent d'abord passer la maladie pour une dengue, un choléra ou une fièvre typhoïde. Un observateur écrivit « une des complications les plus frappantes était une hémorragie des muqueuses, particulièrement de celles du nez, de l'estomac et des intestins. Des saignements auriculaires et des hémorragies pétéchiales survenaient également »[69]. La majorité des décès firent suite à des surinfections, notamment des pneumonies bactériennes, mais le virus tua aussi directement en causant des hémorragies et des œdèmes pulmonaires massifs dépassant les possibilités thérapeutiques de l'époque[71].
Les pandémies suivantes furent moins dévastatrices. La « grippe asiatique » de 1957 (virus de type A, souche H2N2) et la « grippe de Hong Kong » de 1968 (virus de type A, souche H3N2) firent malgré tout des millions de morts dans le monde. Le développement des antibiotiques, en permettant le traitement des surinfections bactériennes, pourrait avoir joué un rôle non négligeable dans la diminution de la mortalité[71]. De nouvelles menaces virent le jour dans le New Jersey en 1976 (fausse alerte à la grippe porcine de 1976 (en)), dans le monde entier en 1977 (« grippe russe ») et depuis 1997 à Hong Kong et dans d'autres pays asiatiques avec le virus H5N1. Toutefois, depuis 1968, l'immunité acquise contre les souches des précédentes pandémies et la vaccination ont limité l'expansion du virus et peuvent avoir aidé à prévenir le risque de nouvelles pandémies[72].
| Pandémie | Date | Décès | Sous-type impliqué | Index de sévérité |
|---|---|---|---|---|
| Grippe asiatique (russe) | 1889–1890 | 1 million | H2N2 ? | ? |
| Grippe espagnole | 1918–1920 | 30 à 100 millions | H1N1 | 5 |
| Grippe asiatique | 1957–1958 | 1 à 4 million[74] | H2N2 | 2 |
| Grippe de Hong Kong | 1968–1969 | 1 à 4 million[74] | H3N2 | 2 |
| Grippe russe de 1977 | 1977–1979 | 0,7 million[75] | H1N1 | |
| Grippe A (H1N1) | 2009–2010 | 18 138 (fin d'alerte 2010) | H1N1 | NA |
Identification du germe (virus)
La grippe était faussement attribuée à une bactérie jusqu'à ce que les agents étiologiques de la grippe, les virus de la famille des Orthomyxoviridae, soient identifiés chez le porc par Richard Schope en 1931[76]. Cette découverte fut bientôt suivie par l'isolement du virus chez les humains par un groupe de recherche dirigé par Patrick Laidlaw au National Institute for Medical Research (en) (Conseil de recherche médicale) du Royaume-Uni en 1933 : à partir de prélèvements sur la gorge de son collègue Christopher Andrewes (en) contaminé par la grippe, ce groupe a réussi à infecter le furet, animal sensible à ce virus et le seul alors capable de maintenir en culture le virus[77]. Enfin il fallut attendre que Wandell Stanley cristallise le virus de la mosaïque du tabac en 1935 pour que la nature non-cellulaire des virus soit connue.
Découverte du vaccin
Pendant la pandémie de 1918, différents vaccins furent utilisés aux États-Unis tant à des fins préventives que curatives. Inefficaces car basés sur une ou plusieurs bactéries (Haemophilus influenzae), et non sur le virus, ils semblent néanmoins avoir été assez largement utilisés faute, notamment, d'un système d'évaluation adéquat[78].
En 1935, Wilson Smith montre que le virus peut se cultiver dans les œufs de poule embryonnés, une technique déjà mise en œuvre depuis 1932 avec d'autres virus par Alice Miles Woodruff et Ernest William Goodpasture de l'université Vanderbilt, ce qui ouvre la voie au vaccin[79]. Joseph Stokes, de l'université de Pennsylvanie, commence les premiers essais de vaccins entre 1936 et 1938, mais les résultats sont peu probants[80].
La première étape significative vers la prévention de la grippe fut le développement, en 1944, d'un vaccin à base de virus grippal tué découvert par Thomas Francis, Jr. (en), avec le soutien de l'armée américaine[81]. Cette découverte se basait sur les travaux fondamentaux de Frank Macfarlane Burnet, qui démontra que le virus perdait sa virulence lorsqu'il était cultivé dans des œufs de poule embryonnés[82]. L'armée américaine, durement frappée par la grippe durant la Première Guerre mondiale, s'impliqua activement dans ces recherches[69] (travaux poursuivis dans les années 1950, par les découvertes sur l'interféron par Jean Lindenmann)[83].
Dès le début des recherches sur le virus, l'animal modèle dans ces travaux en immunologie a été le furet (Mustela putorius furo)[84], animal très sensible à ce virus, lequel peut se transmettre entre cette espèce et l'espèce humaine[85]. Il est un des rares mammifères avec l'homme à éternuer quand il est grippé[86].
Notes et références
- Source : Public Health Image Library
- (en-US) Mariette F. Ducatez, Claire Pelletier et Gilles Meyer, « Influenza D Virus in Cattle, France, 2011–2014 », Emerging Infectious Diseases, vol. 21, no 2, (DOI 10.3201/eid2102.141449, lire en ligne, consulté le )
- Publication de l'OMS : vaccins grippaux Relevé épidémiologique hebdomadaire de l'OMS, 19 août 2005, vol. 80, 33, p. 277–288.
- (en) P Villegas, « Viral diseases of the respiratory system », Poult Sci, vol. 77, no 8, , p. 1143–5. (PMID 9706079)
- (en) R Eccles, « Understanding the symptoms of the common cold and influenza », Lancet Infect Dis, vol. 5, no 11, , p. 718–25 (PMID 16253889)
- « Grippe saisonnière », sur www.who.int (consulté le )
- « Coronavirus : pourquoi la comparaison avec la grippe est-elle compliquée ? », sur SudOuest.fr (consulté le )
- « Epidémie de grippe: 34 décès en France, la vaccination toujours possible », sur sante.lefigaro.fr, (consulté le )
- GROG, impact de la grippe en France de 2001 à 2008
- Groupe d'Expertise et d'Information sur la Grippe, grippe-geig.com
- (en) Mariette Ducatez, Claire Pelletier & Gilles Meyer, « Influenza D Virus in Cattle, France, 2011–2014 », Emerging infectious diseases, vol. 21, no 2, , p. 368–371 (DOI 10.3201/eid2102.141449).
- Huraux J.-M., Traité de virologie médicale, Estem, 2003, 699 p., p. 439
- Fouchier R.A.M., Munster V., Wallensten A. et al., 2005. Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls'. Paru dans J. Virology vol. 79, no 5, p. 2814-22.
- Tong et al., 2012, A distinct lineage of Influenza virus A from Bats. Paru dans PNAS. vol. 109, no 11, p. 4269-74.
- (en) A Hay, V. Gregory, A. Douglas et Y. Lin, « The evolution of human influenza viruses », Philos Trans R Soc Lond B Biol Sci, vol. 356, no 1416, , p. 1861–70 (PMID 11779385)
- (en) A Osterhaus, G. Rimmelzwaan, B. Martina, T. Bestebroer et R. Fouchier, « Influenza B virus in seals. », Science, vol. 288, no 5468, , p. 1051–3 (PMID 10807575)
- (en) D. Suarez, E. Spackman E, D. Senne, L. Bulaga, A. Welsch et K. Froberg, « The effect of various disinfectants on detection of avian influenza virus by real time RT-PCR », Avian Diseases, vol. 47, no 3 Suppl, , p. 1091–5 (PMID 14575118)
- Avian Influenza (Bird Flu): Implications for Human Disease. Physical characteristics of influenza A viruses. UMN CIDRAP.
- Flu viruses 'can live for decades' on ice, NZ Herald, 30 novembre 2006.
- Tong S, Zhu X, Li Y, Shi M, Zhang J, Bourgeois M, Yang H, Chen X, Recuenco S, Gomez J, Chen LM, Johnson A, Tao Y, Dreyfus C, Yu W, McBride R, Carney PJ, Gilbert AT, Chang J, Guo Z, Davis CT, Paulson JC, Stevens J, Rupprecht CE, Holmes EC, Wilson IA, Donis RO, « New world bats harbor diverse influenza A viruses », PLoS Pathogens, vol. 9, no 10, , e1003657 (PMID 24130481, PMCID 3794996, DOI 10.1371/journal.ppat.1003657)
- Seasonal Flu vs. Stomach Flu by Kristina Duda, R.N.; consulté le 12 mars 2007 (Website: "About, Inc., A part of The New York Times Company")
- Santé publique France, Centre national de référence des virus des infections respiratoires (dont la grippe), Centre national de référence des virus des infections respiratoires (dont la grippe), Réseau Sentinelles, EA 7310 Université de Corse, « Surveillance de la grippe en France, saison 2018-2019 », sur www.santepubliquefrance.fr, (consulté le ).
- [PDF]Alliance entre simplicité et rapidité pour le diagnostic de la grippe, bd.com, consulté le 16 mai 2020
- équipe de Juergen Pipper, de l'Institut de bio-ingénierie et nanotechnologie de Singapour)
- Pipper, J., Inoue, M., Ng, L. et al. Catching bird flu in a droplet. Nat Med 13, 1259–1263 (2007). https://doi.org/10.1038/nm1634
- Site de PORTFASTFLU
- (en) Loeb M, Dafoe N, Mahony J et al. « Surgical mask vs N95 respirator for preventing influenza among health care workers: A randomized trial » JAMA 2009;302:1865-1871
- (en) Kim M. Snyder, « Does Hand Hygiene Reduce Influenza Transmission? », The Journal of Infectious Diseases, vol. 202, no 7, , p. 1146–1147 (ISSN 0022-1899, DOI 10.1086/656144, lire en ligne, consulté le )
- (en) Cowling BJ, Kwok-Hung Chan, Fang V, « Facemasks and hand hygiene to prevent influenza transmission in households » Ann Int Med. 2009;151:437-446
- (en) Robert Freeborn (Michigan State University) and al., « The Immune Response to Influenza is Suppressed by the Synthetic Food Additive and Nrf2 Activator, tert-butylhydroquinone (tBHQ) », This abstract is from the Experimental Biology 2019 Meeting. There is no full text article associated with this abstract published in The FASEB (Federation of American Societies for Experimental Biology) Journal., (ISSN 1530-6860, lire en ligne)
- (en) Sandstead HH & Prasad AS « Zinc Intake and Resistance to H1N1 Influenza » Am J Public Health. 2010;100(6):970-1
- (en) Meydani SN « Serum zinc and pneumonia in nursing home elderly » Am J Clin Nutr. 2007;86:1167–73
- (en) Sandstead HH et al. « Zinc deficiency in Mexican American children: influence of zinc and other micronutrients on T cells, cytokines, and antiinflammatory plasma proteins » Am J Clin Nutr. 2008;88:1067–73
- (en) Shnakar AH & Prasad AS « Zinc and immune function: the biological basis of altered resistance to infection » Am J Clin Nutr 1998; 68(suppl):447S–63S
- (en) Srivastava V. et al. « Influenza A virus induced apoptosis: Inhibition of DNA laddering & caspase-3 activity by zinc supplementation in cultured HeLa cells » Indian J Med Res 129, mai 2009, p. 579-586
- (en) Allen LH et al. « Provision of Multiple Rather Than Two or Fewer Micronutrients More Effectively Improves Growth and Other Outcomes in Micronutrient-Deficient Children and Adults » J Nutr. 2009;139:1022–1030.
- « Grippe saisonnière », sur www.who.int (consulté le )
- (en) Vittorio Demicheli, Tom Jefferson, Carlo Di Pietrantonj et Eliana Ferroni, « Vaccines for preventing influenza in the elderly », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD004876.pub4, lire en ligne, consulté le )
- (en) Tom Jefferson, Alessandro Rivetti, Carlo Di Pietrantonj et Vittorio Demicheli, « Vaccines for preventing influenza in healthy children », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD004879.pub5, lire en ligne, consulté le )
- (en) Vittorio Demicheli, Tom Jefferson, Eliana Ferroni et Alessandro Rivetti, « Vaccines for preventing influenza in healthy adults », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD001269.pub6, lire en ligne, consulté le )
- (en) Roni Bitterman, Noa Eliakim-Raz, Inbal Vinograd et Anca Zalmanovici Trestioreanu, « Influenza vaccines in immunosuppressed adults with cancer », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD008983.pub3, lire en ligne, consulté le )
- Hayden FG, Sugaya N, Hirotsu N et al. Baloxavir marboxil for uncomplicated influenza in adults and adolescents, N Engl J Med, 2018;379:913-923
- Influenza antiviral medications: summary for clinicians. Atlanta: Centers for Disease Control and Prevention
- Patrick Berche, Une histoire des microbes, John Libbey Eurotext, , p. 153
- Source BEH no 39-40 du 9 octobre 2007 (page 333) (télécharger le no 39-40
- GrippeNet.fr
- "Surveillance de la grippe par le Réseau des GROG : stoppée après 30 saisons de service
- dossier grippe du site de l'InVS
- [PDF]Bulletin du GROG
- « La grippe, une épidémie saisonnière », sur www.santepubliquefrance.fr, (consulté le )
- « Surveillance de la grippe en France, saison 2018-2019 », sur Santé Publique France, (consulté le )
- « Combien de gens meurent réellement de la grippe ? », sur sante.lefigaro.fr, (consulté le )
- « Recherche | CépiDc », sur www.cepidc.inserm.fr (consulté le )
- (en) Eric Lofgren, N. H. Fefferman, Y. N. Naumov, J. Gorski & E. N. Naumova, « Influenza seasonality: underlying causes and modeling theories », Journal of virology, vol. 81, no 11, , p. 5429-5436 (DOI 10.1128/JVI.01680-06).
- (en) Lowen AC, Mubareka S et al. « Influenza virus transmission is dependent on relative humidity and temperature » PLoS Pathog. 2007 octobre 19;3(10):1470-6
- « Pourquoi la grippe frappe en hiver ? », NOUVELOBS.COM, 4 mars 2008.
- (en) Polozov IV, Bezrukov L et al. « Progressive ordering with decreasing temperature of the phospholipids of influenza virus » Nat Chem Biol. 2008;4(4):248-55.
- Toubiana, L., Pousset, M., Messiaen, C. & Landais, P. « En période hivernale, l’évolution des rhinopharyngites infantiles est-elle annonciatrice des épidémies de grippes ? » Bulletin épidémiologique hebdomadaire 2010;38-39:401-404. Résumé
- « Grippe aviaire », OMS, (consulté le )
- Johnson N.P., Mueller J. « Updating the accounts: global mortality of the 1918-1920 “Spanish” influenza pandemic. », Bull Hist Med., printemps 2002, 76(1), p. 105-15.
- Claude Chastel, Ces virus qui détruisent les hommes, Ramsay, , p. 108.
- Variants d'échappement immunitaire. Le système immunitaire de l'hôte infecté exerce une pression immunitaire sélective, entre autres par la synthèse d'anticorps neutralisants, favorisant l'apparition de virus capables d'échapper à l'immunité et de survivre.
- Patrick Berche, Faut-il encore avoir peur de la grippe ? : histoire des pandémies, Paris, Odile Jacob, , 278 p. (ISBN 978-2-7381-2759-4), p. 10
- (en) Martin P & Martin-Granel E, « 2,500-year evolution of the term epidemic », Emerg Infect Dis, vol. 12, no 6, (PMID 16707055, lire en ligne)
- Hippocrate et Adams, Francis (traduction), « Of the Epidemics », ive siècle av. j.-c. (consulté le )
- décrite par Jussieu en 1729
- Thomson, Theophilus, Annals of Influenza or Epidemic Catarrhal Fever in Great Britain from 1510 to 1837, Sydenham Soc., Londres, 1852
- (en) K. D. Patterson et Pyle G. F., « The geography and mortality of the 1918 influenza pandemic. », Bull Hist Med., vol. 65, no 1, , p. 4–21 (PMID 2021692)
- (en) Knobler S (éditeur), Mack A (éditeur), Mahmoud A (éditeur) et Lemon S (éditeur), The Threat of Pandemic Influenza : Are We Ready? Workshop Summary (2005), Washington, The National Academies Press (lire en ligne), « 1: The Story of Influenza », p. 60–61
- (en) M. Clarke M, L. Schonberger, N. Arden, N. Cox et K. Fukuda, « Pandemic versus epidemic influenza mortality: a pattern of changing age distribution. », J Infect Dis, vol. 178, no 1, , p. 53–60 (PMID 9652423)
- (en) J. Taubenberger, A. Reid, T. Janczewski et T. Fanning, « Integrating historical, clinical and molecular genetic data in order to explain the origin and virulence of the 1918 Spanish influenza virus. », Philos Trans R Soc Lond B Biol Sci, vol. 356, no 1416, , p. 1829–39 (PMID 11779381, lire en ligne)
- (en) M Hilleman, « Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. », Vaccine, vol. 20, nos 25–26, , p. 3068–87 (PMID 12163258)
- (en) CW Potter, « A History of Influenza », J Appl Microbiol., vol. 91, no 4, , p. 572–579. (PMID 11576290)
- « Pandemic Influenza Risk Management: WHO Interim Guidance » [archive du ], sur World Health Organization, , p. 19
- Petrovski BÉ, Lumi X, Znaor L, Ivastinović D, Confalonieri F, Petrovič MG, Petrovski G, « Reorganize and survive-a recommendation for healthcare services affected by COVID-19-the ophthalmology experience », Eye, vol. 34, no 7, , p. 1177–1179 (PMID 32313170, PMCID 7169374, DOI 10.1038/s41433-020-0871-7, lire en ligne)
- (en) K Shimizu, « History of influenza epidemics and discovery of influenza virus », Nippon Rinsho, vol. 55, no 10, , p. 2505–201 (PMID 9360364)
- (en) W. Smith, C. H. Andrewes et P. P. Laidlaw, « A virus obtained from influenza patients », Lancet, vol. 2, , p. 66–68
- (en) Eyler, John M., « The Fog of Research : Influenza Vaccine Trials during the 1918–19 Pandemic », sur oxfordjournals.org, (consulté le ).
- Patrick Berche, Une Histoire Des Microbes, John Libbey Eurotext, (lire en ligne), p. 118
- (en) Joseph Stokes et col, « Results of immunization by means of active virus of human influenza », J Clin Invest, vol. 16, no 2, , p. 237–243
- (en) H Kendall, « Vaccine Innovation: Lessons from World War II », Journal of Public Health Policy, vol. 27, no 1, , p. 38–57 (lire en ligne)
- Sir Frank Macfarlane Burnet: Biography The Nobel Foundation. Consulté le 22 octobre 06
- Isaacs, A. & Lindenmann, J. Proc. R. Soc. Lond. B 147, 258–273 (1957)
- Burnet, F.M. 1937 Influenza virus on the developing egg: IV. The pathogenicity and immunizing power of egg virus for ferrets. Br. J. exp. Path. 18, 37-43.
- Site veterinaire-alliance.fr, page "La grippe humaine est contagieuse au furet", consulté le 1er novembre 2020.
- Site hopitalveterinairequebec.com, page sur la grippe du furet, consulté le 1er novembre 2020.
Voir aussi
Articles connexes
Articles divers
Grippe chez les animaux
Grippes pandémiques historiques
- Grippe de 1918 (aussi nommée « grippe espagnole ») et Pandémie de la grippe de 1918
- Grippe asiatique ou « Grippe asiatique de 1957»
- Grippe de 1968 ou grippe de Hong Kong
Grippe aviaire
- Grippe aviaire et virus H5N1
- État de l'épizootie de grippe aviaire dans l'Union européenne
- Risque pandémique lié à la grippe aviaire
- Histoire des épizooties de grippe aviaire
Grippe « porcine »
Liens externes
- Influenzanet, système de surveillance épidémiologique des syndromes grippaux à l'aide de volontaires en Europe, et son équivalent français, Grippenet.
- Réseau Sentinelles.
- Portail de la médecine
- Portail de la virologie
- Portail des maladies infectieuses