Ferroportine
La ferroportine ou ferroportine-1 appelée aussi en anglais : solute carrier family 40 member 1 (SLC40A1) ou iron-regulated transporter 1 est une protéine qui, dans l'espèce humaine, est codée par le gène SLC40A1[1].
| Solute carrier family 40 member 1 | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | SLC40A1 | |
| Synonymes | Ferroportine-1, Iron-regulated transporter 1, FPN1, HFE4, IREG1, MTP1 | |
| Locus | 2q32 | |
| Homo sapiens | ||
| Chromosome et locus | 2q32 | |
| Entrez | 30061 | |
| HUGO | 10909 | |
| OMIM | 604653 | |
| UniProt | Q9NP59 | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Structure
L'oligomérie de la ferroportine-1 ne fait pas consensus : il n'est pas encore déterminé si c'est un monomère[2], un dimère[3] ou un polymère. Chaque protomère est formé de 571 acides aminés[4], avec une histidine conservée à la position 32.
Après mutation, la protéine présente une baisse de sa capacité à transporter le fer[5].
Distribution tissulaire
La ferroportine est retrouvée à la surface de cellules qui stockent ou transportent le fer[6] :
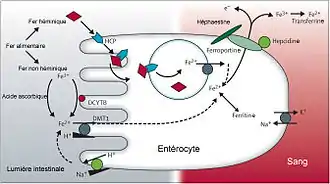
- Les entérocytes au niveau du duodénum au niveau du pôle basolatéral[7], c'est-à-dire au contact du sang circulant ;
- Les cellules de Kupffer au niveau du foie[7] ;
- Les macrophages du système réticulo-endothélial.
Rôle dans la régulation du fer
Le niveau de fer est constamment régulé suivant des mécanismes complexes, dont le centre de contrôle est l’hépatocyte, qui dispose de capteurs sensibles au niveau de fer : protéine de l'hémochromatose humaine (HFE), récepteur de la transferrine 2 (en), hémojuvéline 2 (en) (HJV). En réponse à un excès de fer circulant, l’hépatocyte produit une hormone effectrice, l’hepcidine, régulant négativement le fer[8].
L’hepcidine induite par l’excès de fer bloque celui-ci dans les macrophages et les cellules intestinales, en se liant à la ferroportine et en l'internalisant à l'intérieur des cellules[9]. Il en résulte une rétention de fer à l'intérieur des cellules et une diminution du fer circulant au niveau du plasma. Au niveau des entérocytes, le fer ainsi fixé reste lié à la ferroportine et se retrouve excrété dans les fèces évitant ainsi une élévation de la sidérémie. À l’inverse, la diminution de fer circulant entraîne une diminution de l’hepcidine et la sortie du fer cellulaire. L'hepcidine et la ferroportine jouent donc un rôle important dans le métabolisme du fer.
Ce mécanisme régule la sidérémie pour répondre aux besoins de l’hématopoïèse.
De plus, la ferroportine est régulée par le mécanisme de rétro-contrôle entre la protéine régulatrice du fer (IRP) et l'élément de réponse au fer (IRE). En situation de carence en fer, la concentration d'IRP augmente, inhibant ainsi la traduction de l'ARNm de la ferroportine. La traduction de l'ARNm est également régulée par le micro-ARN miR-485-3p[10]. Par ailleurs, l'expression de la ferroportine est régulée par le facteur de transcription HIF2α[3].
Pathologies
- Des mutations au niveau du gène SLC40A1 (chromosome 2q32) de la ferroportine provoquent des formes autosomiques dominantes très rares d'hémochromatose ou hémochromatose de type 4. Les effets de cette mutation ne sont pas graves en général mais toute une série de manifestations cliniques sont possibles en fonction du type de mutation.
- La ferroportine est aussi impliquée dans l'hémochromatose africaine (en) aussi appelée sidérose des Bantous ou sidérose bantoue[11].
- Par ailleurs, la ferroportine est une protéine importante dans la biologie du cancer du sein et un indicateur fondamental dans le pronostic de ce cancer[12],[13].
Notes et références
Notes
Références
- (en) A. Donovan, A. Brownlie, Y. Zhou, J. Shepard, S.J. Pratt, J. Moynihan, B.H. Paw, A. Drejer, B. Barut, A. Zapata, T.C. Law, C. Brugnara, S.E. Lux, G.S. Pinkus, J.L. Pinkus, P.D. Kingsley, J. Palis, M.D. Fleming, N.C. Andrews et L.I. Zon, « Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter », Nature, vol. 403, no 6771, , p. 776–781 (PMID 10693807, DOI 10.1038/35001596, résumé)
- (en) L. Cianetti, M. Gabbianelli et al., « Ferroportin and erythroid cells: an update », Adv. Hematol., vol. 2010, (DOI 10.1155/2010/404173)
- (en) D. M. Ward et J. Kaplan, « Ferroportin-mediated iron transport: expression and regulation », Biochim. Biophys. Acta, vol. 1823, no 9, , p. 1426--1433 (DOI 10.1016/j.bbamcr.2012.03.004)
- (en) Protein - NCBI, « SLC11A3 iron transporter [Homo sapiens] » (consulté le )
- (en) I.E. Zohn, I. De Domenico, A. Pollock, D.M. Ward, J.F. Goodman, X. Liang, A.J. Sanchez, L. Niswander et J. Kaplan, « The flatiron mutation in mouse ferroportin acts as a dominant negative to cause ferroportin disease », Blood, vol. 109, no 10, , p. 4174–4180 (PMID 17289807, PMCID 1885502, DOI 10.1182/blood-2007-01-066068, résumé)
- (en) A. Donovan, C.A. Lima, J.L. Pinkus, G.S. Pinkus, L.I. Zon, S. Robine et N.C. Andrews, « The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis », Cell Metab., vol. 1, no 3, , p. 191–200 (PMID 16054062, DOI 10.1016/j.cmet.2005.01.003, résumé)
- (en) François Canonne-Hergaux, Adriana Donovan, Constance Delaby, Hui-jun Wang et Philippe Gros, « Comparative studies of duodenal and macrophage ferroportin proteins », American Journal of Physiology - Gastrointestinal and Liver Physiology, vol. 290, no G156-G163, (DOI 10.1152/ajpgi.00227.2005, lire en ligne).
- (en) Enrico Rossi, « Hepcidin - the Iron Regulatory Hormone », Clin Biochem Rev., vol. 26, no 3, , p. 47–49 (lire en ligne).
- E. Nemeth, M.S. Tuttle, J. Powelson, M.B. Vaughn, A. Donovan, D.M. Ward, T. Ganz et J. Kaplan, « Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization », Science, vol. 306, no 5704, , p. 2090–2093 (PMID 15514116, DOI 10.1126/science.1104742)
- (en) Carolyn Sangokoya et Jennifer F. Doss, « Iron-Responsive miR-485-3p Regulates Cellular Iron Homeostasis by Targeting Ferroportin », PLOS genetic, vol. 9, no 4, , e1003408 (lire en ligne).
- Orphanet, « Hémochromatose africaine » (consulté le )
- (en) Z.K. Pinnix, L.D. Miller, W. Wang, R. Jr. D'Agostino, T. Kute, M.C. Willingham, H. Hatcher, L. Tesfay, G. Sui, X. Di, S.V. Torti et F.M. Torti, « Ferroportin and iron regulation in breast cancer progression and prognosis », Science translational medicine, vol. 2, no 43, , :43-56 (PMID 20686179, DOI 10.1126/scisignal.3001127, résumé)
- Pierre-Jean Lamy, Anna Durigova et William Jacot, « Iron homeostasis and anemia markers in early breast cancer », Clinica Chimica Acta; International Journal of Clinical Chemistry, vol. 434, , p. 34–40 (ISSN 1873-3492, PMID 24768787, DOI 10.1016/j.cca.2014.04.011, lire en ligne, consulté le )
Voir aussi
Bibliographie
- Patricia Aguilar Martinez, « Une nouvelle hémochromatose », sur Association Hémochromatose France, (consulté le ).
Articles connexes
Liens externes
- Portail de la biologie
- Portail de la médecine