Ester de carbonate
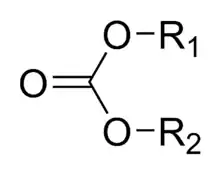
Un ester de carbonate, aussi appelé carbonate organique ou organocarbonate, est un ester de l'acide carbonique. C'est un groupe fonctionnel de structure générale R1O(C=O)OR2, formellement constitué d'un groupe carbonyle entouré par deux groupes alkoxy. Leur structure est proche de celle des esters R1O(C=O)R et des éthers R1OR2, ainsi que celle des carbonates inorganiques.
Les monomères des polycarbonates (par exemple le Lexan) sont liés par des groupes carbonate. Ces polycarbonates sont utilisés dans les lentilles optiques, les disques compacts et les verres pare-balles. Les petits esters de carbonate comme le carbonate de diméthyle, le carbonate d'éthylène ou le carbonate de propylène sont utilisés comme solvants. Le carbonate de diméthyle est aussi un agent méthylant doux.
Types
Les esters de carbonate peuvent être divisés en trois catégories selon leur structure.
La première catégorie inclut les carbonates de dialkyle ou de diaryle, c'est-à-dire les carbonate ayant deux substituants R. Les plus simples d'entre eux sont le carbonate de diméthyle et le carbonate de diphényle :
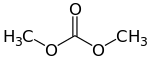 Carbonate de diméthyle
Carbonate de diméthyle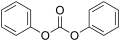 Carbonate de diphényle
Carbonate de diphényle
La deuxième catégorie contient les esters de carbonate dont les deux substituants ne sont pas des alkyles ou des aryles terminaux, mais des groupes aliphatiques ou aromatiques bifonctionnels. On peut citer parmi eux par exemple le poly(carbonate de propylène) ou le poly(carbonate de bisphénol A) (Lexan) :
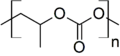 poly(carbonate de propylène)
poly(carbonate de propylène)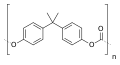 poly(carbonate de bisphénol A) (Lexan)
poly(carbonate de bisphénol A) (Lexan)
La dernière catégorie regroupe les esters de carbonate dont les deux groupes sont reliés par des ponts à deux ou trois atomes de carbone, comme le carbonate d'éthylène et le carbonate de triméthylène ; des substituants, par exemple CH3 pour le carbonate de propylène, sont également possibles :
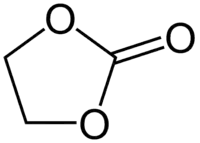 Carbonate d'éthylène
Carbonate d'éthylène Carbonate de triméthylène
Carbonate de triméthylène
Synthèse
Il existe deux façons principales de préparer des esters de carbonate : la réaction entre un alcool (ou un phénol) et le phosgène (phosgénation), et la réaction entre un alcool, le monoxyde de carbone et un oxydant (carbonylation oxydante). D'autres esters de carbonates peuvent ensuite être préparés par transestérification[1],[2].
Phosgénation
Les alcools réagissent avec le phosgène pour former un ester de carbonate selon la réaction suivante :
- 2 ROH + COCl2 → ROCO2R + 2 HCl
Les phénols réagissent de façon similaire, les polycarbonates de bisphénol A étant produits de cette manière. Cette réaction possède un très bon rendement. Cependant, le phosgène utilisé est toxique, et on ajoute en général une quantité stœchiométrique de base (par exemple de la pyridine) pour neutraliser le chlorure d'hydrogène formé. Ce processus n'est pas souhaitable en conséquence[1] ,[2].
Les esters de chloroformate sont des intermédiaires dans cette réaction. Plutôt que de réagir à nouveau avec un alcool, ils peuvent se dismuter pour donner le diester de carbonate désiré et un équivalent de phosgène. dans ces conditions, la réaction nécessite moitié moins de phosgène et de base, et donc produit moitié moins de sels perdus[2] :
- PhOH + COCl2 → PhOCOCl + HCl
- 2 PhOCOCl → PhOCO2Ph + COCl2
Carbonylation oxydante
Avec un catalyseur approprié, les alcools peuvent réagir avec le monoxyde de carbone et un oxydant (par exemple le dioxygène)[1],[2] :
- 2 CH3OH + CO + [O] → CH3OCO2CH3 + H2O
Réaction du dioxyde de carbone avec les époxydes
La réaction du dioxyde de carbone avec les époxydes est une façon de préparer les esters de carbonate cycliques à cinq atomes. La production annuelle de ce genre de carbonates cycliques est estimée à 100 000 tonnes par an, en 2010[3]. Industriellement, les oxydes d'éthylène et de propylène réagissent rapidement avec le dioxyde de carbone pour donner des carbonates d'éthylène et de propylène (avec le catalyseur approprié)[1],[2]. Par exemple :
- C2H4O + CO2 → C2H4O2CO
Transestérification de carbonate
Une fois le carbonate initial produit, il peut être converti en d'autres carbonates par transestérification. Un alcool plus nucléophile va pourvoir se substituer à un alcool moins nucléophile. Il est par exemple possible de remplacer un phénol d'un carbonate d'aryle par un alcool aliphatique. Si l'alcool initial est aussi plus volatil, il est possible de déplacer l'équilibre en le distillant[1],[2].
Synthèse en laboratoire
En laboratoire, les principales méthodes utilisées pour la synthèse d'esters de carbonates sont :
- à partir des diols correspondants ;
- par double oxydation des cétones dans un réarrangement de Baeyer-Villiger ;
- par réaction entre un époxyde avec le dioxyde de carbone, réaction catalysée par un halogénure de zinc[4].
Utilisation
Solvant
Un grand nombre de carbonates organiques sont utilisés comme solvants[5]. Ils sont classés comme solvants polaires, avec une large gamme de température où ils sont liquides. Par exemple, le carbonate de propylène à un point de fusion de −55 °C et un point d'ébullition de 240 °C. Ils présentent aussi les avantages d'une faible écotoxicité et d'une bonne biodégradabilité. Cependant, la production industrielle des carbonates n'est pas verte, car la production de carbonates linéaire reposent sur le phosgène, un polluant particulièrement toxique, et celle des carbonates cycliques sur l'oxyde de propylène, un agent cancérigène.
Batteries
Les carbonates organiques sont utilisés comme solvants dans les batteries au lithium ; du fait de leur haute polarité, ils peuvent dissoudre les sels de lithium. Le problème de leur viscosité élevée est en général contourné en utilisant des mélanges de carbonates, par exemple des mélanges de carbonate de diméthyle, de carbonate de diéthyle et de diméthoxyéthane.
Notes et références
- Abbas-Alli G. Shaikh, « Organic Carbonates », Chemical Reviews, vol. 96, no 3, , p. 951–976 (PMID 11848777, DOI 10.1021/cr950067i)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a05_197)
- Michael North, Riccardo Pasquale et Carl Young, « Synthesis of cyclic carbonates from epoxides and CO2 », Green Chem., vol. 12, no 9, , p. 1514 (DOI 10.1039/c0gc00065e)
- Zinc(II)-pyridine-2-carboxylate / 1-methyl-imidazole: a binary catalytic system for in the synthesis of cyclic carbonates from carbon dioxide and epoxides Arkivoc 2007 (iii) 151-163 (EA-2262DP) Thomas A. Zevaco, Annette Janssen, and Eckhard Dinjus Link
- DOI:10.1021/cr900393d
- Portail de la chimie