Doxorubicine
La doxorubicine, ou hydroxydaunorubicine, également connue sous le nom commercial d’Adriamycin, est un médicament anticancéreux utilisé dans la chimiothérapie du cancer.
| Doxorubicine | |
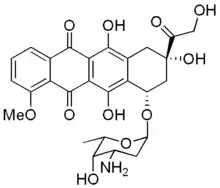
| |
| structure chimique de la doxorubicine | |
| Identification | |
|---|---|
| Nom UICPA | (8S,10S)-10-(4-amino-5-hydroxy-6-méthyl-tétrahydro-2H-pyran-2-yloxy)-6,8,11-trihydroxy-8-(2-hydroxyacétyl)-1-méthoxy-7,8,9,10-tétrahydrotétracène-5,12-dione |
| No CAS | |
| No ECHA | 100.041.344 |
| No CE | 245-495-6 |
| Code ATC | L01 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C27H29NO11 [Isomères] |
| Masse molaire[1] | 543,5193 ± 0,0271 g/mol C 59,66 %, H 5,38 %, N 2,58 %, O 32,38 %, |
| Précautions | |
| Classification du CIRC | |
| Groupe 2A : Probablement cancérogène pour l'homme[2] | |
| Données pharmacocinétiques | |
| Biodisponibilité | (voie orale) - 5 % |
| Considérations thérapeutiques | |
| Voie d’administration | intraveineuse |
| Unités du SI et CNTP, sauf indication contraire. | |
Cette molécule appartient à la famille des anthracyclines et est produite par des bactéries du genre Streptomyces. Au sein des molécules utilisées en chimiothérapie, elle fait partie des antibiotiques antinéoplasiques.
Comme les autres anthracyclines, il s'agit d'un agent intercalant qui entre dans l'espace entre les paires de bases de l'ADN. De plus, ces molécules sont des inhibiteurs des ADN topoisomérases de type II, enzymes impliquées dans le maintien de la structure tridimensionnelle de l'ADN lors des phénomènes de transcription et de réplication. Les complexes brins d'ADN/topoisomérase seront stabilisés empêchant ainsi la réplication de l'ADN.
Historique
En 1963, deux groupes de scientifiques français travaillant chez Rhône-Poulenc à Vitry-sur-Seine et italiens travaillant à Milan chez Farmitalia, entreprise paritaire entre Montecatini et Rhône-Poulenc, isolent indépendamment à partir de deux souches différentes de Streptomyces (cerulorubidus et peucetius) la rubidomycine A nommée rubidomycine par les français en raison de sa couleur rubis et daunomycine par les italiens, noms fusionnés ensuite en 1968 en daunorubicine. En 1980, est brevetée la synthèse de doxorubicine à partir de la daunorubicine[3].
| doxorubicine | |
| Noms commerciaux |
|
|---|---|
| Laboratoire | Accord Healthcare, Acino Pharma, Actavis, Cephalon, Ebewe, Eurogenerics (EG), G Gam, Hospira, Janssen-Cilag, Novopharm, Pfizer, Pharmintraco, Sandoz, Sopherion, Teva |
| Sels | chlorhydrate |
| Forme | lyophylisat pour préparation pour perfusion, liposomes pour perfusion |
| Classe | Antinéoplasiques, antibiotiques cytotoxiques et apparentés, anthracyclines et apparentés, ATC code L01DB01 |
| Autres informations | non disponible en ville : prescription hospitalière, réservée aux spécialistes et services cancérologie ou hématologie, ou oncologie médicale |
| Remboursement |
|
| Identification | |
| No CAS | |
| No ECHA | 100.041.344 |
| Code ATC | L01DB01 |
| DrugBank | 00997 |
Mécanisme d'action et devenir dans l'organisme
Mécanisme d'action
La doxorubicine, comme toutes les anthracyclines, peut s'intercaler entre deux paires de bases d'ADN, préférentiellement entre deux bases G-C à la suite de la formation de liaisons hydrogène spécifiques entre la doxorubicine et la guanine.
Pharmacocinétique
La courbe d'élimination plasmatique du produit est triphasique avec une phase initiale rapide, d'une demi-vie d'environ 5 minutes et une phase terminale lente, d'une demi-vie d'environ 36 heures. La doxorubicine est éliminée essentiellement par l'excrétion biliaire sous forme de produit inchangé et de métabolites (40 à 50 % de la dose en 7 jours). L'excrétion urinaire est négligeable (environ 10 % de la dose, principalement sous forme de produit inchangé).
La glycoprotéine P diminue l'activité de la doxorubicine en la sortant activement des cellules tumorales.
Indications, posologies et informations pratiques
Les indications des anthracyclines sont principalement les leucémies et les lymphomes. La doxorubicine est également utilisée dans le traitement des sarcomes osseux (ostéosarcome et sarcome d'Ewing) en association avec d'autres drogues anti-néoplasiques.
Indications
La doxorubicine est utilisée dans le/les :
- carcinomes du sein ;
- sarcomes des os et des parties molles ;
- lymphome de Hodgkin, lymphomes non hodgkiniens ;
- tumeurs solides de l'enfant ;
- cancers du poumon ;
- leucémies aiguës et chroniques ;
- cancers de la vessie, de l'ovaire, de l'estomac.
Posologie
La posologie moyenne est de 40 à 75 mg·m-2 par cycle.
Chaque cycle est séparé du précédent par un intervalle de trois à quatre semaines. Les cycles sont répétés jusqu'à une dose totale maximale de 550 mg·m-2.
Informations pratiques
On administre la dose de doxorubicine en 3 à 5 minutes minimum dans la tubulure d'une perfusion intraveineuse de solution de chlorure de sodium isotonique ou de solution de glucose à 5 % :
- soit en une seule fois ;
- soit en 2 fois au cours de la journée ;
- soit répartie sur 2 ou 3 jours.
Il n'est pas nécessaire de procéder à une longue perfusion, celle-ci pouvant être installée peu de temps avant l'administration de la doxorubicine et arrêtée quelques minutes après.
Contre-indications, précautions d'emploi et effets indésirables
Contre-indications
Ce médicament est contre-indiqué dans les situations suivantes :
- grossesse et allaitement ;
- toxicité cardiaque induite par une autre anthracycline ou doses cumulées maximales obtenues pour une autre anthracycline ;
- association avec le vaccin contre la fièvre jaune.
Ce médicament est généralement déconseillé :
- chez les sujets présentant une cardiopathie avec insuffisance cardiaque avérée. L'insuffisance coronarienne n'est pas une contre-indication si elle est contrôlée et ne se complique pas d'une altération franche de la fonction ventriculaire gauche ;
- en association avec :
- les vaccins vivants atténués,
- la phénytoïne ou la fosphénytoïne.
Précautions d'emploi
Il est indispensable de diminuer les doses chez les sujets présentant une insuffisance hépatique sévère (bilirubine ou transaminases élevées) : chez ces sujets, en effet, les taux sanguins de doxorubicine et la demi-vie plasmatique de ce produit sont augmentés, d'où une majoration des effets secondaires (administrer alors 15 à 30 mg·m-2 toutes les quatre semaines).
L'administration de la dose en une injection réduit considérablement l'incidence des stomatites.
L'espacement des cycles par un intervalle de trois ou quatre semaines permet la réparation des cellules sanguines et des cellules immuno-compétentes.
Le respect de la dose totale maximale de 550 mg·m-2 limite l'apparition de la myocardite congestive.
Il est évident qu'il faut néanmoins surveiller avant chaque cycle, la numération formule sanguine et effectuer régulièrement un examen cardiaque avec examen clinique, échographie et/ou ventriculographie isotopique surtout en cas de radiothérapie thoracique.
La cytolyse entraîne une hyperuricémie qu'il convient de surveiller et de prévenir.
Effets indésirables
Elle constitue l'une des quatre molécules du protocole CHOP, mais du fait de sa cardiotoxicité, elle n'est pas utilisée chez les sujets ayant des antécédents cardiaques :
- toxicité cardiaque aiguë : survenant dans les 48 heures, des troubles à l'ECG peuvent apparaître, le plus souvent sans traduction clinique ;
- toxicité cardiaque chronique : liée à la dose cumulée administrée (si dose supérieure à 550 mg·m-2, pouvant évoluer vers l'insuffisance cardiaque congestive) ;
- insuffisance médullaire (neutropénies, anémies, thrombopénies) ;
- syndromes myélodysplasiques et des leucémies aiguës myéloïdes secondaires au traitement (incidence plus élevée qu'attendue si association avec des inhibiteurs de topoisomérase II de leucémies de type LAM 2, LAM 3, LAM 4 après une latence de 1 à 3 ans) ;
- extravasation avec risque de nécrose ;
- alopécie (90 % des cas), réversible à l’arrêt du traitement ;
- nausées, vomissements, stomatites ;
- aménorrhée, azoospermie ;
- coloration rougeâtre des urines pendant 48 heures.
Galénique et dénominations commerciales
La forme classique de doxorubicine porte le nom commercial d'Adriamycin.
Formule liposomale
Le Doxil est de la doxorubicine liposomale encapsulée et pégylée, produite par le laboratoire Ben Venue aux États-Unis.
Le Myocet est de la doxorubicine liposomale non pégylée, produite par Enzon Pharmaceuticals pour Cephalon.
Chimie
La solution de doxorubicine est transparente et rouge. De plus, cette molécule possède des propriétés fluorescentes (excitation autour de 480 nm/vert - émission autour de 595 nm/jaune)[4]. Grâce à ces propriétés colorimétriques, la doxorubicine est un très bon modèle de molécule thérapeutique pour la recherche. En effet, la couleur rouge permet d'évaluer la concentration de la molécule diluée en solution par spectrophotométrie UV (aussi possible par fluorescence). La fluorescence quant à elle permet de déterminer la localisation de la molécule dans des cellules vivantes par exemple par microscopie de fluorescence.
Synthèse
Elle est réalisée à partir de la daunorubicine.
Divers
Elle fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[5].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2A : Probablement cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- Arcamone F, Penco S. & Vicario GP. (1980). US Patent no 4,211,864. Washington, DC: U.S. Patent and Trademark Office. sur worldwide.espacenet.com
- (en) Karukstis KK, Thompson EH, Whiles JA, Rosenfeld RJ, « Deciphering the fluorescence signature of daunomycin and doxorubicin », Biophysical Chemistry, vol. 73, no 3, , p. 249-263. (PMID 9700924)
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013
Liens externes
- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Doxorubicine
- Page spécifique sur le Répertoire Commenté des Médicaments, par le Centre belge d'information pharmacothérapeutique
- Page spécifique sur le Vidal.fr
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie