Diiode
Le diiode (symbole I2) est une molécule composée de deux atomes d'iode liés entre eux. Dans les conditions normales de température et de pression, le diiode est à l'état solide, il passe directement de l'état solide à l'état gazeux par sublimation. C'est un produit irritant qui doit être manipulé avec précaution.
Ne doit pas être confondu avec Diode.
Cet article concerne le corps simple I2. Pour l'élément chimique, voir Iode.
| Diiode | ||
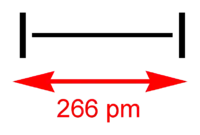
| ||
 | ||
| Structure et apparence (à l'état solide) du diiode. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | diiode | |
| No CAS | ||
| No ECHA | 100.028.585 | |
| No CE | 231-442-4 | |
| Apparence | cristaux noirs à bleuâtres ou pourpre foncé, d'odeur acre[1] | |
| Propriétés chimiques | ||
| Formule | I2 [Isomères] |
|
| Masse molaire[2] | 253,80894 ± 0 g/mol I 100 %, |
|
| Propriétés physiques | ||
| T° fusion | 113,7 °C[3] | |
| T° ébullition | 184,4 °C[3] | |
| Solubilité | 330 mg·l-1 (eau à 25 °C)[3] ; librement sol. dans les solutions aq. de HI ou iodures ; |
|
| Masse volumique | 4,93 g·cm-3 (solide, 20 °C)[3] ; 3,960 g·cm-3 (liquide, 120 °C)[4]. |
|
| Pression de vapeur saturante | à 25 °C : 0,04 kPa[1] | |
| Point critique | 545,85 °C[5] ; 11,6 MPa[3] | |
| Thermochimie | ||
| ΔfusH° | 15,52 kJ·mol-1[3] | |
| ΔvapH° | 164,45 J·g-1[3] | |
| Cristallographie | ||
| Symbole de Pearson | [6] | |
| Classe cristalline ou groupe d’espace | Cmca (no 64)[6] | |
| Strukturbericht | A14[6] | |
| Précautions | ||
| SGH[7] | ||
  Attention |
||
| SIMDUT[8] | ||
  D2A, E, |
||
| Écotoxicologie | ||
| LogP | 2,49[3] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Le diiode est l'oxydant du couple I2 / I-. C'est d'ailleurs le couple mis en jeu lors de sa réaction (violente) avec l'aluminium ou le potassium. Ce couple permet aussi de fabriquer du diiode à partir d'un oxydant et de l'ion iodure.
En dissolvant du diiode et de l'iodure de potassium dans l'eau, on obtient la solution de lugol (eau iodée). Cette solution contient des ions polyiodure dont le plus simple est le triiodure I3-.
En dissolvant du diiode dans l'éthanol, on obtient de la teinture d'iode qui est un antiseptique. Il permet en outre de mettre en évidence l'amidon. En effet, la teinture d'iode forme un complexe bleu foncé avec l'amidon. De façon générale, les solutions de diiode dans un solvant oxygéné sont brunes et celles dans un solvant non oxygéné sont de couleur violette. Cette mise en évidence peut aussi être effectuée en mettant le composé à marquer en contact avec du diiode gazeux[9].
Images
 Échantillon de diiode. |
 Réseau 3D éclaté. |
 Réseau 3D. |
Références
- IODE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Iodine, elemental » dans la base de données Hazardous Substances Data Bank, consulté le 5 mai 2010
- (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman et Susan Budavari, The Merck Index : An Encyclopedia of Chemicals, Drugs and Biologicals, 13e éd., Whitehouse Station (N.J.), Merck, , 2564 p. (ISBN 0-911910-13-1), partie 5036
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- « The Molecular Iodine (I2) Crystal Structure (A14) », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Iode » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Alan Boyde et al., Iodine Vapor Staining for Atomic Number Contrast in Backscattered Electron and X-Ray Imaging, MICROSCOPY RESEARCH AND TECHNIQUE 77:1044–1051 (2014)
- Portail de la chimie