Cycle de l'oxygène
Le cycle de l'oxygène est un cycle biogéochimique qui permet d'expliquer les transformations de l'oxygène dans la biosphère terrestre entre ses différents degrés d'oxydation, en ions, oxides et molécules à travers diverses réactions rédox, dans et entre les réservoirs de la planète Terre[1].
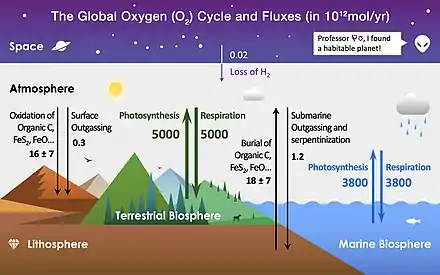
L'oxygène est l'un des éléments les plus abondants sur Terre et représente une grande partie de chaque réservoir principal. Les processus du cycle de l'oxygène sont considérés comme biologique ou géologique et sont évalués en tant que « source » (production) ou « puits » (consommation) de O2[1],[2].
Ce cycle est indissociable du cycle du carbone puisque celui-ci s'effectue grâce au dioxyde de carbone utilisé lors de la photosynthèse. Cette dernière produit du dioxygène, qui, par le biais de la respiration, brûle les composants carbonés produits par la photosynthèse pour redonner du dioxyde de carbone. En dernière analyse, photosynthèse et respiration sont à l'origine de la production et de l'équilibre des gaz atmosphériques. Les deux mécanismes -CO2 + H2O → sucres + dioxygène et vice versa - conditionnent la circulation du carbone et de l'oxygène.
Les réservoirs d'oxygène
Lithosphère
La lithosphère est de loin le plus grand réservoir d'oxygène de la Terre, et contient près de 99,5% du total.
L'oxygène n'est pas significativement présent dans le noyau terrestre. Il se trouve dans la croûte et le manteau, dont il représente 46,6 % du poids, sous forme de silicates et d'autres oxydes[3].
Hydrosphère
L'hydrosphère est essentiellement composée de molécules d'eau H2O, généralement sous forme liquide, et donc de 33% d'oxygène en nombre de moles. C'est le second plus grand réservoir d'oxygène. La masse totale de l'hydrosphère est estimée à 1 386 × 1021 g, dont l'oxygène représente les 16/18e soit 1 232 × 1021 g ou 77 000 × 1018 mol.
L'oxygène y est également présent sous forme de molécules dissoutes, dont principalement l'oxygène libre et les acides carboniques (HxC3).
Atmosphère
Après la croûte, le manteau et l'hydrosphère, l'atmosphère représente 34[2] à 37 × 1018 mol d'O2[4].
L'atmosphère est composée à ~ 20,9 % d'oxygène, essentiellement sous forme de O2 — l'atmosphère représente à elle seule 98% de l'oxygène disponible sous forme libre. Dans la littérature, le terme « oxygène » dans ce contexte fait généralement référence aux plus communs allotropes de l'oxygène, l'oxygène élémentaire diatomique (O2), car il constitue le produit ou réactif de nombreuses réactions biogéochimiques rédox au cours du cycle[2].
L'oxygène entre en composition d'autres composés chimiques présent dans l'atmosphère, en particulier la vapeur d'eau H2O, mais également le dioxyde de carbone CO2, et des oxydes de souffre et d'azote (SO2, NO, N2O, etc.).
Biosphère
La biosphère contient de l'oxygène sous forme de molécules organiques (CxHxNxOx) et de molécules d'eau. L'oxygène ainsi fixé représente de l'ordre de 10 × 1018 g ou 0,6 × 1018 mol d'oxygène.
Bien que présente de manière très marginale en termes de masse, la biosphère constitue un facteur essentiel du cycle de l'oxygène. C'est initialement la photosynthèse qui a libéré de l'O2 gazeux dans l'atmosphère, pour former de la matière organique (ici, du sucre) en réduisant le gaz carbonique originel (voir cycle du carbone) :
- 6 CO2 + 6 H2O → C6H12O6 + 6 O2↑
Cependant, cette élaboration de base est généralement compensée par la respiration cellulaire, qui revient globalement à inverser le processus : pour fournir l'énergie nécessaire au métabolisme, de la matière organique est oxydée, consommant de l'oxygène O2 et restituant essentiellement du gaz carbonique CO2 et de l'eau, pour un bilan globalement neutre. Une fois que l'organisme est mort, la matière organique restante peut également servir de source d'énergie à des prédateurs externes, à des charognards, des organismes nécrophages divers, le microbiotope, et est généralement recyclée, ne sortant donc pas du cycle biologique.
Pour que la biosphère puisse être productrice nette d'oxygène gazeux, il faut que la matière organique reste d'une manière ou d'une autre « piégée », et ne soit pas digérée dans la biosphère.
D'autre part, l'oxygène O2 est un composant indispensable du cycle de l'azote : dans les cycles actuels, la nitratation de l'azote en nitrates NO3– passe par la consommation d'une molécule d'O2. Les composés nitrés dans la biosphère peuvent ensuite être recyclés, mais également enfouis sous forme de roches nitratées, ou faire l'objet d'une dénitrification par des formes bactériennes qui réduisent le nitrate à une forme gazeuse, l'oxygène étant éliminé sous forme d'eau. Pour que l'oxygène reste présent dans l'atmosphère, il faut donc que les combinés nitrés soient recyclés, et non enfouis ou dénitrifiés.
En amont, à travers la fixation biologique de l'azote réalisée par certaines cyanobactéries, l’inhibition de la nitrogénase par l'O2, que ce soit directement ou indirectement via des radicaux oxydants, constitue un régulateur fort de la teneur en oxygène dans l'atmosphère, par la rétroaction négative qu'il a sur la fixation de l'azote[5]. Une inhibition dans la fixation de l'azote conduirait à une chute de la productivité primaire, à la fois directement pour les cyanobactéries diazotrophes et indirectement pour l'ensemble de la productivité primaire de l'hydrosphère, induisant à plus long terme, pour le cycle du carbone, une réduction dans le rythme d'enfouissement du carbone organique. Sans enfouissement il n'y a pas de création nette d'O2 par la biosphère, et l'oxygène en excès espèce très réactive, disparaît progressivement par l'oxydation de la surface de la planète.
Construction biologique de l'atmosphère oxygénée
Réactivité de l'oxygène
La réactivité de l'oxygène se traduit par de nombreuses réactions de transfert d'électrons (rédox) conduisant à des produits très stables, tels que H2O, CO2, HNO3, H2SO4 et H3PO4. Les réactions de l'oxygène avec les autres éléments légers abondants dégagent presque toujours de l'énergie, ce qui signifie que, contrairement à l'azote N2, sans source continue, l'oxygène moléculaire libre serait épuisé de l'atmosphère terrestre d'ici quelques millions d'années.[6]
Fixation du carbone et libération de l'oxygène
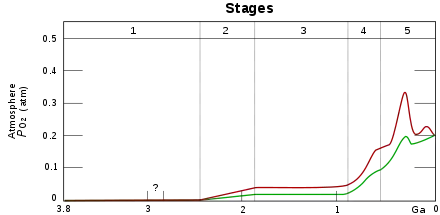
Une production nette d'oxygène par la biosphère demande qu'une partie de la matière organique soit sortie du cycle biologique et immobilisée. D'une manière continue, des composés organiques sédimentent régulièrement dans des milieux anaérobique, où ils peuvent être enfouis sans être décomposés. L'enfouissement de matières carbonées est alors équilibrée par la libération d'oxygène gazeux qui avait été nécessaire à leur création. Celui-ci se répand dans l'atmosphère et l'hydrosphère, et est susceptible d'oxyder les éléments présents.
D'autre part, ce relargage d'O2 ne peut subsister dans l'atmosphère que s'il ne rencontre pas de molécules présentant un potentiel d'oxydation élevé, et susceptible de capturer cet O2 libéré.
Dans le contexte primitif, l'oxygène réagissait initialement avec les composés de l'océan, principalement avec les métaux comme le fer ferreux, pour précipiter en hématite et magnétite, ce qui capturait l'oxygène et limitait les possibilités de vie à la prolifération des seuls organismes anaérobies. Le dégazement d'oxygène était alors un déchet du cycle, poison pour les organismes anaérobiques. La production anaérobie produit de l'oxygène, et cette production détruit la production anaérobie. S'ensuit un cycle d'instabilité : la mort des organismes anaérobies consomme et fixe de l'O2 et en réduit la teneur ; mais la disparition du poison permet aux organismes anaérobiques de proliférer à nouveau, déclenchant les conditions de leur nouvelle disparition. Cette instabilité se traduit dans les dépôts par des dépôts de fer rubané, alternativement noirs et rouges.
De ce fait, l'oxygène libre n'existait pas dans l'atmosphère jusqu'à il y a environ 2 400 Ma, lorsque, au Paléoprotérozoïque, la plus grande partie de ces formes réduites du fer furent oxydées. Avec la précipitation des composés ferreux, l'équilibre chimique de la dissolution du fer se déplaçait à la suite de la réduction de la concentration en fer ; et l'augmentation concomitante de la concentration de O2 dans l'océan, par suite de la photosynthèse, en a progressivement fait un milieu oxydant, alors qu'il était initialement réducteur. Après l'épuisement du fer ferreux marin, la teneur en O2 a progressé, dans les océans d'abord, dans l'atmosphère ensuite. C'est ce que l'on appelle la Grande Oxydation ou catastrophe de l'oxygène.
La transition ne prend fin qu'avec l'apparition de cellules capables de vivre dans un environnement oxygéné. Apparaissent alors, sur le plan géologique, des dépôts rouges, marquage de fer ferrique, et les roches sédimentaires passent d'une dominante noire au rouge. Ces couches sédimentaires rouges impliquent que l'atmosphère et les eaux de surface sont devenues oxygénées[2]
Épisode carbonifère
Quand la matière organique formée est indigeste, donc « non biodégradable », elle s'accumule et sédimente sans pouvoir être consommée par le microbiotope. Historiquement, c'est probablement ce qui a conduit à l'ère carbonifère.
On a en effet émis l’hypothèse que l’enfouissement de grandes quantités de bois est dû au fait que les bactéries et les animaux n’étaient pas encore assez évolués pour être capables de décomposer les nouveaux ligneux apparaissant à cette époque. La lignine est difficile à décomposer, et était présente en très forte proportion dans les plantes du carbonifère. La lignine n’est pas soluble, elle peut rester dans le sol pendant des centaines d’années et inhiber la décomposition d’autres substances végétales[7]. L’enfouissement massif de carbone qui en a résulté a pu conduire à un surplus d’oxygène dans l’air allant jusqu’à 35 %[8], mais des modèles révisés considèrent ce chiffre comme irréaliste et estiment que le pourcentage d’oxygène dans l’air devait se situer entre 15 et 25 %[9].
Le charbon a arrêté de se former il y a près de 290 millions d'années (fin du carbonifère). Cet arrêt de formation du charbon semble pouvoir être expliqué par l'apparition de nouvelles espèces de champignons capables de dégrader la totalité de la lignine grâce à des enzymes (les lignine-peroxydases)[10].
Impact anthropique
Ozone
Ce cycle permet d'expliquer le phénomène de l'apparition de l'ozone. L'utilisation d'automobiles dégage du dioxyde d'azote (NO2). Celui-ci, par décomposition puis recomposition avec le dioxygène ambiant (O2) forme de l'ozone (O3). Or, cet ozone est néfaste à la santé et est même considéré comme un polluant. Cependant dans la haute atmosphère l'ozone forme une couche qui est indispensable, en effet elle agit comme un filtre vis-à-vis des UV émis par le soleil.
- NO2 → NO + O
- O+O2 → O3
Notes et références
- (en) Andrew H Knoll, Donald E Canfield et Kurt Konhauser, Fundamentals of geobiology, Chichester, West Sussex, John Wiley & Sons ., , 93–104 p. (ISBN 978-1-118-28087-4, OCLC 793103985), « 7 »
- Petsch ST, Treatise on Geochemistry, Elsevier, , 9144 p. (ISBN 978-0-08-098300-4, DOI 10.1016/b978-0-08-095975-7.00811-1, lire en ligne), « The Global Oxygen Cycle »
- Falkowski PG, Godfrey LV, « Electrons, life and the evolution of Earth's oxygen cycle », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 363, no 1504, , p. 2705–16 (PMID 18487127, PMCID 2606772, DOI 10.1098/rstb.2008.0054)
- (en) William S. Reeburgh, « Figures Summarizing the Global Cycles of Biogeochemically Important Elements », sur studentportalen.uu.se.
- Feedbacks Between the Nitrogen, Carbon and Oxygen Cycles. Ilana Berman-Frank et al. In Nitrogen in the Marine Environment, 2008, Elsevier.
- Electrons, life and the evolution of Earth's oxygen cycle. Paul G Falkowski, Linda V Godfrey. Philos Trans R Soc Lond B Biol Sci. 2008 Aug 27; 363(1504).
- (en) Jennifer M. Robinson, « Lignin, land plants, and fungi: Biological evolution affecting Phanerozoic oxygen balance », Geology, vol. 18, no 7, , p. 607-610 (DOI 10.1130/0091-7613(1990)018<0607:LLPAFB>2.3.CO;2, résumé).
- (en) Robert A. Berner, « Atmospheric oxygen over Phanerozoic time », PNAS, vol. 96, no 20, , p. 10955-10957 (lire en ligne).
- (en) Timothy M. Lenton, « The role of land plants, phosphorus weathering and fire in the rise and regulation of atmospheric oxygen », Global Change Biology, vol. 7, no 6, , p. 613-629 (DOI 10.1046/j.1354-1013.2001.00429.x).
- D Floudas et al. The Paleozoic Origin of Enzymatic Lignin Decomposition Reconstructed from 31 Fungal Genomes Science, 336, 1715, 2012 (résumé)
Liens externes
- Portail de la biologie
- Portail de la chimie
- Portail de la biologie cellulaire et moléculaire
- Portail de l’environnement
- Portail de l’écologie
- Portail des sciences