Cinétique enzymatique
La cinétique enzymatique a pour objet d'identifier et de décrire les mécanismes des réactions biochimiques, catalysées par les enzymes (réaction enzymatique), en étudiant leur vitesse c'est-à-dire leur évolution en fonction du temps. En partant des enzymes isolées et en allant vers les systèmes métaboliques organisés et intégrés, la cinétique enzymatique permet de décrire quantitativement les propriétés catalytiques des enzymes et les mécanismes mis en place pour leur régulation.
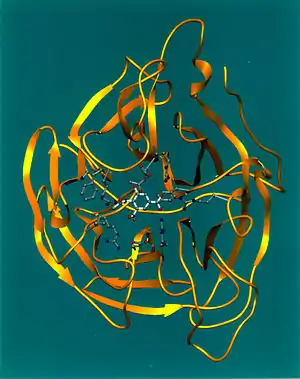
Les enzymes jouent un rôle central dans la régulation des processus biologiques. Elles sont généralement constituées de molécules protéiques issues de la traduction du génome, à l'exception des ribozymes constitués d'ARN. Les enzymes interviennent en diminuant la barrière énergétique entre les réactants permettant d'accélérer les réactions des milliers de fois plus qu'en absence de catalyse.
L'activité catalytique des enzymes est hautement spécifique, c'est-à-dire qu'une enzyme donnée, parmi les milliers qui existent, ne peut catalyser qu'une réaction chimique bien précise (p. ex. l'hexokinase permet à l'aide d'une molécule d'ATP de phosphoryler le glucose pour obtenir le glucose-6-phosphate substrat clé dans la glycolyse et la synthèse du glycogène). En effet, la réaction chimique catalysée par une enzyme s'effectue au niveau d'une région bien déterminée de celle-ci, appelée site actif. Dans ce domaine, les acides aminés adoptent une configuration spatiale précise qui confère à cette région des caractéristiques chimiques spéciales rendant compte de cette spécificité vis-à-vis du substrat (voir figure ci-contre).
Il existe une relation entre la vitesse d'une réaction catalysée par une enzyme et la concentration ou la disponibilité du substrat. L'activité enzymatique dépend aussi du pH, de la température et souvent de la concentration des ions et des cofacteurs. La régulation de cette activité peut être assurée par des composés appelés effecteurs (généralement de faible poids moléculaire). Les effecteurs positifs (ou activateurs) stabilisent la configuration catalytique active de l'enzyme. Les effecteurs négatifs (ou inhibiteurs), agissent au contraire, en favorisant l'état moins actif (inhibiteurs non compétitifs) ou entrent en compétition avec les molécules de substrat en bloquant le site actif (inhibiteurs compétitifs).
La cinétique enzymatique constitue un élément fondamental dans la compréhension de la manière dont les enzymes fonctionnent et conduit à de nombreuses applications dans les industries chimique et agroalimentaire ainsi que dans les biotechnologies et la médecine (pharmacologie, toxicologie).
Considérations générales
Dans une réaction chimique, des réactifs se transforment en produits. Cette réaction fait évoluer le système vers l'état d'équilibre. Un catalyseur est une molécule qui accélère la vitesse de la réaction, sans changer la direction de cette réaction ni l'état d'équilibre. Dans le cas particulier où le catalyseur est une enzyme, les réactifs portent le nom de "substrats". Certaines enzymes peuvent catalyser la réaction dans les deux sens.
Comme tous les catalyseurs, une enzyme accélère une réaction en diminuant son énergie d'activation. La participation de l'enzyme dans la réaction modifie son mécanisme précis (en quelque sorte elle modifie le chemin pris par les réactifs).
Comment l'enzyme diminue l'énergie d'activation ?
L'enzyme, lors de son interaction avec le substrat, modifie la réactivité moléculaire en formant un complexe enzyme-substrat, elle forme un état intermédiaire. Il existe en effet au sein de ces structures en 3D que sont les enzymes des sites de fixation où le substrat se fixe et des sites de réaction (ou catalyse) où la réaction est facilitée. Ces sites sont constitués de radicaux d'acides aminés formant la chaine protéique de l'enzyme. Ces acides aminés rapprochés grâce au repliement dans l'espace de la chaine protéique forment le site actif, il peut être activé par des ions magnésiums par exemple. Donc, l'enzyme facilite la réaction du substrat en diminuant l'énergie d'activation, ceci en passant par un ou plusieurs états intermédiaires.
Modèles de la cinétique enzymatique
Modèle de Michaelis-Menten
On part de la réaction
On fait l'hypothèse d'un état quasi stationnaire (AEQS pour Approximation de l'État Quasi Stationnaire) sur l'espèce ES : ES étant instable, on suppose qu'elle disparait aussi vite qu'elle apparait.
Si est la vitesse de la réaction,
(cf cours de chimie)
donc et en remplaçant [ES]
Si on fait un bilan de matière sur E
, où est la quantité initiale d'enzyme
et en remplaçant E,
Si on définit et
On a
Cinétique à un substrat
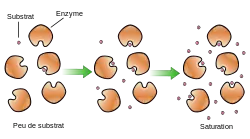
Soit A le substrat, P le produit, la réaction est la suivante :
A+E ⇆ (E-A) ⇆ (E-P) ⇆ P+E
Cinétique à plusieurs substrats
Il existe des enzymes avec deux substrats et deux produits appelés bi/bi
Différents modèles existent suivant les enzymes : soient A et B les réactifs, P et Q les produits, E l'enzyme.
- cinétique bi/uni :
A+B+E ⇆ (E-A)+B ⇆ (E-A-B) ⇆ (E-P-Q) ⇆ E+P+Q si la fixation est ordonnée
ou
A+B+E ⇆ (E-A-B) ⇆ (E-P-Q) ⇆ E+P+Q si elle n'est pas ordonnée
ces enzymes sont le plus souvent des ligases comme l'ATP synthase, ADP+Pi ⇆ ATP (où Pi = phosphate inorganique)
- cinétique ordonnée :
A+B+E ⇆ (E-A)+B ⇆ (E-A-B) ⇆ (E-P-Q) ⇆ (E-Q)+P ⇆ P+Q+E
les formes entre parenthèses signifie qu'il s'agit de complexes enzyme-substrat(s) il n'y a qu'un ordre de réaction
- cinétique aléatoire :
A+B+E ⇆ (E-A-B) ⇆ P+Q+E
Il n'y a pas d'ordre de fixation, les complexes peuvent se dissocier avant la réaction et se reformer dans un ordre différent.
- cinétique de Théorel Chance :
A+B+E ⇆ (E-A)+B ⇆ (E-P)+B ⇆ E'+P+B ⇆ (E'-B)+P ⇆ (E-Q)+P ⇆ P+Q+E
E' est la même enzyme mais ayant changé de conformation. C'est le cas par exemple de l'alcool déshydrogénase.
- cinétique dite ping pong :
A+B+E ⇆ (E-A)+B ⇆ (E-P)+B ⇆ (E-B)+P ⇆ (E-Q)+P ⇆ P+Q+E
Le départ de P du site actif est déclenché par l'arrivée de B.
Contrôle de l'activité enzymatique
Conditions du milieu réactionnel
Certaines conditions du milieu réactionnel modifient l'activité de l'enzyme :
- le pH ;
- la force ionique ;
- la présence d'activateurs ou d'inhibiteurs ;
- la concentration en substrat ;
- la température de réaction d'après la loi d'Arrhenius et suivant la température de dénaturation de l'enzyme.
Inhibition et activation
Inhibition compétitive : arrive lorsque deux composés (substrats) veulent se lier à la même enzyme. Les deux substrats peuvent être en compétition pour le même site car ils ont une configuration spatiale (partiellement) identique et peuvent tous les deux accéder au site catalytique (on peut faire l'analogie avec deux clés semblables qui peuvent ouvrir la même serrure). Il se peut aussi que les sites de fixation des deux substrats soient différents mais que la fixation du premier entraîne une gêne stérique qui empêche le deuxième substrat de se fixer. On peut également citer le chevauchement partiel : lorsque les deux substrats ont un groupement commun qui se fixe à l'enzyme sur un site de fixation unique.
Il se peut aussi que le substrat compétitif se lie au site catalytique sans être modifié. Si l'enzyme est saturée par un substrat, l'autre (d'affinité moindre, donc ayant un Kd plus élevé) ne sera pas catalysé d'où le terme compétitif. Il pourra par contre le déplacer par action de masse (i.e si sa concentration est beaucoup plus forte il le déplacera même si son Kd est plus élevé).
Exemple : il y a compétition entre méthacholine et acétylcholine car elles ont toutes les deux un groupement choline qui active l'enzyme. Il en résulte: E+S1+S2→ES1+ES2→E+P1+P2 (les réactions sont réversibles)
Inhibition non compétitive : arrive lorsqu'un agent non relié au substrat est capable de lier l'enzyme au niveau de son site allostérique. Cela laisse le site catalytique vacant, mais va souvent en modifier sa configuration spatiale. Cela peut empêcher la liaison enzyme substrat de se faire au niveau du site actif ou entrainer la liaison. Tout dépend de si le changement de configuration au niveau du site catalytique augmente l'affinité du substrat pour le dernier (active l'enzyme) ou la diminue.
Interactions coopératives et allostériques
1. C'est le cas des enzymes possédant des sous unités ou protomères (toujours par nombre pair). Ces enzymes ont une cinétique particulière. Leur fonctionnement n'est pas michaélien et l'affinité pour le substrat augmente de manière non linéaire avec la concentration en substrat.
Cette cinétique particulière provient de transconformations spatiales, il existe une transition allostérique entre deux formes extrêmes :
- tendue, l'enzyme est la moins affine pour son substrat.
- relâchée, l'enzyme est très affine pour son substrat.
L'allostérie est à l'origine de régulations. Dans le métabolisme cellulaire par exemple, lors de la glycolyse, la phosphofructokinase-1 est régulée de manière allostérique par l'ATP lors de la synthèse de fructose-1,6-biphosphate.
Attention, il existe des enzymes possédant des sous unités n'étant pas allostériques : phosphatase alcaline, β-galactosidase.
2. Description de la cinétique, La courbe Vi=f([S]) soit Vitesse initiale en fonction de la concentration en substrat est d'allure sigmoïde, lors de faibles concentrations en substrat, l'affinité est faible, lors de fortes concentrations en substrat, l'affinité est maximale (on est à Vmax). L'affinité augmente le plus à 1/2 de Vmax où on peut noter une valeur particulière analogue au km le K50.
3. Équation de Hill,
i étant un indice de coopérativité, plus il est grand, plus l'allure de la courbe est sigmoïde, si i=1, on retombe sur l'équation de Michaelis, l'enzyme n'est pas allostérique.
rqi : i est différent du nombre de protomères.
4. Origine du phénomène, La fixation d'une première molécule de substrat sur l'enzyme lui permet d'acquérir une conformation moins tendue ce qui permet à une seconde molécule de substrat de se fixer et ainsi de suite jusqu'à ce que tous les sites de chaque protomère soient saturés.
Références
- Portail de la biochimie