Cellules MDCK
Les cellules MDCK (Madin-Darby Canine Kidney) sont une lignée cellulaire modèle utilisée dans la recherche en biologie et biophysique des épithéliums. Elles sont étudiées pour comprendre notamment la polarité cellulaire, les adhérences cellule-cellule (appelées jonctions adhérentes), la motilité cellulaire collective, ainsi que les réponses aux facteurs de croissance. C'est l'un des rares modèles de culture cellulaire qui convient à la culture cellulaire 3D et aux réarrangements multicellulaires connus sous le nom de morphogenèse ramifiée[1].
Histoire
Suite à l'isolement initial en 1958 des cellules épithéliales du tubule rénal d'un chien Cocker Spaniel adulte par SH Madin et NB Darby[2], la lignée cellulaire portant leur nom a été utilisée principalement comme modèle pour l'infection virale des cellules de mammifères. [3],[4] En effet, ils ont choisi d'isoler les tubules rénaux avec précisément cet objectif en tête, car ils avaient déjà réussi avec une infection virale de cellules dérivées de tubules rénaux d'autres mammifères. [5] Ainsi, l'objectif initial en isolant et en cultivant des cellules à partir de ce tissu n'était pas de générer un nouveau système modèle pour la biologie des cellules épithéliales. Ce n'est qu'en 1970 que le laboratoire de Zbynek Brada a publié des travaux décrivant les cellules MDCK comme une lignée cellulaire représentative portant les caractéristiques des cellules épithéliales des tubules rénaux[6]. Ils ont basé cette conclusion sur les activités de transport de fluide des monocouches formées de cellules MDCK, la présence de microvillosités sur leur surface apicale (supérieure) et leur capacité à s'auto-organiser, lorsqu'elles sont cultivées en 3D, en sphères creuses.
Au cours des années 1970, la lignée cellulaire MDCK a trouvé une nouvelle utilisation comme modèle pour le tissu épithélial de mammifères. En 1982, Mina Bissell et ses collègues ont montré que les monocouches MDCK répondaient à l'ajout d'un recouvrement de collagène (appelé «culture sandwich») en proliférant et en formant des tubules creux[7]. Cela laissait entendre pour la première fois que la lignée cellulaire répondrait aux environnements 3D en s'auto-organisant dans la structure 3D appropriée rappelant les tubules rénaux. Au cours des années suivantes, la culture de cellules MDCK entièrement intégrées dans le collagène s'est avérée donner des sphères creuses, ou acini[8]. C'étaient de simples monocouches épithéliales avec un intérieur et un extérieur définis. Cependant, le fait que les cellules MDCK ne formaient pas de tubules dans ces conditions est resté inexpliqué jusqu'à plus tard.
Au cours de la même période dans les années 1980, les biologistes étudiant la motilité cellulaire avaient découvert un comportement intéressant et reproductible des cellules en culture: la réponse de dispersion. Les cellules épithéliales en culture se développent normalement sous forme d'amas serrés. Cependant, ils pourraient être amenés à rompre les contacts cellule-cellule et à devenir allongés et mobiles après exposition à un "facteur de dispersion" qui était sécrété par des cellules mésenchymateuses telles que les fibroblastes 3T3[9]. Cela a été mieux décrit par le groupe de Julia Gray en 1987[10]. Au cours de la même période au milieu des années 1980, le groupe de Walter Birchmeier a montré qu’un anticorps monoclonal perturbe les contacts cellule-cellule et modifie la polarité avant-arrière des cellules en culture[11],[12]. La cible de cet anticorps a ensuite été identifiée comme un composant des jonctions cellule-cellule, la E-cadhérine[13]. Ces observations disparates ont finalement fusionné dans un paradigme pour la motilité cellulaire et la polarité cellulaire : les cellules épithéliales sont généralement non mobiles, mais peuvent devenir mobiles en inhibant les jonctions cellule-cellule ou en ajoutant des facteurs de croissance qui induisent la dispersion[14]. Les deux sont réversibles et impliquent tous deux la rupture des jonctions cellule-cellule.
En 1991, la réponse des acini de MDCK en culture 3D au facteur de dispersion a été rapportée pour la première fois par Lelio Orci et ses collègues. [15] Ils ont cultivé des acini de cellules MDCK dans des gels de collagène avec ou sans fibroblastes 3T3, dans lesquels les milieux pouvaient s’échanger mais les types de cellules n'étaient pas en contact direct. Cette stratégie de culture cellulaire, appelée coculture, a induit les acini MDCK à subir une morphogenèse de ramification, dans laquelle les cellules se réorganisent en un réseau de tubules interconnectés qui ressemble au développement de nombreux tissus. [16] La même année, le «facteur de dispersion» s'est avéré être une protéine précédemment décrite sécrétée par les fibroblastes, le facteur de croissance des hépatocytes (HGF)[17]. Ce travail a résolu un mystère exceptionnel de la culture MDCK, car le tissu à partir duquel ces cellules sont dérivées est tubulaire, mais elles ne s'étaient auparavant développées qu'en acini sphériques en culture 3D. Au-delà de ce paradoxe immédiat, un lien crucial a été tissé entre l'induction aiguë de la motilité cellulaire en culture 2D par le «facteur de dispersion», et son impact sur l'organisation spatiale adoptée par les tissus en 3D.
Morphogenèse ramifiée
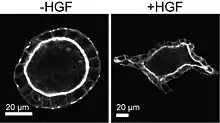
Au cours des 20 dernières années, la compréhension de la biologie cellulaire MDCK en culture 3D a été notamment avancée par le laboratoire de Keith Mostov. Ce groupe s'est concentré sur la régulation de la polarité cellulaire et ses effets en aval sur la morphogenèse de ramification[18],[1]. En effet, l'ensemble des travaux générés par le groupe Mostov a réussi à synthétiser des décennies de connaissances sur la ségrégation spatiale des fonctions cellulaires, et leurs marqueurs moléculaires, en un modèle remarquable pour la génération et l'homéostasie de la polarité cellulaire dans les tissus. [19],[20] En 2003, le groupe de Mostov a rapporté le premier compte rendu complet liant la morphogenèse ramifiée avec les caractéristiques de la polarité apico-basale[21]. Ce travail a établi que les cellules MDCK ne perdent pas les contacts avec les voisines pendant le début de la morphogenèse ramifiée, mais que les marqueurs canoniques de la polarité cellulaire sont perdus de façon transitoire. Un résultat de ce changement de polarité est la réorientation de la division cellulaire le long d'une nouvelle branche de cellules en croissance, afin de positionner correctement les cellules filles pour continuer l'extension de branche. La motilité cellulaire par laquelle les cellules MDCK produisent et allongent les branches était liée à ces changements de polarité.
Ces résultats ont été intégrés dans un modèle de morphogenèse de branchement axé sur le réarrangement transitoire de la signalisation de la polarité cellulaire. Cela permet aux cellules normalement non mobiles de générer des protubérances et de migrer collectivement, suivies d'une redifférenciation et de la formation de tubules creux. À l'appui de ce modèle, Mostov et ses collègues ont identifié les effets du HGF sur les acini MDCK comme provoquant une transition partielle des phénotypes des cellules épithéliales aux phénotypes de cellules mésenchymateuses. [22] Cet argument rassemble un programme de signalisation établi appelé la transition épithéliale à mésenchymateuse (EMT), par laquelle les cellules épithéliales sessiles deviennent mobiles et rompent les contacts cellule-cellule[14]. L’EMT a été proposé comme étant la cascade de signalisation transcriptionnelle qui entraîne la dispersion cellulaire[23],[24]. Compte tenu de la distinction que, pour les acini en 3D, les jonctions cellule-cellule ne se rompent pas, on ne sait pas comment relier précisément le concept de l’EMT avec la morphogenèse de ramification.
Le groupe Mostov a également étudié les moyens par lesquels le HGF active la motilité cellulaire au cours de la morphogenèse de ramification des MDCK. [25],[26] Leurs études ont montré que la morphogenèse ramifiée nécessite le facteur de transcription ERK, en aval de la cascade de signalisation de la voie MAPK/ERK, une voie de transduction du signal bien définie impliquée dans la motilité et la prolifération cellulaire[27]. La machinerie précise de motilité cellulaire responsable de la morphogenèse de ramification de MDCK n'a pas été spécifiée par le groupe Mostov, au-delà de l'exigence d'une protéine de signalisation impliquée dans la régulation de la GTPase Rho. De plus, le laboratoire Gardel a montré que la motilité invasive des cellules MDCK chez les acini nécessite Dia1, qui régule les adhérences cellulaires aux fibrilles de collagène individuelles.
Pendant ce temps, d'autres groupes ont démontré la nécessité de protéines d'adhérence entre cellule et matrice extra-cellulaire ou de leurs régulateurs pour la morphogenèse de ramification des MDCK. [28],[29] En utilisant un protocole modifié pour la culture de cellules MDCK et la morphogenèse de ramification, Gierke et Wittman ont établi l’importance de la dynamique des microtubules dans la régulation des premières étapes de la ramification[30]. Ils ont observé une adhérence dégradée entre les cellules et la matrice de collagène lorsque les microtubules étaient dérégulés. Ce phénotype a indiqué l'importance du trafic des protéines appropriées d'adhérence cellulaire et de protrusion vers le front cellulaire lorsque la morphogenèse de ramification a été initiée. Combinés aux observations du groupe Mostov, ces travaux ont confirmé que la polarité cellulaire est indispensable pour l'homéostasie des MDCK en acinus ainsi que les comportements migratoires lors de la morphogenèse de branchement.
Références
- Erin O'Brien, Zegers et Mostov, « Building epithelial architecture: insights from three-dimensional culture models », Nature Reviews Molecular Cell Biology, vol. 3, , p. 531–537 (DOI 10.1038/nrm859)
- « ATCC », ATCC (consulté le )
- Lehmann-Grube, « A Sensitive Plaque Assay for Influenza Viruses », Virology, vol. 21, , p. 520–522 (DOI 10.1016/0042-6822(63)90219-8)
- Moulton et Frazier, « Deoxyribonucleic acid and protein changes in dog kidney cells infected with infectious canine hepatitis virus », Virology, vol. 15, , p. 91–101 (DOI 10.1016/0042-6822(61)90226-4)
- Karl Matlin, PhD, personal communication
- Leighton, Estes, Mansukhani et Brada, « A cell line derived from normal dog kidney (MDCK) exhibiting qualities of papillary adenocarcinoma and of renal tubular epithelium », Cancer, vol. 26, , p. 1022–8 (PMID 4248968, DOI 10.1002/1097-0142(197011)26:5<1022::aid-cncr2820260509>3.0.co;2-m)
- Hall, Farson et Bissell, « Lumen formation by epithelial cell lines in response to collagen overlay: a morphogenetic model in culture », Proc Natl Acad Sci U S A, vol. 79, , p. 4672–6 (PMID 6956885, PMCID 346738, DOI 10.1073/pnas.79.15.4672)
- McAteer, Evan et Gardner, « Morphogenetic clonal growth of kidney epithelial cell line MDCK », The Anatomical Record, vol. 217, , p. 229–239 (DOI 10.1002/ar.1092170303)
- Stoker et Perryman, « An epithelial scatter factor released by embryo fibroblasts », J Cell Sci, vol. 77, , p. 209–23 (PMID 3841349)
- Stoker, Gherardi, Perryman et Gray, « Scatter factor is a fibroblast-derived modulator of epithelial cell mobility », Nature, vol. 327, , p. 239–242 (DOI 10.1038/327239a0)
- Behrens, Birchmeier, Goodman et Imhof, « Dissociation of Madin-Darby canine kidney epithelial cells by the monoclonal antibody anti-arc-1: mechanistic aspects and identification of the antigen as a component related to uvomorulin », J Cell Biol, vol. 101, , p. 1307–15 (PMID 2995405, PMCID 2113935, DOI 10.1083/jcb.101.4.1307)
- Imhof, Vollmers, Goodman et Birchmeier, « Cell-cell interaction and polarity of epithelial cells: specific perturbation using a monoclonal antibody », Cell, vol. 35, , p. 667–675 (DOI 10.1016/0092-8674(83)90099-5)
- Behrens, Mareel, Van Roy et Birchmeier, « Dissecting tumor cell invasion: epithelial cells acquire invasive properties after the loss of uvomorulin-mediated cell-cell adhesion », J Cell Biol, vol. 108, , p. 2435–47 (PMID 2661563, PMCID 2115620, DOI 10.1083/jcb.108.6.2435)
- Paul Thiery, « Epithelial-mesenchymal transitions in development and disease », Cell, vol. 139, , p. 871–890 (PMID 19945376, DOI 10.1016/j.cell.2009.11.007)
- Montesano, Schaller et Orci, « Induction of epithelial tubular morphogenesis in vitro by fibroblast-derived soluble factors », Cell, vol. 66, , p. 697–711 (DOI 10.1016/0092-8674(91)90115-F)
- Affolter, Zeller et Caussinus, « Tissue remodelling through branching morphogenesis », Nature Reviews Molecular Cell Biology, vol. 10, , p. 831–842 (DOI 10.1038/nrm2797)
- Weidner, Arakaki, Hartmann et Vandekerckhove, « Evidence for the identity of human scatter factor and human hepatocyte growth factor », Proc Natl Acad Sci U S A, vol. 88, , p. 7001–5 (PMID 1831266, PMCID 52221, DOI 10.1073/pnas.88.16.7001)
- Bryant et Mostov, « From cells to organs: building polarized tissue », Nat Rev Mol Cell Biol, vol. 9, , p. 887–901 (PMID 18946477, PMCID 2921794, DOI 10.1038/nrm2523)
- Martin-Belmonte, Gassama, Datta et Yu, « PTEN-mediated apical segregation of phosphoinositides controls epithelial morphogenesis through Cdc42 », Cell, vol. 128, , p. 383–397 (PMCID 1865103, DOI 10.1016/j.cell.2006.11.051)
- Bryant, Roignot, Datta et Overeem, « A molecular switch for the orientation of epithelial cell polarization », Developmental Cell, vol. 31, , p. 171–187 (DOI 10.1016/j.devcel.2014.08.027)
- Yu, O'Brien, Wang et Bourne, « Hepatocyte growth factor switches orientation of polarity and mode of movement during morphogenesis of multicellular epithelial structures », Molecular Biology of the Cell, vol. 14, , p. 748–763 (PMCID 150005, DOI 10.1091/mbc.E02-06-0350)
- Zegers, O'Brien, Yu et Datta, « Epithelial polarity and tubulogenesis in vitro », Trends in Cell Biology, vol. 13, , p. 169–176 (DOI 10.1016/S0962-8924(03)00036-9)
- Janda, Lehmann, Killisch et Jechlinger, « Ras and TGFβ cooperatively regulate epithelial cell plasticity and metastasis », The Journal of Cell Biology, vol. 156, , p. 299–314 (DOI 10.1083/jcb.200109037)
- Kalluri, « Epithelial-mesenchymal transition and its implications for fibrosis », Journal of Clinical Investigation, vol. 112, , p. 1776–1784 (PMID 14679171, PMCID 297008, DOI 10.1172/JCI20530)
- Erin O'Brien, « ERK and MMPs sequentially regulate distinct stages of epithelial tubule development », Developmental Cell, vol. 7, , p. 21–32 (PMID 15239951, DOI 10.1016/j.devcel.2004.06.001)
- Kim, Shewan, Ewald et Werb, « p114RhoGEF governs cell motility and lumen formation during tubulogenesis through a ROCK–myosin-II pathway », Journal of Cell Science, vol. 128, , p. 4317–4327 (DOI 10.1242/jcs.172361)
- Vial, Sahai et Marshall, « ERK-MAPK signaling coordinately regulates activity of Rac1 and RhoA for tumor cell motility », Cancer Cell, vol. 4, , p. 67–79 (DOI 10.1016/S1535-6108(03)00162-4)
- Hunter et Zegers, « Pak1 regulates branching morphogenesis in 3D MDCK cell culture by a PIX and β1-integrin-dependent mechanism », American Journal of Physiology. Cell Physiology, vol. 299, , C21–C32 (PMCID 2904258, DOI 10.1152/ajpcell.00543.2009)
- Jiang, Chiu, Chen et Chuang, « Role of α 3 β 1 integrin in tubulogenesis of Madin-Darby canine kidney cells », Kidney International, vol. 59, , p. 1770–1778 (DOI 10.1046/j.1523-1755.2001.0590051770.x)
- Gierke et Wittmann, « EB1-recruited microtubule+ TIP complexes coordinate protrusion dynamics during 3D epithelial remodeling », Current Biology, vol. 22, , p. 753–762 (DOI 10.1016/j.cub.2012.02.069)
- Portail de la biologie cellulaire et moléculaire